基于miR-223/NLRP3 轴研究柚皮素对氧诱导视网膜病变中小胶质细胞活化的影响
楚瑞雪,孙先桃,王 惠
(郑州大学附属儿童医院,河南省儿童医院,郑州儿童医院眼科,郑州 450000)
早产儿视网膜病变(retinopathy of prematurity,ROP)是发生在早产儿、低出生质量儿的视网膜血管异常增生疾病,现已成为儿童致盲和视力损伤的主要原因[1]。目前治疗ROP的主要方法包括抗血管内皮生长因子、激光术、冷凝术等,但治疗后部分患儿仍出现视觉异常甚至失明现象[2],因此,探求更有效的治疗方法是临床上ROP治疗关键。随着研究深入,发现小胶质细胞异常活化可以影响视网膜新生血管的形成,且炎症能够激活小胶质细胞异常活化[3-4],推测炎症可能是ROP形成的原因之一。柚皮素(naringenin,NAR)作为抗炎、抗氧化的黄酮类化合物,能够通过抑制小胶质细胞的活化从而缓解小鼠记忆功能[5],但其在ROP中的作用机制尚未发现研究。微小RNA(microRNA,miR)-223在单核/巨噬细胞和胚胎干细胞分化、破骨细胞形成等方面发挥重要作用,研究发现,上调miR-223后可以抑制核苷酸结合寡聚化结构域样受体蛋白3(nucleotide-binding oligomerization domain-like receptor protein3,NLRP3)炎症体表达,进而可以改善脂多糖诱导的小胶质细胞的过度活化现象[6],推测NAR亦可能通过miR-223/NLRP3轴发挥作用。因此,本文建立氧诱导视网膜病变(oxygen induced retinopathy,OIR)模型,通过体内实验观察NAR对OIR的影响,并初步探讨其作用机制,为临床上ROP的治疗提供参考依据。
1 材料和方法
1.1 实验动物
30只健康成年SPF级C57BL/6J小鼠(雌性:雄性=2∶1),8周龄,体重(23±2)g,均购自中国医学科学院医学生物学研究所[SCXK(滇)K2019-0002]。小鼠均在郑州大学(药物研究院)动物实验室饲养[SYXK(豫)2018-0004],饲养条件:单个分笼饲养,均在温度(25.0±0.5)℃、湿度(45±5)%、12 h光照12h黑暗条件下自由饮食摄水,并保持饲养环境透气、干净。20只雌性小鼠和10只雄性小鼠适应性饲养1周后,按雌雄2∶1合笼交配,雌性小鼠怀孕后取出单独饲养,并足日龄产下幼鼠,其中150只幼鼠母乳喂养至7日龄(postnatal7,P7),进行随机分组,开始后续实验。实验动物符合3R原则,经本院动物伦理审查委员会审查(IACUC:2020090123),符合动物伦理。
1.2 主要试剂与仪器
羧甲基纤维素钠(sodium carboxymethyl cellulose,CMC)(伊士曼,执行标准:GB/T5005-2001);NAR(美国Sigma公司,批号:192025,纯度≥95%);miR-223拮抗剂阴性对照、miR-223拮抗剂均购自广州锐博生物科技公司;miRNA提取分离试剂盒、miRNA反转录试剂盒(TIANGEN,批号分别为:20201006、20201205);荧光素钠注射液(广州白云山明兴制药有限公司,批号:20190206);一抗小胶质细胞标志物钙离子结合蛋白-1(ionized calcium binding adapter-1,Iba-1)、NLRP3、半胱氨酸天冬氨酸蛋白酶-1(cysteinyl aspartate specific proteinase-1,Caspase-1)、白细胞介素(interleukin,IL)-1β、IL-18,Alexa Fluor®488标记的荧光二抗(英国abcam公司,批号分别为:12-NOV-2019、05-DEC-2020、26-JAN-2020、08-Nov-2019、02-NOV-2020、09-FEB-2020)。眼底荧光造影仪(上海伊沐医疗器械有限公司,型号:SK-650B);实时荧光定量PCR(real time quantitative PCR,RT-qPCR)仪(美国ABI公司,型号:StepOnePlus);蛋白凝胶成像仪(赛默飞世尔,型号:iBright CL750)。
1.3 实验方法
1.3.1 动物建模与分组
实验前所有幼鼠均用眼科裂隙灯观察眼部,均未发现异常。150只幼鼠按照随机数字表法分为常氧组、OIR组、NAR组、NAR+阴性对照组、NAR+miR-223拮抗剂组,每组30只。除常氧组外,其余各组参考文献[7],幼鼠及其母鼠在P7~P12移至封闭氧箱中,氧气体积分数(75±2)%,连续5d,P12返回正常氧环境中。常氧组在正常氧环境中常规饲养。
250mg CMC溶于ddH2O中,定容至100mL过夜。1.0g NAR溶于含CMC的溶剂中,定容100 mL,配置成10mg/mL溶液备用。NAR组幼鼠腹腔注射100mg/(kg·d)NAR,NAR+阴性对照组在NAR基础上P12尾静脉注射2.5mg/kg miR-223拮抗剂阴性对照,NAR+miR-223拮抗剂组在NAR基础上P12尾静脉注射2.5mg/kg miR-223拮抗剂,常氧组、OIR组每天腹腔注射等体积CMC、P12尾静脉注射等体积生理盐水。P17检测幼鼠各项指标。
1.3.2 RT-qRCR检测视网膜中miR-223水平
每组随机取10只,小心取下视网膜,置于-80℃冰箱保存备用;miRNA提取试剂盒提取miRNA,非变性凝胶电泳检测提取质量,miRNA反转录试剂盒将miRNA反转录成cDNA。miR-223上游引物:5’-GGTGGTGAATACCCTCCTG-3’,下游引物:5’-GTCTGTCCGTGGTGCTGA-3’;U6上游引物:5’-AAGACGGGCGGAGAGAAACC-3’,下游引物:5’-CGTTGACTCCGACCTTCACC-3’。RT-qPCR仪检测miR-223水平。20μL反应体系:50ng/μL cDNA1μL,10μmol/L上游引物/下游引物0.5μL/0.5μL,2×Hi SYBR Green QPCR Mix10μL,ddH2O 8.0μL。反应条件:95℃、5min;94℃、50s,59℃、30s,40个循环,72℃、10min。2-ΔΔCT法计算miR-223水平。
1.3.3 荧光素眼底血管造影(fundus fluorescein angiography,FFA)检查
每组随机取10只,幼鼠散瞳、2mL/kg10%荧光素钠注射液腹腔注射,待荧光素钠循环至眼底时,眼底荧光造影仪以视盘和激光光凝为中心对幼鼠行FFA检查。
1.3.4 HE染色观察视网膜形态
每组取剩余10只,处死后取眼球,置于4%多聚甲醛中固定。左眼球石蜡包埋后平行眼轴方向连续切片(切片厚度5μm),切片经二甲苯脱蜡、梯度乙醇水化、苏木精染色、1%盐酸乙醇分色后,伊红染色,再经梯度乙醇脱水、二甲苯透明,封片观察。
1.3.5 免疫荧光检测视网膜中Iba-1表达情况
4%多聚甲醛中固定的右眼球在4℃经20%和30%蔗糖溶液脱水,冰冻切片机平行眼轴方向连续切片(切片厚度6μm),切片经0.3% Trition处理30min,加入山羊血清37℃封闭1h,随后加入一抗Iba-1(1∶1000),第2天洗去一抗滴加荧光二抗(1∶500)室温孵育1h,统计单位面积Iba-1阳性细胞数。
1.3.6 Western blot检测视网膜中NLRP3、Caspase-1、IL-1β及IL-18蛋白表达情况
-80℃中取出视网膜,加100μL组织匀浆液匀浆,10000r/min4℃离心20min,上清(即为总蛋白)置于新的离心管中,每孔上样20μg,凝胶电泳分离蛋白,PVDF膜转膜,5%脱脂奶粉室温封闭2h,PBST清洗后分别添加一抗NLRP3(1∶1000)、Caspase-1(1∶1000)、IL-1β(1∶500)、IL-18(1∶500),4℃孵育过夜;PBST清洗后加入对应二抗,室温孵育1h。DAB显色试剂盒避光显色,蛋白凝胶成像仪拍照和定量分析。
1.4 统计学方法
统计学软件GraphPad Prism8.0进行数据分析,计量数据以平均数±标准差(±s)描述,多组间比较用单因素方差分析,组间两两比较采用SNK-q法。P<0.05,差异有统计学意义。
2 结果
2.1 NAR对视网膜中miR-223水平的影响
与常氧组相比,OIR组视网膜中miR-223水平降低(P<0.05);与OIR组相比,NAR组、NAR+阴性对照组视网膜中miR-223水平升高(P<0.05);分别与NAR组、NAR+阴性对照组相比,NAR+miR-223拮抗剂组视网膜中miR-223水平降低(P<0.05)。见表1。
2.2 NAR对FFA的影响
常氧组荧光分布均匀;OIR组出现血管破裂(黑色箭头),荧光漏在视网膜中,视网膜泛白,血管出现收缩;NAR组、NAR+阴性对照组血管破裂现象缓解,视网膜泛白现象减轻;NAR+miR-223拮抗剂组血管破裂,荧光漏在视网膜中,视网膜泛白明显。见图1。

图1 5组幼鼠FFA情况Figure1 FFA situation of the young mice of5groups
2.3 NAR对视网膜形态的影响
常氧组各层次细胞排列整齐且紧密;OIR组视网膜厚度变厚、细胞排列松散,部分出现细胞缺失现象、血管新生现象(黑色箭头);NAR组、NAR+阴性对照组视网膜变厚、细胞松散现象存在,未见新生血管;NAR+miR-223拮抗剂组细胞松散严重、细胞缺失明显。见图2。
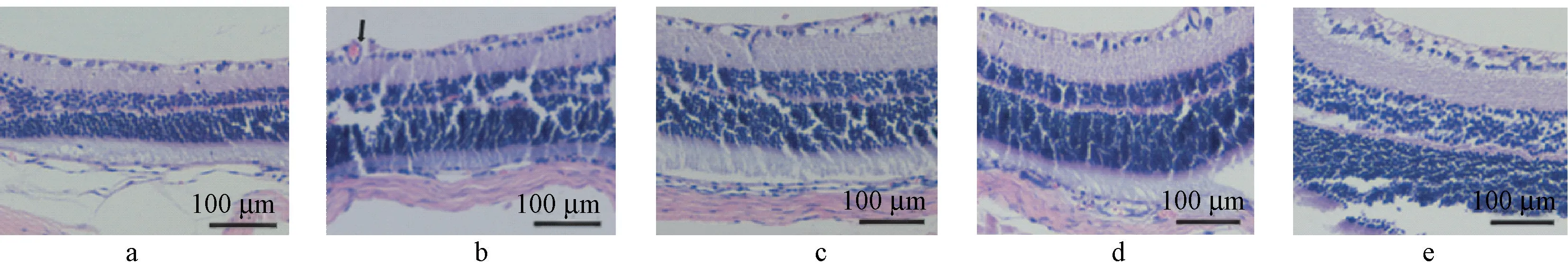
图2 5组幼鼠视网膜形态情况(HE染色)Figure2 Morphology of retina in the young mice of5groups(HE staining)
2.4 NAR对视网膜中Iba-1表达的影响
与常氧组相比,OIR组视网膜中Iba-1水平升高(P<0.05);与OIR组相比,NAR组、NAR+阴性对照组视网膜中Iba-1水平降低(P<0.05);分别与NAR组、NAR+阴性对照组相比,NAR+miR-223拮抗剂组视网膜中Iba-1水平升高(P<0.05)。见图3、表1。

图3 5组幼鼠视网膜中Iba-1表达情况(免疫荧光)Figure3 Iba-1expression in the retina of the young mice of5groups(immunofluorescence)
表1 5组视网膜中miR-223水平及Iba-1表达比较(±s,n=10)Table1 Comparison of miR-223levels and Iba-1in the retinas of the5groups

表1 5组视网膜中miR-223水平及Iba-1表达比较(±s,n=10)Table1 Comparison of miR-223levels and Iba-1in the retinas of the5groups
注:与常氧组相比,#P<0.05;与OIR组相比,∗P<0.05;与NAR组相比,△P<0.05;与NAR+阴性对照组相比,▲P<0.05。Note.Compared with normal oxygen group,#P<0.05.Compared with OIR group,∗P<0.05.Compared with NAR group,△P<0.05.Compared with NAR+negative control group,▲P<0.05.
组别Groups miR-223 Iba-1(cells/mm2)常氧组Normal oxygen group 1.01±0.12 15.35±2.71 OIR组OIR group 0.38±0.05# 83.43±11.75#NAR组NAR group 0.74±0.07∗ 28.56±3.16∗NAR+阴性对照组NAR+negative control group 0.75±0.06∗ 30.15±4.48∗NAR+miR-223拮抗剂组NAR+miR-223antagomir group 0.26±0.03△▲ 76.18±8.15△▲
2.5 NAR对视网膜中NLRP3、Caspase-1、IL-1β、IL-18蛋白表达的影响
与常氧组相比,OIR组视网膜中NLRP3、Caspase-1、IL-1β、IL-18蛋白水平升高(P<0.05);与OIR组相比,NAR组、NAR+阴性对照组视网膜中NLRP3、Caspase-1、IL-1β、IL-18蛋白水平降低(P<0.05);分别与NAR组、NAR+阴性对照组相比,NAR+miR-223拮抗剂组视网膜中NLRP3、Caspase-1、IL-1β、IL-18蛋白水平升高(P<0.05)。见图4、表2。
表2 5组幼鼠视网膜中NLRP3、Caspase-1、IL-1β、IL-18蛋白表达比较(±s,n=10)Table2 Comparison of NLRP3,Caspase-1,IL-1β and IL-18protein expression in the retina of young mice in the5groups

表2 5组幼鼠视网膜中NLRP3、Caspase-1、IL-1β、IL-18蛋白表达比较(±s,n=10)Table2 Comparison of NLRP3,Caspase-1,IL-1β and IL-18protein expression in the retina of young mice in the5groups
注:与常氧组相比,#P<0.05;与OIR组相比,∗P<0.05;与NAR组相比,△P<0.05;与NAR+阴性对照组相比,▲P<0.05。Note.Compared with normal oxygen group,#P<0.05.Compared with OIR group,∗P<0.05.Compared with NAR group,△P<0.05.Compared with NAR+negative control group,▲P<0.05.
组别Groups NLRP3 Caspase-1 IL-1β IL-18常氧组Normal oxygen group 0.56±0.08 0.09±0.01 0.05±0.01 0.21±0.03 OIR组OIR group 1.13±0.12# 1.56±0.17# 1.73±0.18# 1.03±0.11#NAR组NAR group 0.69±0.08∗ 0.24±0.03∗ 0.45±0.05∗ 0.31±0.03∗NAR+阴性对照组NAR+negative control group 0.70±0.06∗ 0.26±0.04∗ 0.46±0.06∗ 0.32±0.04∗NAR+miR-223拮抗剂组NAR+miR-223antagomir group 1.02±0.05△▲ 1.05±0.10△▲ 0.81±0.09△▲ 0.93±0.08△▲

图4 5组幼鼠视网膜中NLRP3、Caspase-1、IL-1β、IL-18蛋白表达情况Figure4 NLRP3,Caspase-1,IL-1β,IL-18protein expression in the retina of young mice in the5groups
3 讨论
ROP又称晶状体后纤维增生症,是视网膜正常血管化停滞,新生血管异常增生,严重情况下会牵拉视网膜脱落,损害视力,甚至失明,即使患儿未失明,视网膜光感受器细胞发育异常,患儿出现斜视、弱视、屈光不正等的几率也极高[8]。随着研究深入,发现感染在ROP发生、发展中起一定作用,骨髓造血干细胞来源的巨噬细胞迁移至视网膜中并分化成小胶质细胞。小胶质细胞能够参与免疫系统的免疫监视,损伤情况下小胶质细胞激活,在初期可以作为抗原呈递细胞,吞噬坏死的视网膜神经节细胞碎片,但小胶质细胞过度激活还可分泌一系列炎症因子,发挥炎症作用[9-10]。且在ROP中小胶质细胞过度活化传递缺氧信号,促进视网膜血管新生[11]。本研究以小鼠出生7d幼鼠为研究对象,OIR处理模拟ROP症状,研究发现,OIR中FFA可见血管破裂严重,荧光漏在视网膜中,视网膜泛白,血管出现收缩现象;HE染色可见视网膜出现血管新生现象、细胞排列紊乱,提示OIR在一定程度上可以模拟ROP现象。研究发现,小胶质细胞主要集中在神经纤维层、内核层和外丛状层,本研究对小胶质细胞标志物Iba-1免疫荧光染色发现,在常氧组中仅有少量活化的小胶质细胞,可能用于对正常代谢的视网膜碎片进行清理,但在OIR组中视网膜相同部位出现大量活化的小胶质细胞,可能影响血管破裂、增生。中医作为传统医学,中草药的治疗对于疾病意义重大,其中NAR作为中药中重要成分,广泛存在于植物和中药中,研究发现,其在糖尿病视网膜病变大鼠氧化损伤、细胞凋亡等过程中发挥重要作用[12]。在本研究中,NAR可以减轻血管新生现象,降低小胶质细胞活化现象,从而缓解OIR,但其具体机制尚需进一步研究。
miRNA存在于哺乳动物体内,通过转录后基因表达从而参与调控表观遗传[13],miR-223一直认为是与造血、免疫相关的特异性miRNA,miR-223存在于血管内皮细胞中,在血管新生中处于下调状态,能够拮抗血管新生[14];作为髓系细胞中表达miRNA,能够调控免疫细胞发育和维持免疫细胞稳态[15],能够通过调控多种炎症相关因子表达从而调控单核细胞的分化和巨噬细胞极化[16]。NLRP3作为miR-223的靶基因之一[17],是中枢神经系统炎症小体,可触发炎症反应过程,在OIR视网膜中处于高表达状态[18]。NLRP3可以与效应分子结合形成成熟的炎症小体和成熟的Caspase-1,Caspase-1作为IL-1β、IL-18特异有效的蛋白酶,激活后的Caspase-1能够促进炎症因子IL-1β、IL-18的表达,IL-1β、IL-18进一步发挥致炎促损伤作用[19-20]。本研究发现,在OIR视网膜中miR-223处于低表达状态,NLRP3、Caspase-1、IL-1β、IL-18蛋白水平均升高,提示在OIR中miR-223表达降低,从而升高NLRP3的表达,发挥作用。NAR组较OIR组视网膜中miR-223水平升高、NLRP3、Caspase-1、IL-1β、IL-18蛋白水平降低,而在NAR组的基础上添加miR-223拮抗剂后可以逆转上述过程,提示NAR能够升高miR-223水平、降低NLRP3、Caspase-1、IL-1β、IL-18蛋白水平,实现对小胶质细胞活化的缓解,进而抑制血管新生。
综上所述,NAR能够上调miR-223的表达进而抑制NLRP3炎症小体的表达,缓解视网膜炎症作用,进而缓解小胶质细胞过度激活,实现对OIR的保护。但miR-223下游靶基因众多,亦可能通过别的基因发挥作用,且小胶质细胞过度激活机制复杂,需进一步研究发现其机制。

