三叶香茶菜介导IκB-α磷酸化对CCl4致大鼠肝纤维化的影响
周至品,农汝楠,覃 乐,刘代华,王竟静,陈 勇,王晓源∗
(1.广西医科大学附属柳州市人民医院,广西 柳州 545006;2.右江民族医学院,广西 百色 533000;3.广西中医药大学,南宁 530001)
三叶香茶菜(Isodon ternifolius(D.Don)Kudo)为唇形科植物牛尾草,为广西瑶药材[1],可全草入药,药性甘、微苦,凉,具利湿疏肝、清热解毒的功效,多用于急慢性肝炎及早期肝硬化等疾病。前期的研究表明三叶香茶菜有抵抗大鼠肝纤维化作用,能够显著下调肝纤维化大鼠TGF-β1的表达[2-3]。三叶香茶菜能降低大鼠肝组织中Toll样受体4(Toll-like receptor4,TLR4)与核转录因子(nuclear transcription factor-κB,NF-κB)表达及入核,下调IL-1β、TNF-α、IL-6的细胞因子水平[4-5]。但三叶香茶菜如何抑制TLR4/NF-κB的的活化仍有待进一步研究。研究表明IκB-α与NF-κB结合不利于NF-κB活化入核,而IκB-α磷酸化水解与NF-κB分离,NFκB即活化入核,促进炎症因子的表达,引起细胞炎症反应[6]。因此,本研究拟以IκB-α分子及其磷酸化蛋白为靶点,进一步研究三叶香茶菜抗肝纤维化大鼠NF-κB信号通路活化的作用机制,为三叶香茶菜的利用提供新的理论。
1 材料和方法
1.1 实验动物
SPF级SD大鼠,96只,雌雄各半,体重为180~200g(±20%),购自湖南斯莱克景达实验动物有限公司[SCXK(湘)2019-0002]。动物饲养于广西中医药科学实验中心动物房[SYXK(桂)2019-0001]。本研究经广西中医药大学伦理委员会批准(DW20190329-05),实验设计及实施过程中严格遵循动物实验的3R原则。
1.2 主要试剂
药材来源于广西金秀县,并由广西中医药大学梁子宁教授鉴定为三叶香茶菜。秋水仙碱(20180804)购自广东彼迪药业有限公司;ALT(20190727)、HYP(20190728)生化试剂盒均购于南京建成生物工程研究所公司;TGF-β1(TAEJCJYV2W)、α-SMA(QPPHWEUQE8)、IL-6(ZCN5LZ69HT)、TNF-α(9G5HET75U2)ELISA试剂盒购于武汉伊莱瑞特生物科技股份有限公司;TLR4(bs-20594R)、p-IκB alpha(bsm-52169R)、NF-κB p65(bs-20159R)抗体均购于Bioss公司;β-actin抗体(ab8227)购于abcam公司。
1.3 实验方法
1.3.1 动物造模及给药
取SPF级SD大鼠96只,随机分成6组,每组16只,即对照组、模型组、秋水仙碱(0.2mg/kg)组、三叶香茶菜高剂量(80g/kg)组、三叶香茶菜中剂量(40g/kg)组、三叶香茶菜低剂量(20g/kg)组(按生药量计)。除对照组外,模型组、秋水仙碱组、三叶香茶菜高剂量、中剂量、低剂量组分别给予皮下注射40% CCl4花生油混合溶液,首剂量为5mL/kg,后调整为3mL/kg,2次/周,连续注射12周。造模4周后,正常组灌胃生理盐水,其余各组给予相应药物灌胃,给药1次/日,治疗8周。末次给药后,禁食不禁水12h大鼠麻醉后,腹主动脉取血,分离肝组织[5]。
1.3.2 指标检测
(1)HE染色 取肝组织,福尔马林固定,石蜡包埋并切片,切片2mm厚,HE染色,显微镜下观察肝组织病理情况。
(2)生化法 采用酶标仪测定血清中ALT活力及HYP水平,操作均严格按照试剂盒说明。
(3)ELISA法 严格按照ELISA试剂盒操作要求,测定血液中TGF-β1、α-SMA纤维相关因子及IL-6、TNF-α炎症因子水平。
(4)荧光定量PCR 取肝组织,提取总RNA,逆转录合成cDNA,制备DNA模版,最后荧光定量PCR反应。所有引物均由上海生工生物工程技术服务有限公司合成,引物信息见表1。

表1 Real-time PCR引物序列Table1 Real-time PCR primer sequence
(5)Western blot 取肝组织,提取组织蛋白。100℃变性10min,凝胶电泳分离并转至PVDF膜,一抗,4℃孵育12h,二抗,37℃孵育1h,ECL显色,曝光成像,得到灰度值,计算相对表达。
1.4 统计学方法
数据采用SPSS25.0软件处理。计量资料用平均数±标准差(±s)表示,组间比较采用单因素方差分析,两组间差异比较方差齐时采用LSD法,方差不齐时采用T2检验;计数资料用非参数秩和检验比较分析。检验水准α=0.05,α=0.01。
2 结果
2.1 三叶茶香菜对大鼠肝组织慢性病理损害的保护作用
光镜下,对照组肝小叶完整清晰,肝细胞围绕中央静脉,呈放射性排列,未见坏死,无炎性细胞浸润,未见纤维组织增生。模型组出现肝小叶结构破坏,肝细胞索排列紊乱,纤维间隔增厚,肝细胞变性,部分坏死,假小叶形成。秋水仙碱组及三叶香茶菜组肝组织损伤程度叫模型组明显减轻,肝细胞变性、炎细胞浸润、坏死情况有所改善。病理见图1,评分表见表2。
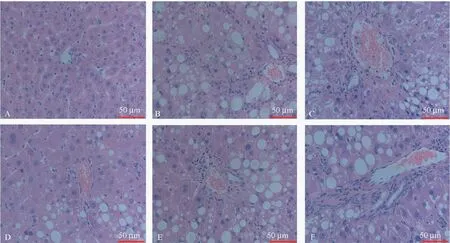
图1 三叶香茶菜对CCl4致肝纤维化大鼠肝组织病理损害抵抗作用(HE染色)Figure1 Effect of Isodon ternifolius(D.Don)Kudo on liver damage of the rats with liver fibrosis induced by CCl4(HE staining)
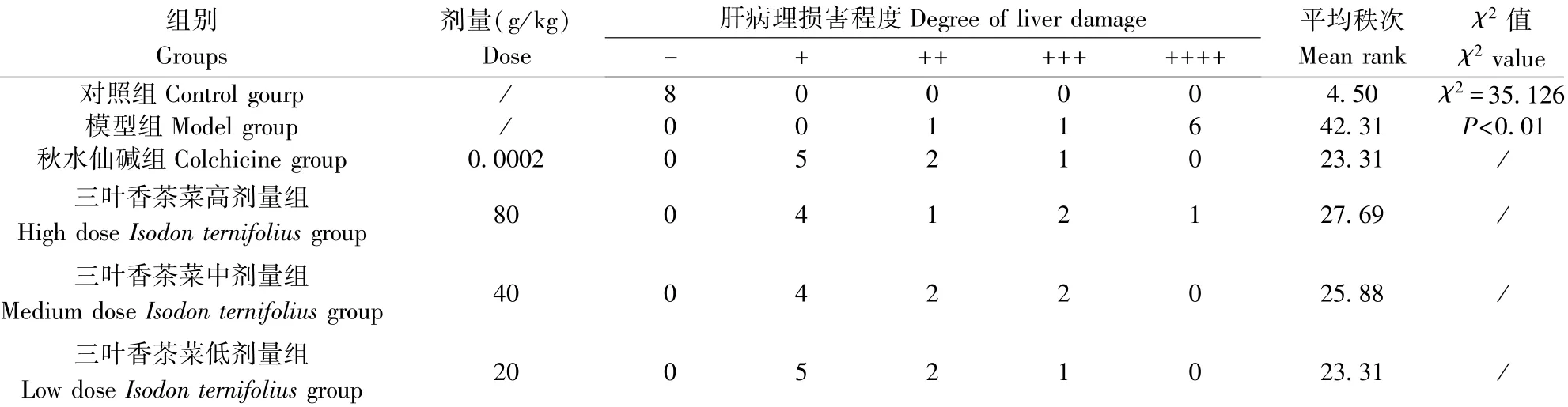
表2 三叶香茶菜对CCl4致肝纤维化大鼠肝组织病理损害程度影响(n=8)Table2 Effect of Isodon ternifolius(D.Don)Kudo on the damage of liver tissue of the rats with liver fibrosis induced by CCl4
2.2 三叶香茶菜对肝纤维化大鼠ALT、HYP水平的影响
ALT、HYP是反应肝损伤及纤维化相关的生化指标。生化结果发现,模型组较对照组大鼠血清ALT、HYP水平有显著升高(P<0.01);与模型组比,秋水仙碱组、三叶香茶菜高、中剂量组ALT的活力水平明显降低(P<0.01),三叶香茶菜中、低剂量组HYP水平显著降低(P<0.05或P<0.01),见表3。
表3 三叶香茶菜对CCl4诱导肝纤维化大鼠ALT、HYP水平的影响(±s)Table3 Effect of Isodon ternifolius(D.Don)Kudo on ALT and HYP level in rats with liver fibrosis induced by CCl4
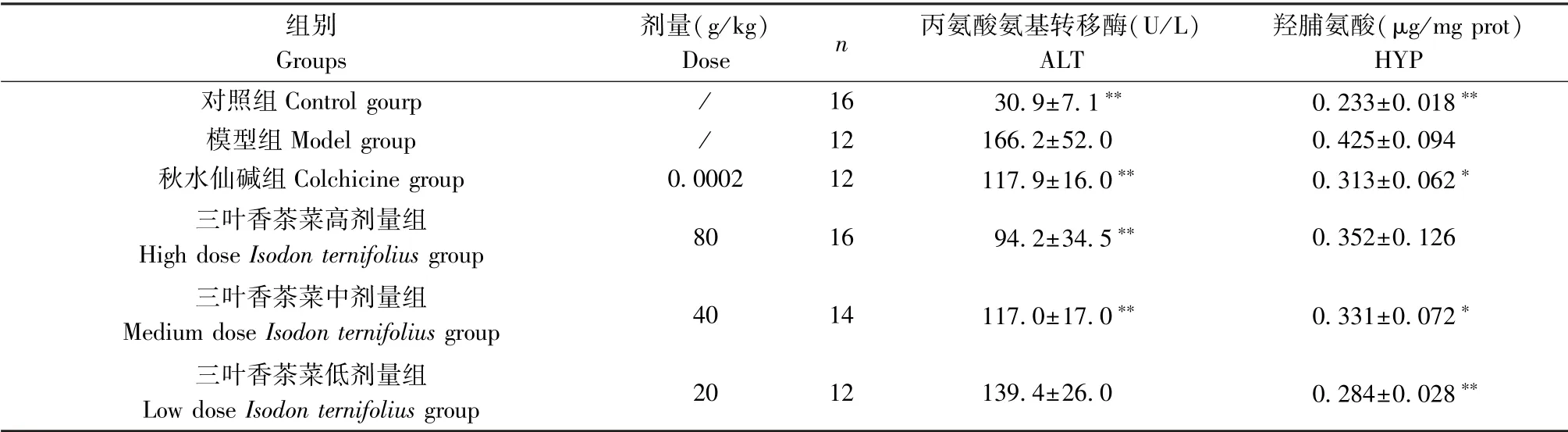
表3 三叶香茶菜对CCl4诱导肝纤维化大鼠ALT、HYP水平的影响(±s)Table3 Effect of Isodon ternifolius(D.Don)Kudo on ALT and HYP level in rats with liver fibrosis induced by CCl4
注:与模型组比较,∗P<0.05,∗∗P<0.01。Note.Compared with model group,∗P<0.05,∗∗P<0.01.
组别Groups剂量(g/kg)Dose n 丙氨酸氨基转移酶(U/L)ALT羟脯氨酸(μg/mg prot)HYP对照组Control gourp / 16 30.9±7.1∗∗ 0.233±0.018∗∗模型组Model group / 12 166.2±52.0 0.425±0.094秋水仙碱组Colchicine group 0.0002 12 117.9±16.0∗∗ 0.313±0.062∗三叶香茶菜高剂量组High dose Isodon ternifolius group 80 16 94.2±34.5∗∗ 0.352±0.126三叶香茶菜中剂量组Medium dose Isodon ternifolius group 40 14 117.0±17.0∗∗ 0.331±0.072∗三叶香茶菜低剂量组Low dose Isodon ternifolius group 20 12 139.4±26.0 0.284±0.028∗∗
2.3 三叶香茶菜对肝纤维化大鼠IL-6、TNF-α、TGF-β1、α-SMA表达影响
炎症因子及纤维化化相关因子IL-6、TNF-α、TGF-β1、α-SMA与肝纤维化密切相关。ELISA结果显示,与对照组比较,模型组大鼠血清中IL-6、TNF-α、TGF-β1、α-SMA的表达水平显著升高(P<0.01)。与模型组相比较,秋水仙碱组及三叶香茶菜高、中、低剂量组IL-6、TGF-β1、α-SMA表达水平显著降低(P<0.05,P<0.01),秋水仙碱组和三叶香茶菜中剂量组TNF-α的表达水平显著降低(P<0.01),三叶香茶菜高、低剂量大鼠血清中TNF-α的水平较模型组有下降,但差异不具有统计学意义,见表4。结果表明,三叶香茶菜能降低炎症因子IL-6、TNF-α及TGF-β1、α-SMA纤维化相关因子的水平,抑制肝纤维化。
表4 三叶香茶菜对CCl4致肝纤维化大鼠IL-6、TNF-α、TGF-β1、α-SMA水平的作用(±s)Table4 Effect of Isodon ternifolius(D.Don)Kudo on the IL-6,TNF-α,TGF-β1,α-SMA in rats with liver fibrosis induced by CCl4
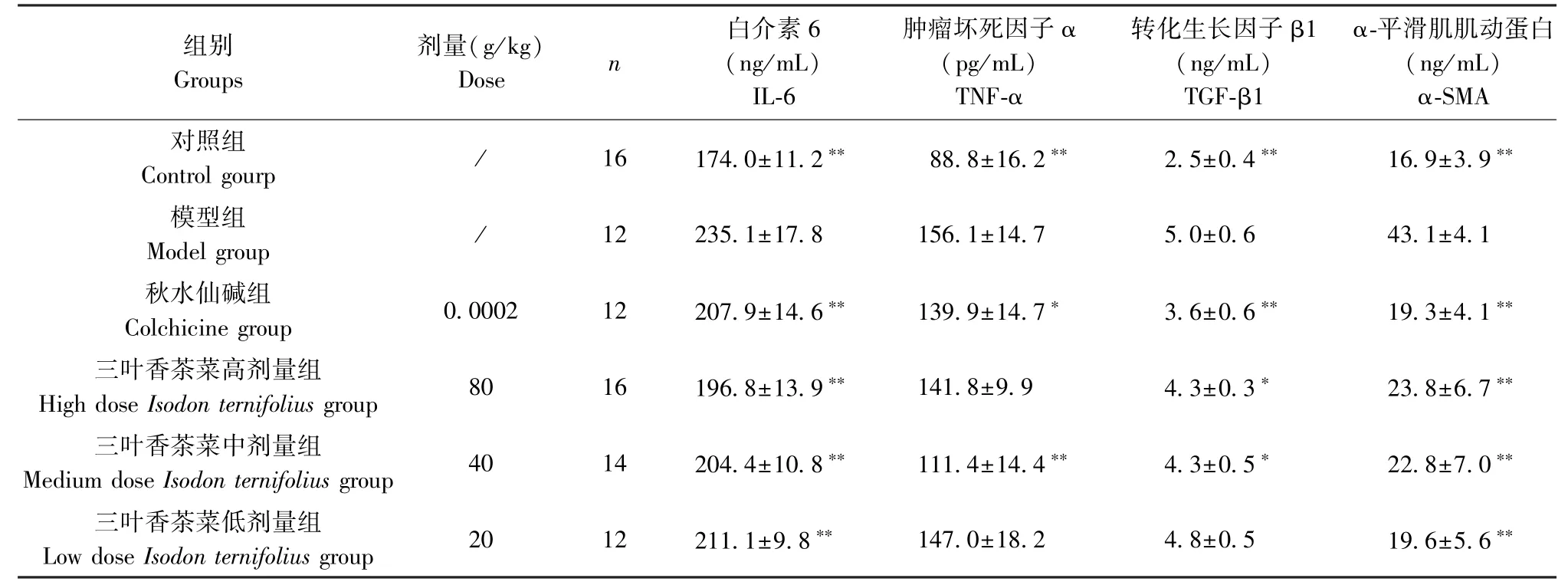
表4 三叶香茶菜对CCl4致肝纤维化大鼠IL-6、TNF-α、TGF-β1、α-SMA水平的作用(±s)Table4 Effect of Isodon ternifolius(D.Don)Kudo on the IL-6,TNF-α,TGF-β1,α-SMA in rats with liver fibrosis induced by CCl4
注:与模型组比较,∗P<0.05,∗∗P<0.01。Note.Compared with model group,∗P<0.05,∗∗P<0.01.
组别Groups剂量(g/kg)Dose n白介素6(ng/mL)IL-6肿瘤坏死因子α(pg/mL)TNF-α转化生长因子β1(ng/mL)TGF-β1 α-平滑肌肌动蛋白(ng/mL)α-SMA对照组Control gourp / 16 174.0±11.2∗∗ 88.8±16.2∗∗ 2.5±0.4∗∗ 16.9±3.9∗∗模型组Model group / 12 235.1±17.8 156.1±14.7 5.0±0.6 43.1±4.1秋水仙碱组Colchicine group 0.0002 12 207.9±14.6∗∗ 139.9±14.7∗ 3.6±0.6∗∗ 19.3±4.1∗∗三叶香茶菜高剂量组High dose Isodon ternifolius group 80 16 196.8±13.9∗∗ 141.8±9.9 4.3±0.3∗ 23.8±6.7∗∗三叶香茶菜中剂量组Medium dose Isodon ternifolius group 40 14 204.4±10.8∗∗ 111.4±14.4∗∗ 4.3±0.5∗ 22.8±7.0∗∗三叶香茶菜低剂量组Low dose Isodon ternifolius group 20 12 211.1±9.8∗∗ 147.0±18.2 4.8±0.5 19.6±5.6∗∗
2.4 三叶香茶菜对大鼠肝组织TLR4/NF-κB信号通路表达的影响
RT-qPCR和Western blot结果均表明,与对照组相比,模型组TLR4、NF-κB p65表达水平明显升高(P<0.05)。RT-qPCR结果发现,与对组组比,模型组IκB-α mRNA无统计学差异,但是有下降趋势,而Western blot结果发现p-IκB-α表达水平升高(P<0.05)。RT-qPCR和Western blot结果均表明三叶香茶菜组较模型组IκB-α表达水平显著升高(P<0.05),TLR4、NF-κB p65、p-IκB-α蛋白水平显著降低(P<0.05),见图2。综上,结果表达三叶香茶菜抑制了IκB-α的磷酸化从而抑制TLR4/NF-κB信号通路的活化。
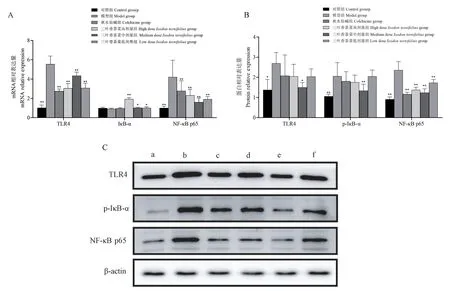
图2 三叶香茶菜对肝纤维化大鼠TLR4/NF-κB信号蛋白及mRNA表达的影响Figure2 Effect of Isodon ternifolius(D.Don)Kudo on the expression of TLR4/NF-κB signal protein and mRNA in liver fibrosis rat
3 讨论
为进一步明确三叶香茶菜对TLR4/NF-κB信号通路的调控,本研究采用CCl4诱导大鼠肝纤维化模型,研究了三叶香茶菜对TLR4、NF-κB p65、IκB-α、p-IκB-α信号蛋白的影响。本研究结果表明,经三叶香茶菜治疗后,治疗组大鼠肝组织慢性损害明显改善。三叶香茶菜能降低血清IL-6、TNF-α炎症因子以及TGF-β1、α-SMA纤维化相关因子水平,下调肝组织中的TLR4、NF-κB p65,上调IκB-α mRNA表达,抑制IκB-α磷酸化水平。
TLR4是一种识别病原相关分子模式中的识别受体,它是最早发现的第一个Toll样受体相关蛋白[7],具有识别病原相关分子模式(PAMPs)及损伤相关分子模式(DAMPs)的作用[8]。TLR4活化后激活下游的NF-κB信号通路,而NF-κB是重要的炎症转录因子,其激活可增强炎症反应的基因转录,致大量促炎因子IL-6、TNF-α等释放,发生炎症反应,促进肝组织损伤[9]。研究表明TLR4在肝纤维化的进展中发挥重要作用[10],TLR4/NF-κB是调控HSC及炎性细胞激活的信号通路,参与肝损伤时调控炎症细胞因子的形成[11]。TNF-α是TLR4下游重要的促炎因子[12],其具有诱导炎性细胞因子及趋化因子发生炎症级联效应的作用,还能够促进纤维化因子的表达[13],增加ECM在肝的沉积,加速纤维化的进程。NF-κB是Rel蛋白家族的成员之一,其主要以同源或异源的二聚体的形式存在。具有对DNA识别、二聚化及核定位等生物学功能。未活化的NFκB主要存在于细胞质中,以p65亚基形式与IκB-α(NF-κB的抑制蛋白)结合后以三聚体形式存在于细胞浆中[14]。当受到细胞因子、LPS、氧自由基等应激刺激时,促进NF-κB的活化释放炎症因子导致肝细胞损伤[15]。
NF-κB信号 激 活 过 程 包 括NF-κB诱 导 激 酶(NIK)激活IκB激酶(IKK-α),致使IκB-α(NF-κB抑制蛋白)磷酸化后降解,NF-κB复合物解离,最后致使NF-κB活化后进入细胞核促进其与相应的靶基因结合,导致一系列效应基因的表达,如IL-1β、TNF-α、IL-6等炎性细胞因子的合成与释放,引起细胞炎症、细胞增殖、形态改变、细胞分化、凋亡等[16]。而IκB为NF-κB的抑制分子,IκB分子由N端和C端组成,N端含有磷酸化和泛素化位点是信号反应区,C端是能够组成与NF-κB亚基RHD结合的位点。其IκB蛋白均具有氨基酸的锚蛋白重复序列,其作用是与NF-κB同源结构域RHD相结合,从而隐藏NF-κB的核定位序列,抑制其NF-κB进入细胞核发生转录和翻译。相关研究发现,慢性乙型肝炎患者肝组织中的NF-κB的表达增加与肝纤维化的发生发展成正相关[17]。研究表明,NF-κB的活化可以受到许多因素的抑制,其主要是通过抑制IκB的磷酸化及降解,上调IκB的表达或直接作用于NFκB等途径抑制其活性[18]。研究表明,在肝中IKK/NF-κB信号的激活通过巨噬细胞介导慢性炎症加重肝纤维化[19]。当IκB被抑制,LPS诱导小鼠模型的肝纤维化程度明显减轻,其机制是通过阻断NF-κB信号通路的活化,从而抑制炎症因子及纤维化相关因子的释放[20]。因此,增加IκB-α的表达及抑制其磷酸化都可以弱化NF-κB活化转核,抑制TNF-α、IL-6及TGF-β的合成和分泌,减轻肝纤维化的进展[21]。
综上表明,三叶香茶菜具有抗肝纤维化作用,其机制是通过升高IκB-α基因表达,下调IκB-α蛋白磷酸化水平,抑制了NF-κB活化转核,阻断TLR4/NF-κB信号通路的活化,从而抑制下游炎症细胞因子的表达,减弱肝的炎症损伤及纤维相关因子产生,达到抗肝纤维化作用。

