烟草青枯病菌对4种杀菌剂的敏感性及复配药剂联合毒力评价
牟文君,马晓静,胡利伟,郭建华,薛超群,奚家勤,宋纪真
中国烟草总公司郑州烟草研究院 烟草行业生态环境与烟叶质量重点实验室,郑州高新技术产业开发区枫杨街2 号 450001
植物青枯病(Bacterial wilt)是由青枯劳尔氏菌(Ralstonia solanacearum)引起的毁灭性土传病害,病原菌分布范围广,可侵染烟草、番茄和马铃薯等50余科的数百种作物[1-2]。青枯病菌从植株根部或伤口侵染,侵入植物木质部维管束并快速通过维管系统进入植物地上部分,对茄科作物危害尤为严重。烟草是我国重要经济作物,近年来随着连作年限的增加,烟草青枯病流行和蔓延的速度加快,发病严重田块发病率达100%,已成为烟草生产上的主要病害之一[3]。
烟草青枯病菌具有较高的遗传变异性和环境适应能力,菌系复杂,危害严重且难以防治,成为烟草生产的重要限制因素之一。目前,生产上对烟草青枯病的防治主要采取农业防治、生物防治和化学防治相结合的综合措施[4-7]。由于不同的防治方法均存在局限性,且细菌性青枯病与其他真菌、卵菌病害常混合发生,因此对青枯病的防治尚无十分有效的措施。化学药剂以其高效、速效的特点在病害防治中发挥着重要作用,目前市场上用于烟草青枯病防治的药剂主要有有机氯、有机铜、有机硫、无机铜、无机硫及其复配药剂等[8]。冯永新等[9]测定了7 种杀菌剂对烟草青枯病菌的毒力,其EC50介于101.02~212.70 mg/L 之间,按照毒力大小依次为三氯异氰尿酸、氯尿·硫酸铜、噻菌铜、溴菌·壬菌铜、甲霜·福美双、噻唑锌和中生菌素。黄小琴等[10]研究表明,硫酸链霉素、氢氧化铜、春雷霉素和噻唑锌等7种杀菌剂对烟草青枯病的EC50在170.07~318.57 mg/L 之间,且硫酸链霉素的毒力最大。毕涛等[11]从13 种药剂中筛选出可有效抑制烟草青枯病菌生长的6种药剂,其中3%四霉素水剂的抑菌效果最好。林天然等[4]检测了5 种常用杀菌剂对烟草青枯病盆栽的防治效果,表明50%青枯灵和72%农用硫酸链霉素对青枯病的防效达88.6%和79.6%,而1.8%辛菌胺醋酸盐、80%乙蒜素和3%克菌康的防效分别为75.6%、56.7%和52.3%。郑旭川等[12]研究提出,25%溴菌·壬菌铜微乳剂、20%噻菌铜悬浮剂对烟草青枯病的防效在50%左右。尽管化学防治已成为防控青枯病的主要方法,但目前还没有特效药剂。因此,挖掘作用机制独特、防治效果优异的化学药剂对烟草青枯病的防治尤为重要。氧化磷酸化解偶联抑制剂是将呼吸链中电子传递和ATP 生成解偶联的一类药剂,由于该类药剂无特异性靶标,因此其抑菌谱更为广泛,也不易产生抗药性[13-15]。氟啶胺是氧化磷酸化解偶联抑制剂中的代表性药剂,属于吡啶胺类[9],对烟草黑胫病菌和根肿菌等大部分真菌及螨类均有良好的抑菌活性和防效[14-16]。有研究表明,植物病原真菌对氟啶胺的抗药性发展缓慢,且氟啶胺与非氧化磷酸化解偶联作用机制的杀菌剂无交互抗药性,可以用来治理已有的抗药性风险[17-19]。
单一药剂的长期、多频次不合理使用可造成病原菌的抗药性[4],如2016 年农用链霉素因抗药性问题最终退出了农药市场[20]。纳米抗菌材料较大的比表面积能够增加其与病原菌接触,提高抑菌活性,同时在化学渗透压和物理损伤细胞结构的协同作用下,使病原菌不易产生抗药性,因此在植物病害防控方面具有广阔应用前景[21-22]。蒲丽等[23]研究表明,纳米二氧化钛在阳光或汞灯下照射4 h 后对烟草青枯菌的杀菌率达90%以上。蔡璘[24]研究发现,纳米氧化镁对烟草青枯病菌的抑制活性显著高于普通氧化镁,纳米氧化镁处理后烟草青枯病田间发病率可减少38.83%。金属元素抗菌剂铜纳米粒子在极低剂量下(0.22 μg/mL)也能够抑制地毯草黄单胞杆菌的生长,从而高效控制石榴叶片枯萎病的发生[25]。银纳米粒子与氟康唑联用对白色念珠菌具有高效抑菌作用[26]。但目前氟啶胺尚未应用于细菌病害的防治。为筛选出高效防治烟草青枯病的药剂,测定了烟草青枯菌对杀菌剂氟啶胺、双苯菌胺、噻霉酮、链霉素和春雷霉素的敏感性,并将氟啶胺分别与纳米硫、纳米银和纳米铜进行二元复配,评价其协同增效作用,旨在为筛选防治烟草青枯病的新型高效药剂和实现农药减量增效奠定基础。
1 材料与方法
1.1 烟草青枯病菌的分离鉴定
采集江西省抚州市宜黄、黎川、乐安、广昌、资溪、南丰和崇仁发病烟田的青枯病发病烟株,将发病烟秆横切成5 cm 的小段,并将溢出的白色菌脓划线挑入盛有1 mL无菌水的离心管中制成菌悬液。静置片刻后,用移菌环在牛肉膏蛋白胨(NA)选择性培养基平板上划线培养(NA 培养基121 ℃灭菌20 min,在温度50~60 ℃时加入终浓度为 50 μg/mL 放线菌酮、10 μg/mL 氯霉素和10 μg/mL 多黏菌素)。烟草青枯病菌分子鉴定PCR体系包括12.5 μL DNA mix[生工生物工程(上海)股份有限公司],0.2 pmol/L 特异性引物 759/760(5′-GTCGCCGTCAACTCACTTTCC-3′,5′-GTCGCCGTCAGCAATGCGGAATCG-3′),25 ng DNA模板,最后加入ddH2O补充至25 μL,阴性对照为ddH2O。PCR反应条件:95 ℃预变性5 min;94 ℃变性30 s,59 ℃退火30 s,72 ℃延伸90 s,35个循环;72 ℃延伸10 min。采用1.5%琼脂糖凝胶电泳检测,PCR产物由上海生工生物工程有限公司测序鉴定。
1.2 供试药剂
98%氟啶胺购自上海弼众商贸有限公司,98%双苯菌胺购自沈阳化工研究院。99%噻霉酮购自天津阿尔塔科技有限公司。98%链霉素购自成都艾科达化学试剂有限公司。90%春雷霉素购自天津阿尔塔科技有限公司。以上药剂用二甲基亚砜配制成1×105μg/mL的母液,置于4 ℃条件下保存。纳米铜、纳米银和纳米硫药液浓度均为1×103μg/mL,均购自威晶纳米新材料公司。
1.3 烟草青枯病菌生长曲线测定
将烟草青枯病菌接种至培养液中,于30 ℃、120 r/min 避光条件下进行恒温振荡培养65 h,获得细菌悬浮液。加样板每孔加入营养肉汤250 μL和预培养的烟草青枯病菌菌液50 μL,每个菌株重复3次。将加样板置入Bioscreen C 生长曲线测定仪(芬兰Oy Growth Curves Ab公司),温度设置为28~30 ℃、每隔30 min测定菌液在波长600 nm处的吸光值(OD600),并绘制烟草青枯病菌的生长曲线。
1.4 烟草青枯病菌对不同药剂的敏感性测定
采用生长曲线测定仪测定烟草青枯病菌对氟啶胺、双苯菌胺、噻霉酮、链霉素和春雷霉素的药剂敏感性。从烟草青枯病菌划线平板上挑取单菌落加入NA 液体培养基中,振荡培养19 h,备用。将药剂按照体积比1∶100加NA液体培养基中,药剂浓度见表1。氟啶胺、双苯菌胺和噻霉酮以只加二甲基亚砜的NA培养液为对照,链霉素和春雷霉素以只加无菌水的NA 培养液为对照。加样板每孔加入不同浓度药液3 μL、营养肉汤250 μL、青枯菌菌液50 μL,每个浓度重复3次。加样板置入生长曲线测定仪上,于28~30 ℃、每隔30 min测定1次OD值。药剂对青枯病菌的生长抑制率计算公式:

表1 不同杀菌剂单剂及复配药剂的浓度Tab.1 Concentrations of different single and combinatory fungicides

以药剂浓度的对数为x轴,抑制率的机率值为y轴,根据两者间的线性关系,建立毒力回归曲线方程y=ax+b,并计算相关系数r和药剂对病原菌的有效抑制中浓度EC50。根据烟草青枯病菌敏感性的分布情况,建立青枯病菌对5种药剂的敏感基线。
1.5 复配药剂的联合毒力测定
在单剂毒力测定的基础上,按氟啶胺分别与3种纳米农药按体积比 80 ∶1、40 ∶1、20 ∶1、4 ∶1、1 ∶1、1 ∶4、1 ∶20、1 ∶40 和 1 ∶80 共 9 个配比测定其对烟草青枯病菌的抑制率,复配药剂的终浓度见表1。采用Wadley方法对复配制剂进行联合作用评价,计算公式:

式中:a、b 分别为氟啶胺与纳米农药的复配比例,%;EC50(a)为氟啶胺的有效抑制中浓度,μg/mL;EC50(b)为纳米农药的有效抑制中浓度,μg/mL。

式中:EC50(th)为混剂的理论有效抑制中浓度,μg/mL;EC50(ob)为混剂的实测有效抑制中浓度,μg/mL。
SR≤0.5,表明两种药剂复配具有拮抗作用;SR在0.5~1.5 时,表明两种药剂复配具有相加作用;SR≥1.5,表明两种药剂复配具有增效作用[16]。
2 结果与讨论
2.1 烟草青枯病菌的分离鉴定
从江西省宜黄、黎川、乐安、广昌、资溪和南丰等地区采集了烟草青枯病病样,分离培养后青枯病菌在NA 培养基上生长的菌落表面光滑,呈不规则圆形,不透明、黏稠状且有流动性,见图1。将分离到的菌株采用烟草青枯病菌特异引物759/760 进行PCR 鉴定。结果(图2)表明,共有40 株菌株基因组DNA 的PCR 扩增产物出现在预期位置(281 bp)。经NCBI 数据库BLASTN 比对,确认分离菌株为烟草青枯病菌。分离的烟草青枯病菌地理来源为崇仁县相山镇2 株;黎川县4 株,来自德胜乡、湖坊乡和潭溪乡;宜黄县5 株,分别来自黄陂镇和二都镇;广昌县9 株,来自头陂镇、旴江镇和长桥乡;南丰县10 株,来自傅坊乡、太和镇和太源乡;资溪县2 株,来自高阜镇;乐安县8 株,来自招携镇和增田镇,见表2。

图1 烟草青枯病菌在NA平板上的菌落形态Fig.1 Colony morphology of R. solanacearum on NA plate
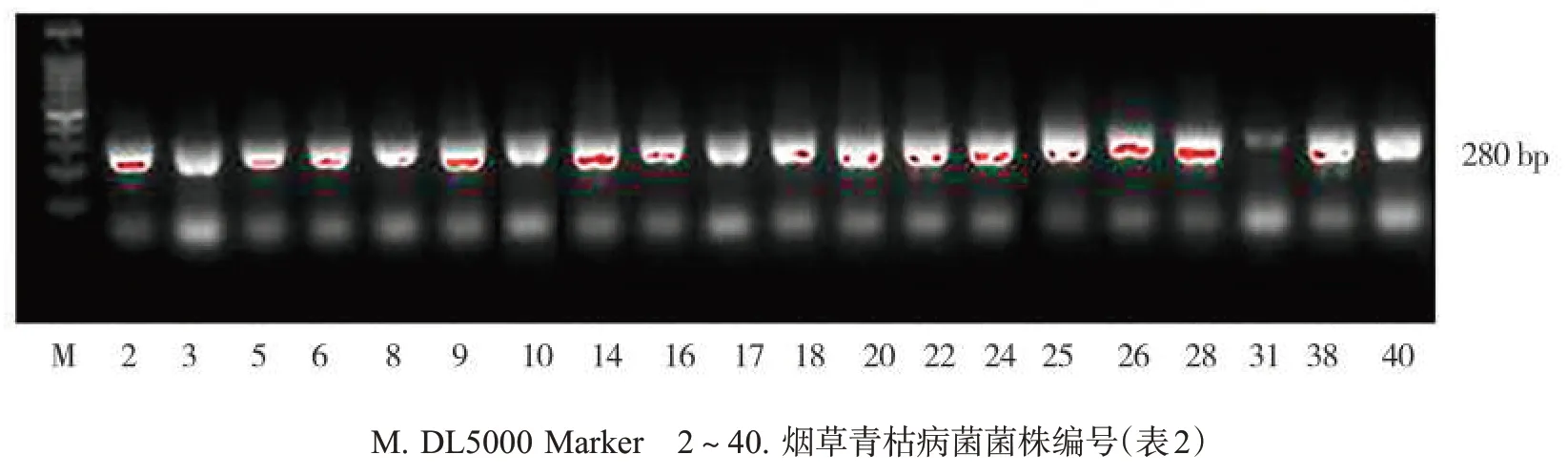
图2 烟草青枯病菌的PCR鉴定电泳图Fig.2 PCR electrophoretogram of R. solanacearum DNA samples
表2 烟草青枯病菌菌株信息Tab.2 Information of R. solanacearum strains

表2(续)
2.2 烟草青枯病菌生长曲线
选取4株烟草青枯病菌,在生长曲线测定仪上连续培养65 h,监测烟草青枯病菌的生长动态,并绘制烟草青枯菌的生长曲线。由图3 可知,培养4~19 h时烟草青枯菌快速生长,处于对数生长期,19~38 h烟草青枯病菌的生长相对平稳,38 h 后烟草青枯病菌开始逐渐衰亡。因此,在药剂毒力试验中,选定培养19 h 左右的菌液,此时菌株生长活力较高,菌液OD600值代表烟草青枯病菌的生长量,可通过OD 值来比较药剂处理对烟草青枯病菌生长的影响。

图3 烟草青枯病菌的生长曲线Fig.3 Growth curves of R. solanacearum strains
2.3 烟草青枯病菌对氟啶胺的药剂敏感性
氟啶胺和双苯菌胺的作用机制为氧化磷酸化解偶联[9]。烟草青枯病菌对氟啶胺的药剂敏感性(表3)表明,氟啶胺对供试菌株的EC50为0.147 1~0.890 4 μg/mL,最大与最小的 EC50之间相差 6.05 倍,平均EC50为0.305 0 μg/mL,表明来自不同取样地的烟草青枯病菌株对氟啶胺的敏感性差异不大。其中,EC50最低和最高的菌株均来自乐安,来自其他地区菌株的EC50居于两者之间。烟草青枯病菌菌株对氟啶胺的敏感性频率分布呈连续单峰曲线(图4A),表明供试菌株对氟啶胺较敏感,可用于青枯病的防治。

表3 烟草青枯病菌对不同药剂的敏感性Tab.3 Sensitivity of R. solanacearum to different fungicides (μg·mL-1)

表3(续)
2.4 烟草青枯病菌对双苯菌胺的药剂敏感性
从表3 可以看出,烟草青枯病菌对双苯菌胺的敏感性较高,平均EC50为0.037 8 μg/mL,且敏感性分布范围相对较窄,最大和最小EC50分别为0.018 7 μg/mL和0.053 4 μg/mL,两者仅相差2.86 倍,分别来自黎川县和广昌县。从敏感基线(图4B)可以看出,烟草青枯病菌对双苯菌胺的敏感性呈单峰曲线分布,表明供试菌株对双苯菌胺敏感,未出现抗药性菌株。
2.5 烟草青枯病菌对噻霉酮的敏感性
噻霉酮对烟草青枯病菌的EC50分布范围为0.099 5~4.825 3 μg/mL,平均EC50为2.429 9 μg/mL。从表3 可见,南丰县10 株青枯病菌对噻霉酮的敏感性差异相对较大,宜黄县5 株青枯病菌对噻霉酮的敏感性分布相对较窄。总体来看,烟草青枯病菌菌株对噻霉酮的敏感性频率分布呈连续单峰曲线(图4C),EC50分布在2~3 μg/mL 的菌株频率相对较高。
2.6 烟草青枯病菌对春雷霉素的敏感性
烟草青枯病菌对春雷霉素的敏感性分布范围相对较宽,EC50为4.157 7~37.628 2 μg/mL,最大EC50与最小EC50之间相差9.05倍,平均EC50为9.927 3 μg/mL(表3)。其中,EC50最大值和最低值的菌株分别来自南丰县和黎川县,其他地区菌株的EC50介于两者之间。烟草青枯病菌菌株对春雷霉素的敏感性频率分布呈连续单峰曲线(图4E),春雷霉素对大部分供试菌株的EC50分布在4~10 μg/mL之间。

图4 烟草青枯病菌对不同药剂的敏感基线Fig.4 Sensitivity baselines of R. solanacearum to different fungicides
2.7 烟草青枯病菌对链霉素的敏感性
图4 结果表明,烟草青枯病菌对链霉素表现敏感,敏感性频率呈正态分布,为连续的单峰曲线,未出现抗药性亚群体(图4D)。链霉素对烟草青枯病菌的平均EC50为0.546 3 μg/mL,最大值为来自乐安县的菌株,EC50为1.407 3 μg/mL,最小值来自黎川县,EC50为0.187 6 μg/mL,大部分菌株的EC50分布在0.3~0.7 μg/mL 范围内(表 3)。与毕涛等[11]和汪莹[27]的研究相比,他们使用的72%链霉素可溶性粉剂均为商品化制剂,且使用的检测方法为纸碟片法和牛津杯法,与本研究中的检测方法不同。虽然试验结果不具有可比性,但3个试验结果均表明链霉素对烟草青枯病菌具有较好的抑制活性。
2.8 氟啶胺与纳米硫复配对烟草青枯病菌的联合毒力
氟啶胺单剂、纳米硫溶液单剂、氟啶胺与纳米硫按不同比例复配后的组合物对烟草青枯病菌的毒力作用结果见表4。氟啶胺与纳米硫的9 个复配配比对烟草青枯病菌均有抑制作用,EC50分布在0.281 2~6.040 6 μg/mL之间,大于氟啶胺单剂的EC50(0.207 3 μg/mL),但小于纳米硫单剂的EC5(017.399 8 μg/mL)。随着纳米硫比例的增加,EC50增大,药剂敏感性降低。根据以上单剂和复配组合物对烟草青枯病菌的抑制率,用Wadley 法评价氟啶胺与纳米硫复配的联合毒力。从表4可见,大部分复配组合物均具有相加作用;当氟啶胺与纳米硫按照体积比1∶1复配时,两者具有拮抗作用,增效系数为0.270 6,在生产应用时不宜采用此复配比例;当氟啶胺与纳米硫按体积比1∶40复配时,增效系数最大,为1.595 5,表明两者具有增效作用。
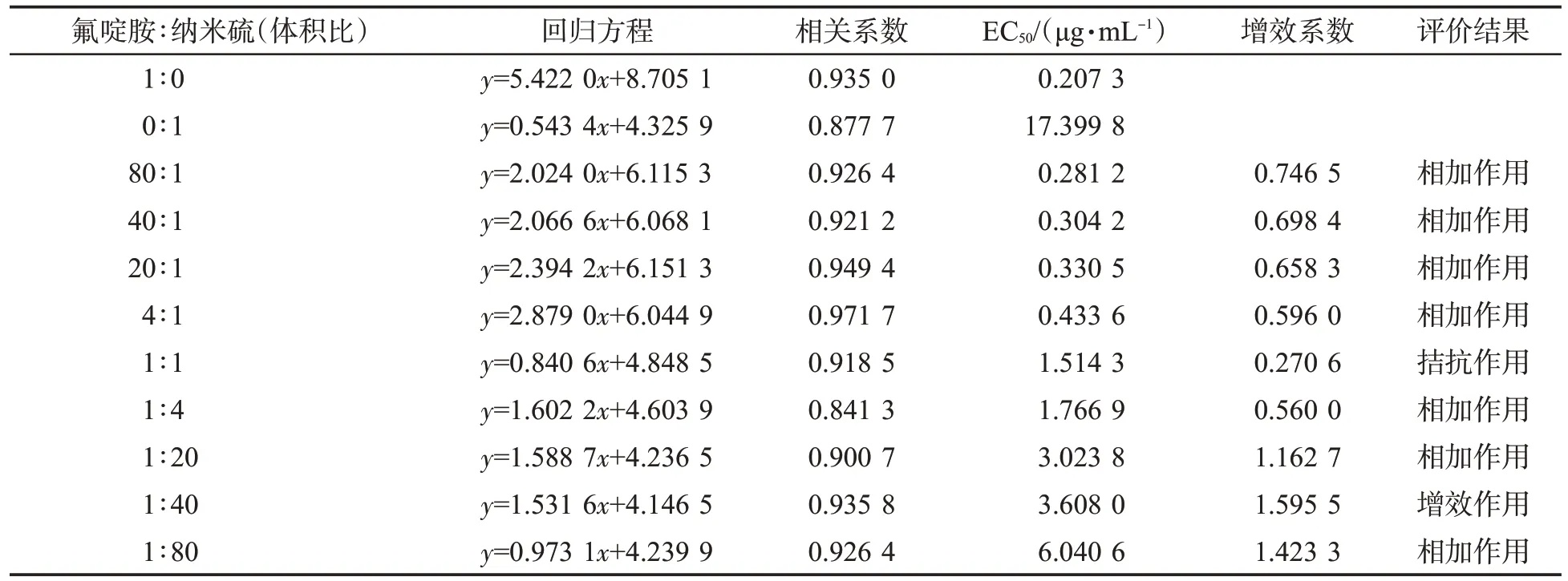
表4 氟啶胺与纳米硫复配对烟草青枯病菌的联合毒力Tab.4 Synergistic toxicity of fluazinam and nano sulfur against R. solanacearum
2.9 氟啶胺与纳米铜复配对烟草青枯病菌的联合毒力
氟啶胺与纳米铜按9个比例进行复配,不同杀菌剂组合物对烟草青枯病菌的EC50分布范围为0.142 2~7.203 3 μg/mL,均小于纳米铜单剂对青枯病菌的EC5(021.479 7 μg/mL),见表5。当氟啶胺与纳米铜按体积比1∶1和1∶4复配时,增效系数小于0.5,说明在此复配比例下,氟啶胺与纳米铜表现为拮抗作用;而其余7个复配比例,氟啶胺与纳米铜的增效系数在0.721 4~1.186 7之间,具有相加作用。

表5 氟啶胺与纳米铜复配对烟草青枯病菌的联合毒力Tab.5 Synergistic toxicity of fluazinam and nano copper against R. solanacearum
2.10 氟啶胺与纳米银复配对烟草青枯病菌的联合毒力
从表6 可以看出,氟啶胺与纳米银在不同复配比例下对青枯病菌均有抑制作用,9 种复配杀菌剂组合物对烟草青枯病菌的EC50分布在0.387 3~9.459 6 μg/mL 之间,均小于纳米银单剂对青枯病菌的EC5(015.420 4 μg/mL),大于氟啶胺单剂对青枯病菌的EC50。采用Wadley 方法评价氟啶胺与纳米银的联合毒力,当氟啶胺与纳米银按 20 ∶1、4 ∶1、1 ∶1、1 ∶4 比例复配时,具有拮抗作用;当氟啶胺与纳米银按80∶1、40∶1、1∶20、1∶40、1∶80比例复配时,具有相加作用,且当氟啶胺与纳米银1 ∶20 复配时,增效系数最高,为1.406 7。

表6 氟啶胺与纳米银复配对烟草青枯病菌的联合毒力Tab.6 Synergistic toxicity of fluazinam and nano silver against R. solanacearum
3 结论
①烟草青枯病菌对杀真菌药剂氟啶胺、双苯菌胺具有敏感性,平均EC50分别为0.305 0 μg/mL和0.037 8 μg/mL,优于对照药剂链霉素(EC500.546 3 μg/mL)。噻霉酮和春雷霉素对烟草青枯病菌的平均EC50分别为2.429 9 μg/mL 和9.927 3 μg/mL,均对烟草青枯病菌具有较好的抑制作用。②氟啶胺与纳米硫、纳米铜和纳米银在9 种复配比例下的联合毒力作用评价结果表明,最佳复配比例(体积比)分别为1∶40、80∶1和1∶20时具有增效或相加作用。

