油茶转录因子基因CoSOC1-like 的克隆和表达分析
黄国文,管天球,赵雨云,陈莫林,刘宏辉
(湖南科技学院化生院,湖南 永州 425199)
油茶(Camellia oleiferaAbel.)为山茶科山茶属常绿灌木或小乔木,是一种重要的木本油料树种[1],主要分布在我国长江流域及以南地区的湖南、安徽、广东、广西、福建等省区。茶油含有90%以上不饱和脂肪酸,具有降血脂、预防心脑血管疾病等功效,是有利于人类健康的食用油。油茶是虫媒、两性花的异花授粉植物。油茶的成花时间长。“湘林1 号”油茶(Camellia oleifera‘Xianglin1)’的花芽分化从5 月下旬开始到9 月上旬结束,经过生理分化期、萼片形成期、花瓣形成期、雌雄蕊形成期、子房和花药形成期、雌雄蕊成熟期等阶段[2],然而,“长林4 号”油茶(Camellia oleifera‘Changlin4)’花芽分化的开始时间是6 月上旬[3],10月中下旬开花结果。植物成花受光周期途经、自主春化途径、赤霉素途径和糖类途经等的基因调节,也受开花整合子SOC1、FT、LFY等基因的调节,最后受同源异形基因AP1、SEP、AG等的调控完成花器官发育[4-5]。SOC1基因是MADSbox 家族基因之一。MADS-box 基因家族在调节植物的花器官发育、开花时间、胚珠发育、根瘤形成和对环境信号反应等方面起作用[6-7]。在真核生物中,MADS-box 基因家族是一类编码转录因子的基因组成,其蛋白质具有高度保守的MADS 结构域[8],能够使本身蛋白质以二聚体的形式结合其它辅助因子和DNA,调节基因的时空表达。在被子植物中,大多数SOC1基因含有 7 个外显子和6 个内含子,其编码的蛋白除了含有保守的MADS-box 以外,还含有K-box 和非保守的I 区、C 区,因此,属于MIKC 型[9]。K-box 是一个半保守片段,主要由有3 个α 螺旋组成,其中,前面2 个螺旋和第3 个螺旋的作用分别是决定本身蛋白二聚化的特异性和形成高级复合物,是蛋白质相互作用部位[10];I 区的序列变化较大,主要促进蛋白二聚体本身与DNA 的结合;C 区由疏水性氨基酸组成的最不保守区域,是基因转录的激活区,但有些SOC1 蛋白也具有一个保守的MOTIF结构域,因此,被划入SOC1/TM3 亚家族[11],SOC1的不同功能主要由不同的C 区基序完成[12]。目前,在大豆(Glycine max(Linn.) Merr.)[13-14]、玉米(Zea maysL.)[15]、烟草(Nicotiana tabacumL.)[16]、芒果(Mangifera indicaL.)[17]、油菜(Brassica campestrisL.)[18]、拟南芥(Arabidopsis thaliana(L.)Heynh)[19-20]、茶树(Camellia sinensis(L.) O.Ktze)[21-22]、橘子(Citrus reticulataBlanco)[23]、火龙果 (Hylocereus polyrhizus(Haw) Britt &Ros)[24]、牡丹(Paeonia suffruticosaAndr.)[25]等植物中的SOC1基因序列和作用都有报道,但关于油茶中SOC1同源基因的序列和作用的报道很少。本研究采用RT-PCR 技术和RACE(Rapid Amplification of cDNA Ends)技术克隆油茶的CoSOC1-like基因,用生物信息学方法研究其序列特征,用荧光定量PCR 技术研究CoSOC1-like基因的表达模式,用基因瞬时表达法研究蛋白的亚细胞定位,为进一步研究油茶CoSOC1-like基因的功能打下基础,为揭示油茶成花的分子机制和花期调控提供理论依据。
1 材料与方法
1.1 材料
油茶材料采摘于湖南科技学院油茶示范基地的3 年生油茶‘湘林210(’Camellia oleifera‘Xianglin 210)’品种。采摘后的叶片立即放于干冰盒中冷冻保存运输,后转存入-70 ℃超低温冰箱,在48 h内提取RNA。
1.2 试验方法
1.2.1 油茶CoSOC1-like基因的克隆 采用RACE方法克隆油茶CoSOC1-like基因[26]。以油茶幼嫩叶片为材料,用RNA 提取试剂盒(北京索莱宝科技有限公司)提取叶片总RNA。使用1.0%琼脂糖凝胶电泳测定RNA 的质量。以RNA 完整且无蛋白质污染的RNA 作为底物,按照反转录试剂盒(北京全式金生物技术有限公司)合成cDNA 第一链。扩增CoSOC1-like基因的引物序列见表1。以cDNA第一链为模板,F1 和R1、F2 和R2 为引物和高保真的PFU 酶(北京全式金生物技术有限公司)构建反应体系,进行巢式PCR 扩增,获得基因的核心片段。使用3′和5′RACE cDNA 扩增试剂盒(北京百泰克生物技术有限公司)提供的引物、F3 和R3、F4 和R4 引物进行PCR 扩增,获得基因的3′端序列片段和5′端序列片段。每个片段经过琼脂糖凝胶回收试剂盒(上海生物工程股份有限公司)回收,与pGM-T 载体(北京索莱宝公司)连接并转化大肠杆菌DH5α 细胞,并涂布在含有100 μg·mL-1氨苄青霉素的固体LB 培养基上进行蓝白斑筛选,37 ℃培养16 h。用PCR 法鉴定白色菌落的阳性克隆。用质粒提取试剂盒(上海生物工程股份有限公司)提取5~10 个阳性克隆的质粒,送至北京擎科生物科技有限公司湖南分公司测序。将每个序列在DNAMAN 软件中拼接,获得含有全长CoSOC1-like基因序列的片段。
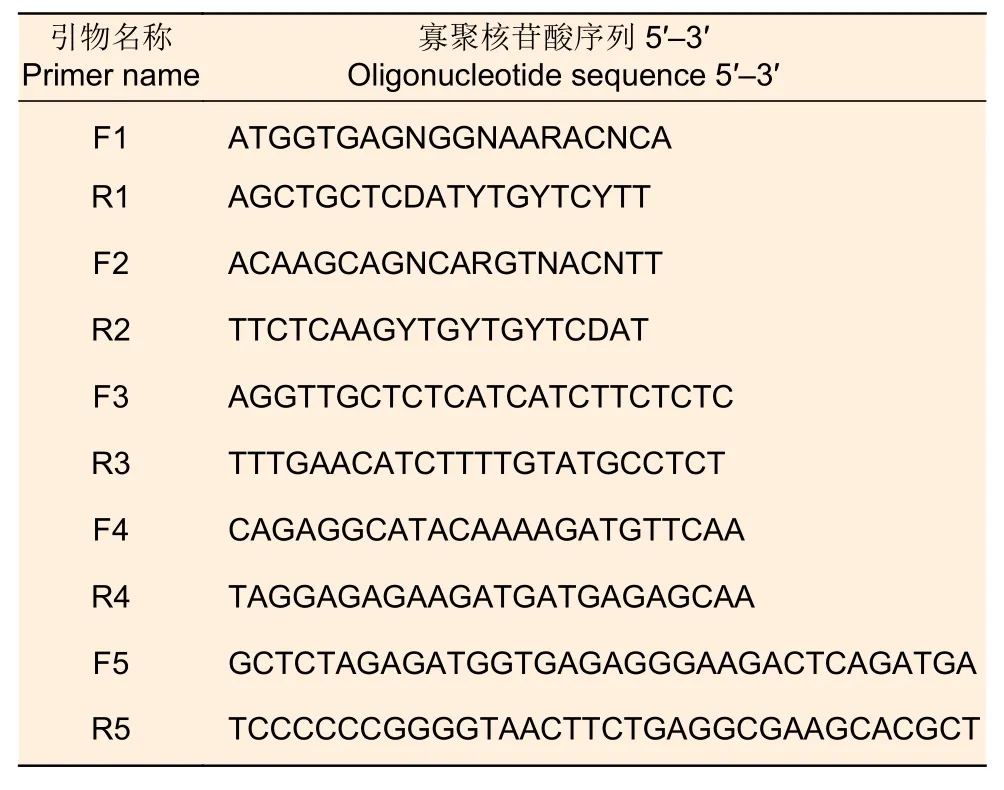
表1 CoSOC1-like 基因的引物序列Table 1 Primer sequences of CoSOC1-like
1.2.2 油茶CoSOC1-like基因序列的生物信息学分析 用DNAStar 5.0 软件分析油茶CoSOC1-like基因开放阅读框,并推导氨基酸序列。用DNAMAN 软件预测油茶CoSOC1-like 蛋白质序列的疏水性、亲水性和跨膜结构域。采用SOPMA在线工具(http://npsa-pbil.ibcp.fr/cgi-bin/)分析蛋白质二级结构;用Phyre2 在线工具分析蛋白质三级结构;在PSORT 在线工具(http://psort.hgc.jp/)上进行亚细胞定位预测;运用在线KinasePhos 2.0 软件对CoSOC1-like 蛋白作用方式预测;利用MEGA5.0软件的Clustal W 法进行比对,用邻接法构建同源蛋白系统发育树(自展值Bootstrap 设定为1 000,其它参数的缺省值不变)。
1.2.3 油茶CoSOC1-like基因表达模式分析 在2020 年12 月20 日取处于开花后期油茶的根、幼茎、叶片、营养芽、花瓣、雄蕊、柄托雌(花柄、花托和雌蕊部分的总称,因为花柄短并且花托和子房紧密结合,不易区分且很难分离)等部分提取总RNA。在2021 年5 月30 日取处于花芽生理分化期油茶的根、幼茎、叶片、顶芽(未出现分化的芽)、营养芽、花芽和幼果等部分提取RNA。在2021 年6 月30 日取处于雌蕊和雄蕊形成期油茶的根、茎、叶片、营养芽(0.4 cm 左右)、花芽(0.8 cm 左右)、果皮和种子等部分提取RNA。在2021 年7 月30 日取处于花芽子房和花药形成期(去掉苞片的花芽中有肉眼可见的约2 mm 左右分叉柱头、1 mm 左右的雄蕊)油茶的根、茎、叶片、营养芽(0.5 cm 左右)、花芽(1.3 cm 左右)、果皮和种子等部分提取RNA。所有的RNA 用反转录试剂盒合成cDNA 后用于荧光定量PCR。测定基因表达量的引物为,油茶CoSOC1-like基因引物为F:5′TCTCTGCGATGCTGAGGTTG 3′,R:5′ TCTATCTGCTTTGCCATGTCTG 3′,片段长度195 bp。ACTIN基因引物为F:5′ TAGACTTGC GGCATCAGTTAGA 3′,R:5′ TTCACGGTTTTT GGACGGATT 3′,片段长度176 bp。所用仪器为BIO-RAD 的 CFX Connect Real-Time System,试剂是赛默飞世尔科技有限公司的Power SYBR™Green PCR 预混液(货号:4367659) 。反应体积为 20 μL,反应程序为:95.0 ℃ 3 min,95.0 ℃15 s,55.0 ℃ 20 s,72.0 ℃ 30 s,35 个循环,72.0 ℃ 5 min,4 ℃保存。每个样品设置 3 次重复,采用 2-ΔΔCT方法计算基因的相对表达量,利用 SPSS19 软件的单变量方差分析的 Duncan 多重比较法进行显著性差异和标准误分析。
1.2.4 油茶CoSOC1-like 蛋白的亚细胞定位分析
以扩增油茶CoSOC1-like基因全长的加入XbaI酶切位点的正向引物(F:5′ GCTCTAGAG ATGGTG AGAGGGAAGACTCAGATGA 3′)、加入了XmaI 酶切位点的反向引物(R:5′ TCCCCCCGGGGTAACT TCTGAGGCGAAGCACGCT 3′)和高保真的PFU酶进行PCR 扩增出基因全长。对CoSOC1-like基因全长和pBI121-EGFP 质粒(湖南丰辉生物科技有限公司)分别进行XbaI 和XmaI(北京NEB公司)双酶切,用琼脂糖凝胶DNA 片段回收试剂盒对酶切片段进行回收,然后用T4 DNA 连接酶(美国clontech 公司)连接这2 个片段,转化大肠杆菌DH5α 感受态细胞,用含有抗生素Amp 的LB 培养基培养,对菌斑进行PCR 鉴定和测序鉴定获得阳性克隆。将此阳性克隆用热激法转化到农杆菌EHA105 菌株中。用含有0.1 mol·L-1乙酰丁香酮和25 μg·mL-1利福平的YEB 培养基培养农杆菌EHA105 到OD600为0.5~0.6 时,转速5 000 rpm离心10 min 收集农杆菌,用重悬液(10 mmol·L-1MES,0.1 mmol·L-1乙酰丁香酮和10 mmol·L-1氯化镁,过滤除菌)悬浮农杆菌,用注射器将农杆菌注射到洋葱(Allium cepaL.)鳞片内表皮中,1 d后取洋葱鳞片内表皮在荧光显微镜(日本Nikon ECLIPSE Ni-U)下观察EGFP 蛋白的绿色荧光。
2 结果与分析
2.1 油茶CoSOC1-like 基因的克隆和序列分析
CoSOC1-like基因的核心片段用PCR 反应扩增,其产物经凝胶电泳检测,表明扩增产物约在350 bp 左右处有一条亮带,无其它杂带(图1)。用5′RACE 反应和3′RACE 反应,扩增基因的5′端序列和3′末端序列;经过测序和拼接,获得序列1 025 bp 片段。经过开放阅读框分析,此DNA 片段包含1 个完整的654 bp CDS 和150 bp 5′UTR、221 bp 3′UTR(图2)。
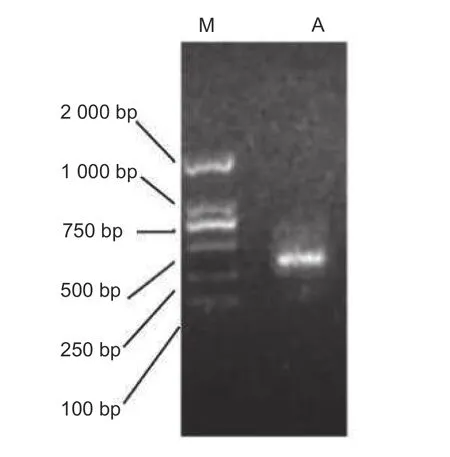
图1 油茶CoSOC1-like 基因片段的扩增产物电泳图Fig.1 Electrophoresis result of CoSOC1-like fragment of Camellia oleifera from RT-PCR
2.2 油茶CoSOC1-like 蛋白质的氨基酸特征和一级结构分析
油茶CoSOC1-like基因的CDS 序列编码217个氨基酸组成的蛋白质(图2)。蛋白质分子量为24.958 kDa,等电点为6.8。带负电荷的氨基酸(Asp+Glu)数量为37 个,带正电荷的氨基酸(Arg+Lys)数量为36 个,平均疏水性值为-0.77,平均亲水性值为0.361,属于亲水性蛋白。该蛋白无信号肽位点,是非分泌蛋白,也无跨膜螺旋区。
油茶CoSOC1-like 蛋白质与其它物种SOC1蛋白的同源性比对结果(图3)表明:它与茶树SOC1-like(XP-028068271.1)的同源性为97.7%、与榴莲(XP_022769695.1)的SOC1-like 同源性为78.4%、与核桃(XP_018851690.1)的SOC1-like 同源性为75.46%、与加州白栎(XP_030930174.1)的SOC1同源性为79.1%,与猕猴桃(AKH61958.1)SOC1e 同源性为82.16%、与山核桃(AHI85950.1)的SOC1 同源性为75.35%,与杨梅(KAB1200892.1)的SOC1同源性为75.94%,表明所克隆到的片段为油茶SOC1同源基因,本文将该基因命名为CoSOC1-like,并在GenBank 注册,登录号为MT036382。该序列蛋白质CoSOC1-like 结构包含MADS-box(1-74 位的氨基酸)、I-domain(75-83 位的氨基酸)、K-box(84-172 位的氨基酸)、C-domain四种结构域,属于植物Ⅱ型MADS-box基因的蛋白结构,C-domain 中含有SOC1 MOTIF,因此CoSOC1-like 属于SOC1/TM3 型。

图2 CoSOC1-like 基因cDNA 全长序列和开放阅读框及其氨基酸序列Fig.2 cDNA sequence and deduced amino acid sequence of CoSOCl-like

图3 CoSOC1-like 基因编码的氨基酸与其它植物的SOC1 的序列比对Fig.3 Alignments of the CoSOC1 -like deduced amino acid sequences with other SOC1 proteins from plants
2.3 油茶CoSOC1-like 蛋白质的二级结构预测
蛋白质二级结构是指蛋白质多肽链中氨基酸主要依赖于氢键而建立的有规则重复的构象,主要包括α-螺旋、β-折叠片、β-转角和无规则卷曲。油茶CoSOC1-like 蛋白的二级结构(图4)表明:油茶CoSOC1-like 蛋白含有α-螺旋56.68%、β-转角4.15%、折叠延伸链10.14%和无规卷曲29.0%。在蛋白质的84—172 位K-box 的氨基酸段有3 个很明显的α-螺旋,这3 个α-螺旋是MIKC 型MADSbox 基因的特征序列。在蛋白质的C-domain 的氨基酸段主要是卷曲和折叠延伸链组成。
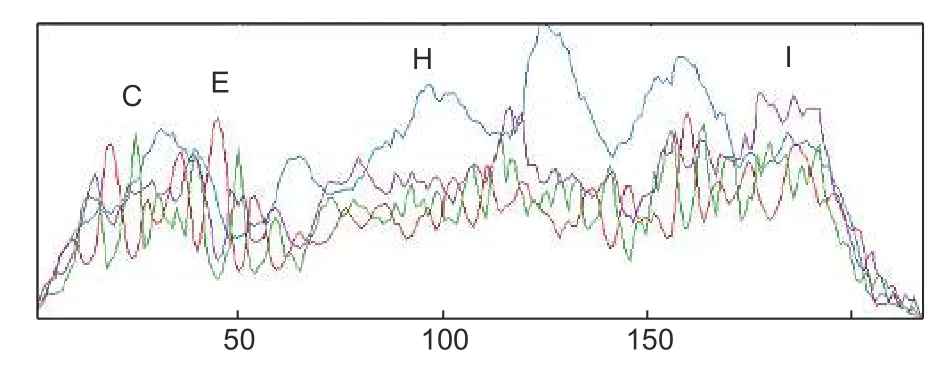
图4 CoSOC1-like 蛋白的二级结构预测Fig.4 Secondary structure prediction of CoSOC1-like protein
2.4 油茶CoSOC1-like 蛋白质的三级结构预测
蛋白质的三级结构是指一条多肽链在二级结构甚至结构域的基础上,依靠氨基酸侧链基团的疏水作用、范德华力及氢键和静电作用,进一步盘旋和折叠形成特定空间结构。油茶CoSOC1-like 蛋白三级结构(图5)表明:CoSOC1-like 属于SRF-LIKE家族的蛋白质,预测的油茶CoSOC1-like 三级结构的肽链与二级结构的预测结果较一致。在CoSOC1-like 蛋白质的氨基端有2 个明显的α-螺旋(红色和黄色螺旋部分),属于蛋白的MADS-box区域;中间部分有2 个同向平行的折叠延伸链,还有一个较长的α-螺旋(青绿色α-螺旋部分)属于K-box 域;蛋白的羧基端是无规卷曲(深蓝色部分)。整个蛋白质折叠成了一个紧密的并且有“空穴”(活性部位)的空间结构,这种结构与它结合DNA 和激活基因转录功能相适应。
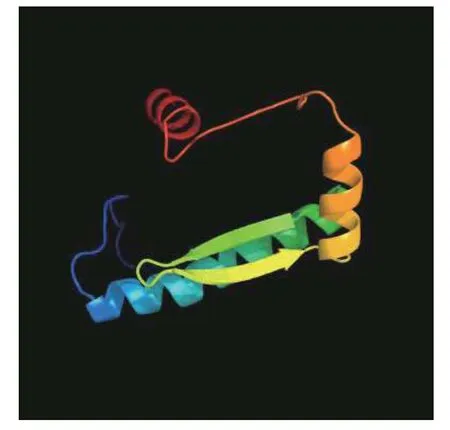
图5 CoSOC1-like 蛋白质三级结构预测Fig.5 Tertiary structure prediction of CoSOC1-like protein
2.5 油茶CoSOC1-like 蛋白的亚细胞定位和磷酸化位点分析
预测油茶CoSOC1-like 蛋白质的亚细胞定位表明:油茶CoSOC1-like 蛋白没有信号肽存在,不是外分泌蛋白;在蛋白质153 位上存在亮氨酸拉链模式(LKEKEKVLTAENAKLCEKYGLL),3 位上存在SRF 型转录因子DNA 结合和二聚化结构域(RGKTQMRRIENATSRQVTFSKRRNGLLKKAFE LSVLCDAEVALIIFSPRGKLYEF),CoSOC1-like位于细胞核的可能性最大,其次为线粒体中(表2)。
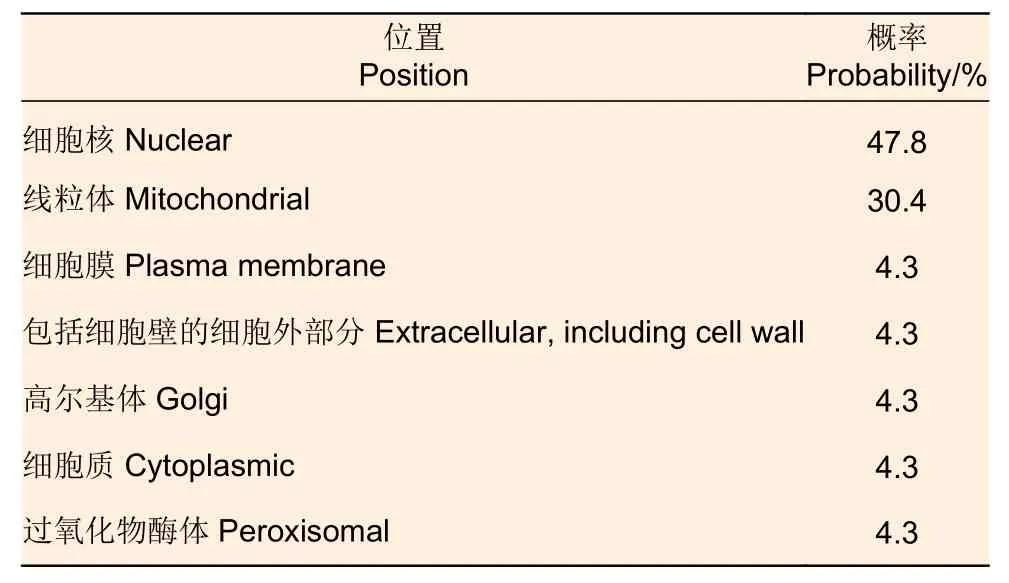
表2 CoSOC1-like 蛋白质亚细胞定位分析结果Table 2 Subcellular localization prediction of CoSOC1-like protein
将CoSOC1-like基因与载体pBI121-EGFP 融合,构建的pBI121-CoSOC1-like-EGFP 融合载体转化洋葱表皮细胞,以转化空载体的洋葱表皮细胞作为对照,在荧光显微镜下观察发现,对照中整个洋葱表皮细胞(包括细胞质和细胞核)都发出绿色荧光(图6 a、c),说明该空载体是有作用的;融合载体转化的洋葱表皮细胞中只有细胞核中发出绿色荧光(图6 d、f),说明CoSOC1-like 蛋白不是定位于线粒体,而是定位于细胞核中。
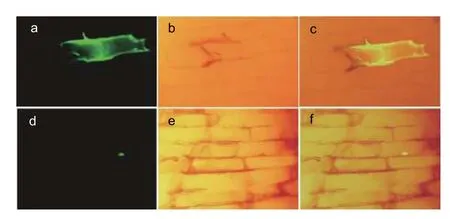
图6 荧光显微镜(200X)下观察CoSOC1-like 蛋白在洋葱表皮细胞中的定位Fig.6 Localization of CoSOC1-like protein in oinion epidermal cells observed in a fluorescence microscope(200X)
对CoSOC1-like 蛋白序列修饰位点分析表明:CoSOC1-like 蛋白含有17 个丝氨酸磷酸化位点、10 个苏氨酸磷酸化位点、4 个酪氨酸磷酸化位点,说明该蛋白活性受磷酸化作用。油茶CoSOC1-like 转录因子可能是通过蛋白质磷酸化激活,与有关基因的启动子区相互作用达到调节靶基因表达的目的。
2.6 油茶CoSOC1-like 蛋白序列系统发育分析
对油茶CoSOC1-like 蛋白与茶树、地花(Monotropa hypopitysLinn.)、猕猴桃、小果咖啡(Coffea arabicaL.)、鸡血藤(Spatholobus suberectusDunn)、大豆、加州白栎、栓皮栎(Quercus suberL.)、杨梅、山核桃、核桃、拟南芥、麻疯树(Jatropha curcasL.)、烟草、河岸葡 萄 (Vitis ripariaMchx.)、蓖 麻 (Ricinus communisL.)、小 麦(Triticum aestivumL.)、水稻 (Oryza sativa‘ Japonica Group’)、高 粱(Sorghum bicolorL.)、玉米等植物SOC1 及其同源蛋白,在氨基酸水平构建系统进化树,结果(图7)表明:以小麦、水稻、高粱、玉米等单子叶植物SOC1 及其同源蛋白作为外群,可以将比较的其他植物SOC1 及其同源蛋白分为2 个分化类群。第1 个类群中包含油茶CoSOC1-like、茶树2 个SOC1-like、地花SOC1、猕猴桃的SOC1e和SOC1i、小果咖啡SOC1-like、鸡血藤SOC1、大豆的SOC1、加州白栎SOC1、栓皮栎SOC1 isoform X1、杨梅SOC1、山核桃的SOC1、核桃SOC1-like、拟南芥SOC1、麻疯树SOC1 isoform X1,自展支持率为100%;油茶CoSOC1-like 与茶树2 个CsSOC1-like 聚类在同一个进化支上,自展支持率为100%。第2 个类群包括茶树SOC1-like isoform X1 和X2、烟草SOC1-like、河岸葡萄SOC1、蓖麻的SOC1,自展支持率为100%。说明油茶的CoSOC1-like 与茶树SOC1-like 的亲缘关系最近,与猕猴桃SOC1e 和SOC1i、地花SOC1 的亲缘关系较近,与小果咖啡SOC1-like、鸡血藤SOC1、大豆的SOC1、加州白栎SOC1等的亲缘关系较远,与茶树的SOC1-like isoform X1 和X2、烟草SOC1-like、河岸葡萄和蓖麻的SOC1 的亲缘关系更远。这说明油茶CoSOC1-like具有较高种属特性,可为今后研究油茶CoSOC1-like基因的功能提供相应的参考。
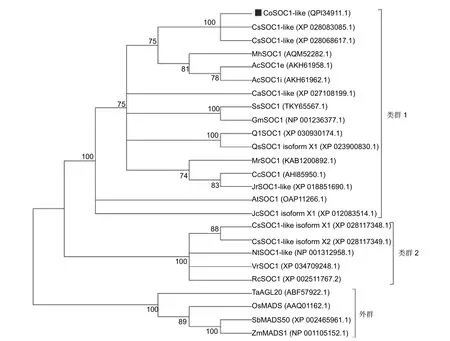
图7 油茶CoSOC1-like 与其他物种SOC1 同源蛋白的系统进化树分析Fig.7 Phylogenetic evolutionary tree analysis of CoSOCl-like and homologous SOC1 proteins form other plants
2.7 油茶CoSOC1-like 基因的表达分析
为了理解油茶CoSOC1-like基因的表达情况,分析了不同生长发育时期的油茶各个器官的基因表达量。对处于开花后期油茶植株的根、茎、叶、营养芽、花瓣、雄蕊、柄托雌(花柄、花托和雌蕊部分)等部位进行了荧光定量RT-PCR 分析,结果(图8)表明:CoSOC1-like基因在所检测的各个部位都有表达,其中,在根和茎中表达水平相对较高,在叶片、营养芽、花瓣、雄蕊和柄托雌等部位表达水平相当。对处于花芽生理分化期油茶的各个器官的荧光定量RT-PCR 分析结果(图9)表明:CoSOC1-like基因在花芽中的相对表达量最多,在根、茎、叶、顶芽、营养芽、幼果中都有一定的相对表达量且表达量相当。对处于雌蕊和雄蕊形成期油茶的各个器官的荧光定量RTPCR 分析结果(图10 A)表明:CoSOC1-like基因在花芽中的相对表达量最多,在根、茎、叶、营养芽、果皮和种子中的相对表达量差别不大。对花芽处于子房和花药形成期油茶的各个器官的荧光定量RT-PCR 分析结果(图10 B)表明:CoSOC1-like基因在花芽中的相对表达量最多,在根、茎和叶中的相对表达量较多,在营养芽、果皮和种子中的相对表达量较少,并且在营养芽、果皮和种子中有一定的绝对表达量。这些结果说明,CoSOC1-like基因不仅可以调节生理分化期、雌蕊和雄蕊形成期、子房和花药形成期的花芽生长分化,也可以调节根、茎、叶、营养芽、果皮和种子的生长发育。
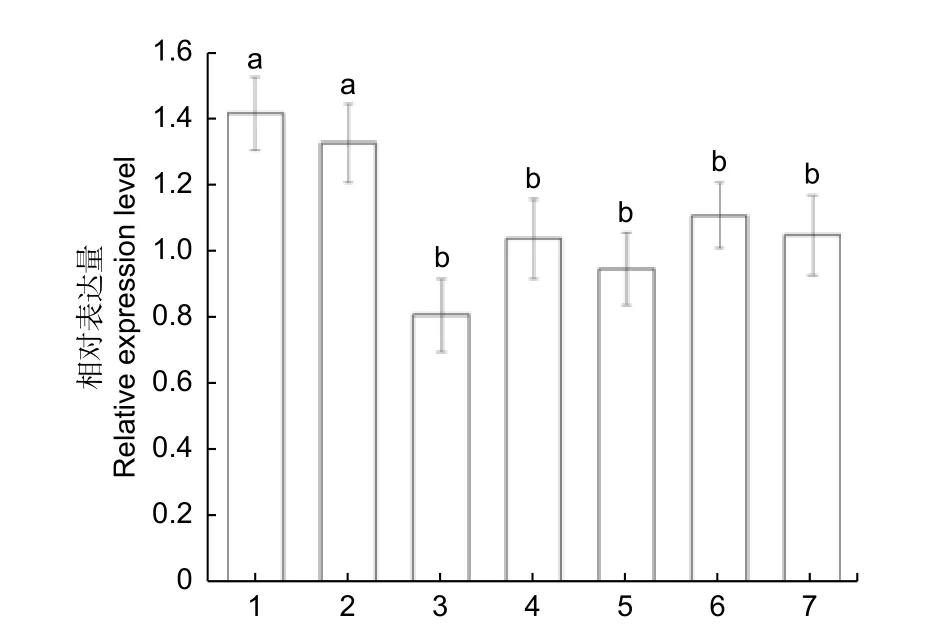
图8 油茶开花后期的CoSOC1-like 基因在不同部位的相对表达量Fig.8 Relative expression level of CoSOC1-like gene of different parts of Camellia oleifera in the late flower stage
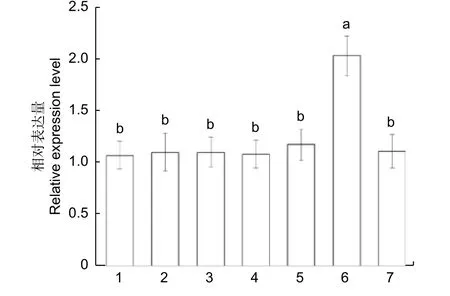
图9 油茶花芽生理分化期的CoSOC1-like 基因在不同部位的相对表达量Fig.9 Relative expression level of CoSOC1-like gene of different parts of Camellia oleifera in the stage of physiological differentiation of flower bud
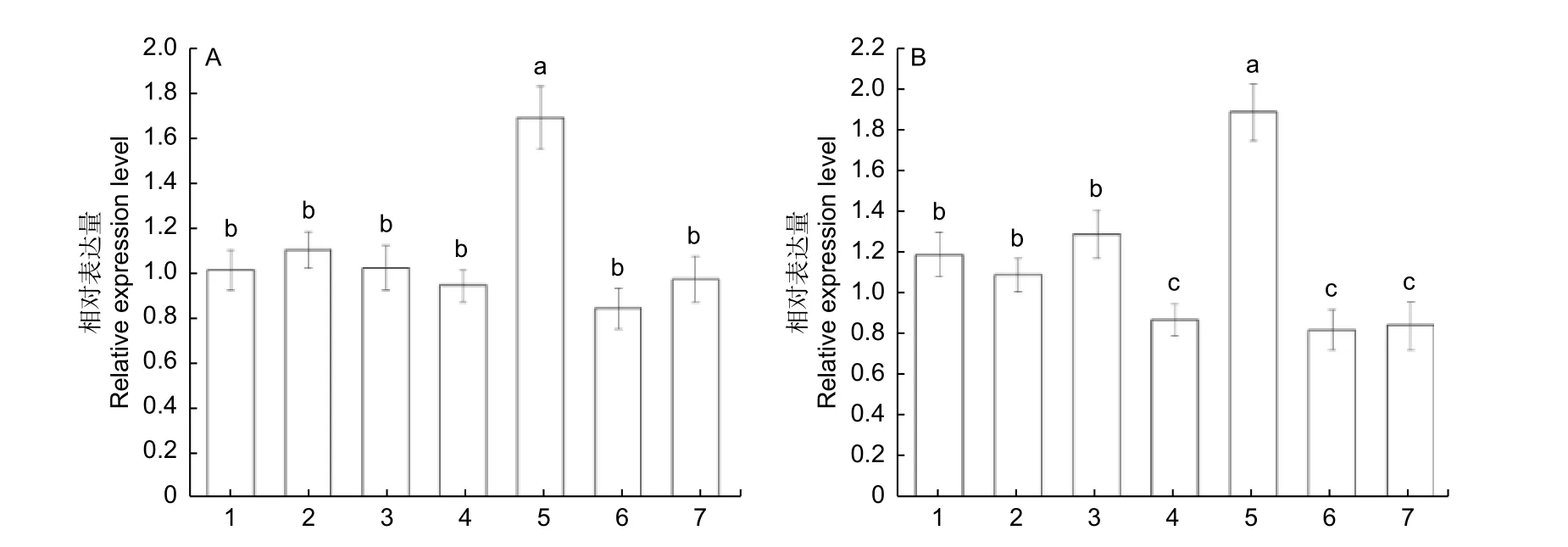
图10 油茶花芽不同分化期的CoSOC1-like 基因在不同部位的相对表达量Fig.10 Relative expression level of CoSOC1-like gene of different parts of Camellia oleifera in the stages of different differentiation of flower bud
3 讨论
植物从幼年期生长到成熟期以后,就进入成花阶段。这个阶段包括植物感受开花信号的刺激,诱导植物从营养生长向生殖生长转化的成花诱导阶段,花的分生组织分化成花原基和花器官原基的分化阶段以及花器官形成和生长等3 个阶段[27-28]。SOC1基因是开花整合子基因,能够感受光周期途径、自主/春化途径、赤霉素途径、糖类途径和温敏途径等开花刺激途径中的信号,诱导花分生组织特征的表达和花器官的形成,促进植物开花[29-31]。
本试验根据在很多物种中存在的SOC1同源基因序列,利用RACE 方法,成功地从油茶中克隆出油茶SOC1同源基因cDNA 序列,命名为CoSOC1-like,基因编码区654 bp 核苷酸,编码217 个氨基酸,GenBank 登陆号为MT036382。同源蛋白质比对结果表明,油茶CoSOC1-like 蛋白具有MADS-box 家族基因的typeⅡ型结构,包含MADS-box、I-domain、K-box 和C-domain 4 部分,且在C 结构域含有SOC1MOTIF 结构,属于SOC1/TM3 型亚家族基因,是一个MADS-box 家族转录因子[32]。蛋白序列分析表明,油茶的CoSOC1-like 蛋白没有跨膜螺旋区,不含信号肽,含有SRF 型转录因子结合DNA 的结构域;基因瞬时表达表明CoSOC1-like 蛋白定位于细胞核,与绿竹SOC1-like[33]和小麦TaSOC1-like 蛋白[34]的定位是一致的,符合转录因子的结构特点和亚细胞定位特征。油茶CoSOC1-like 蛋白有31 个磷酸化位点,它的二级结构和三级结构的多肽链特征与它的一级结构是一致的,该蛋白的三级结构表现出的紧密又有活性部位的空间结构,说明CoSOC1-like 蛋白通过磷酸化作用结合DNA 并激活基因的转录作用。
系统进化树分析表明,油茶CoSOCl-like 蛋白与茶树SOC1-like 蛋白聚为一枝,亲缘关系最近,其次与猕猴桃SOC1e 和SOC1i、地花的SOC1的亲缘关系较近,与小果咖啡SOC1-like、鸡血藤和大豆以及拟南芥的SOC1 等的亲缘关系较远,与茶树的SOC1-like isoform X1 和X2、烟草SOC1-like、河岸葡萄和蓖麻的SOC1 的亲缘关系更远,说明油茶CoSOC1-like 具有独特的序列特征。由于茶树CsSOC1-like 具有调节茶树开花时间作用[35],因此,推测油茶CoSOCl-like 也能够调节油茶的开花时间。
植物的SOC1-like基因的功能具有多样性。苜蓿的SOC1-like基因MtSOC1a不仅可以促进开花,还可以促进主茎的伸长[36];过表达矮牵牛的SOC1-like基因能够促进烟草的花瓣和叶片的光合作用,并增强烟草对高温的耐受性[37]。基因表达分析结果表明,CoSOC1-like基因在油茶不同发育阶段的营养器官和生殖器官中都有表达,这一个特点与松树中SOC1-like基因MADS11的表达类似[38]。CoSOC1-like基因在花芽生理分化期、雌雄蕊形成期和子房花药形成期的花芽中的相对表达量最多,在根、茎、叶、顶芽、营养芽、幼果、种子中都有一定量的相对表达量,这个特点与核桃MADS-like基因在花芽中的相对表达量最高相似,但是又不同于核桃的根、茎、叶中相对表达量很低的特点[39];在子房和花药形成期的果皮和种子中CoSOC1-like的相对表达量低,这与梅花PmSOC1-like基因在果实和种子中相对表达量低一致[40]。在开花后期,CoSOC1-like基因在根和茎中相对表达量较多,在叶片、营养芽、花瓣、雄蕊和柄托雌等部位表达水平相当。说明油茶CoSOC1-like基因除了参与油茶的花芽分化以外,还可能参与油茶的根、茎、叶和种子等其他器官的生长发育过程。这些研究结果为进一步研究CoSOC1-like基因在油茶中的成花机理奠定了基础。
4 结论
本研究成功克隆了油茶的CoSOC1-like基因。CoSOC1-like 蛋白定位于细胞核,含有MADS-box、K-box、I 区和C 区,属于典型的MIKC 型蛋白的转录因子;CoSOC1-like 蛋白与同属植物茶树的CsSOC1-like 的亲缘关系最近。CoSOC1-like基因在油茶的生理分化期、雌雄蕊形成期、子房和花药形成期的花芽中相对表达量最高,在果皮和种子中的相对表达量较低,说明CoSOC1-like基因在油茶的花芽分化中有重要的调节作用。本结果为进一步研究油茶CoSOC1-like基因的功能奠定了理论基础,为后续应用转基因技术调控CoSOC1-like基因表达水平来调节油茶花期提供了理论依据。

