核桃JrWOX4b 基因的克隆和功能分析
雷夏烁,常英英,2,张 普,宋晓波*,白永超,裴 东
(1.林木遗传育种国家重点实验室,国家林业和草原局林木培育重点实验室,中国林业科学研究院林业研究所,北京 100091;2.河南师范大学生命科学学院,河南 新乡 453007)
根系是植物在长期适应陆地生境过程中形成的重要器官,是植物枝繁叶茂和抵御逆境的基础。根系主要由两种类型组成,一是在胚胎的发育过程中形成的主根,二是胚后发育过程中产生的根,包括侧根和不定根[1]。不定根的形成会出现在茎和叶等器官中,它需要激素刺激细胞分裂发育成的根原基。促进“不定根的形成”是大多数林木和园艺作物无性繁殖和工厂化育苗的核心工作[2]。因此,不定根发生能力这一性状在林木遗传改良中占有重要的地位,不定根发生分子调控机制的解析也成为当前林木遗传改良的重要研究内容之一。在过去的几十年中,有关拟南芥(Arabidopsis thalianaL.Heynh.)、水稻(Oryza sativaL.)和玉米(Zea maysL.)等草本模式植物不定根发生遗传调控机制的研究,已经获得丰硕的成果[3],而针对多年生木本植物特别是难生根木本植物不定根发生的研究却相对缺乏。
近年来,随着分子遗传学和测序技术的飞速发展,各类转录因子在植物发育生物学领域的调控作用受到越来越多的关注,其中,植物特有的WUSCHEL-RELATED HOMEOBOX(WOX)基因家族[4],能够通过影响分生组织中干细胞的分裂和分化,调控植物生长发育过程中的胚胎发育、微管系统发育和侧生器官发生等生物学过程[5-6]。在水稻中,OsWOX4基因被证明参与茎尖分生组织的调控,还能够通过调节生长素在水稻初生根的极性运输来控制水稻初生根的伸长[7]。在拟南芥中,AtWOX5与SCR、SHR、PLT基因一同调控根尖干细胞生态位的形成与稳定[8]。在苜蓿中,MtWOX5与MtPLT、MtBBM1基因共同调节根尖分生组织的形成[9]。在杨树中,PtoWUSa可通过调节生长素转运基因PIN的表达,从而控制生长素的极性运输,以此来完成对杨树不定根发育的调控[10-11]。WOX5/7还可以在WOX11/12的作用下激活表达,进而在根原基起始过程中发挥着关键调控作用[12]。GhWOX13基因在棉花纤维中的特异性高表达,暗示着其对棉花纤维形成的调控作用[13]。综上可见,WOX基因家族不同成员在功能方面存在分化,相同成员在不同物种中的作用是保守性和特异性并存的。因此,借鉴模式植物相关研究成果,并从中寻找林木特色调控机制是十分必要的。
优良砧木无性繁育体系的建立,是实现经济林产业整株无性系化的关键。然而,核桃等经济林树种很难产生不定根,特别是随着树龄的增长,其不定根发生能力显著降低甚至完全丧失,严重制约了优良砧木良种的推广应用。本课题组前期通过连续多次嫁接和黄化处理等手段,成功诱导成龄植株复幼,结合IBA(3-吲哚丁酸)等生长调节剂处理,实现了核桃等多个难生根树种的高效扦插繁殖[14]。并通过对WOX基因家族的表达模式分析发现,JrWOX4b基因的表达水平发生在不定根发生过程中显著上调表达,推测其在不定根发生过程中发挥了重要调控作用[15]。因此,本研究在前期工作基础之上,通过对JrWOX4b基因的克隆、生物信息学分析和亚细胞定位,分析其序列和表达特性,重点通过对‘84K’杨的遗传转化和表型分析鉴定其在不定根发生方面的作用,研究结果不仅有助于丰富植物器官从头建成的发育生物学理论,也能指导开展植物优良品种的快速繁殖,对农、林、园艺的发展都具有重要的意义。
1 材料与方法
1.1 材料
核桃品 种‘ 林早香’(Juglans regia‘Linzaoxiang)’幼嫩叶片用于总RNA 提取和基因克 隆;3 周龄银腺杨‘84K’(Populus alba×P.glandulosacl.'84K')无菌苗自上而下第3~4 片叶片用于遗传转化;4~5 周龄野生型烟草自上而下第6~8 片叶片用于亚细胞定位分析。核桃品种‘林早香’2 年生盆栽苗和野生型烟草植株均保存在中国林科院科研温室。‘84K’杨无菌苗保存于林木遗传育种国家重点实验室组培室,培养条件为:温度23~25 ℃,光照周期16/8 h(光照/黑暗)。
1.2 方法
1.2.1 核桃JrWOX4b基因CDS 的克隆和生物信息学分析 总RNA 的提取使用EASY spin Plus植物总RNA 快速提取试剂盒(艾德莱,北京),1.0%琼脂糖凝胶电泳和NanoDrop2000 微量分光光度计检测总RNA 完整性和浓度。PeimeScript RT reagent Kit with gDNA Eraser 反转录试剂盒(Takara,日本)合成cDNA 第一链。根据NCBI 中登陆的核桃JrWOX4b的基因序列(Genbank 登录号:XM_019000128.1)设计JrWOX4b基因CDS区全长序列的PCR 扩增引物(表1),以‘林早香’核桃的cDNA 为模板进行PCR 扩增。利用在线工具ExpasyProtParam(http://web.expasy.org/protparam/)对JrWOX4b基因序列特征进行分析,氨基酸序列多重比对和系统进化树构建使用MEGA软件[16]完成。

表1 引物序列Table 1 Primer sequences used in this study
1.2.2 JrWox4b 蛋白亚细胞定位分析 根据前期克隆得到的JrWOX4b基因CDS 序列(引物见表1),通过gateway 系统BP 反应将其连接至中间载体pDONR222.1 并测序,随后将目的基因亚克隆至载体 pEarlyGate104,得 到35::YEPJrWOX4b的融合表达载体,电击转化农杆菌GV3101。农杆菌菌液培养OD600至0.5~1.0,离心后用侵染液重悬菌液至OD6000.8 左右,并注射烟草叶片。培养2 d 后,使用共聚焦显微镜(LSM510)进行JrWOX4b 蛋白的亚细胞定位观察,荧光成像参数为YFP/FM464:488/543 nm 和505~530/585 nm 接受滤镜。
1.2.3JrWox4b基因植物过表达载体构建及‘84K’杨遗传转化 通过Gateway 系统的BP 反应构建JrWOX4b基因的入门载体P1-JrWOX4b-P2,通过LR 反应将JrWOX4b基因构建于过表达载体PMDC32 中,得到35::JrWOX4b过表达载体,并通过电击法转化至农杆菌感受态GV3101 中,参照张利[17]的方法,通过叶盘法转化‘84K’杨:以生长3 周的‘84K’杨组培苗(顶端向下3~4 片叶片)为材料,农杆菌菌液OD600培养至0.6~0.8 后,将叶片在菌液中浸泡10 min,用滤纸吸净表面菌液后转入不定芽诱导培养基(MS+3 mg·L-1潮霉素+200 mg·L-1特美汀+0.5 mg·L-16BA+0.05 mg·L-1NAA)上诱导和筛选不定芽。在经过大约30 d 的不定芽诱导后将抗性不定芽更换至生根培养基(1/2MS+3 mg·L-1潮霉素+200 mg·L-1特美汀+0.05 mg·L-1IBA)的诱导生根培养基,直至诱导出不定根。
1.2.4 转基因阳性植株的鉴定 提取转基因抗性植株和对照‘84K’植株的基因组DNA,PCR 检验目的基因的插入。利用筛选出的阳性转基因植株为材料,提取抗性植株总RNA,反转录为cDNA,qRTPCR 检测JrWOX4b基因在转基因植株中的相对表达量(引物序列见表1)。
1.2.5 转基因‘84K’杨不定根相关表型分析 每个阳性遗传转化株系和对照‘84K’株系分别扩繁至30 株。取茎尖扦插于不定根诱导培养基中,诱导不定根发生。诱导0~6 d 内在体视显微镜下观察茎段基部的形态学变化。诱导后14 d 统计不定根数量和长度。
1.2.6 数据处理和分析 通过Microsoft Excel 和SPSS18.0 软件对试验数据进行整理和单因素方差分析,显著性差异水平设定为0.05,当P≤0.05时表示对比的样本间有显著性差异。
2 结果分析
2.1 核桃JrWOX4b 基因克隆和生物信息学分析
以‘林早香’核桃叶片cDNA 为模板进行JrWOX4b基因的PCR 扩增,切胶回收和测序结果显示:JrWOX4b基因CDS 区长度为678 bp,编码226 个氨基酸,分子量为25.42 KDa;理论等电点(pI)为9.16,带负电荷残基总数(Asp +Glu)为28,带正电荷残基总数(Arg+Lys)为34;脂肪族指数为54.82,平均亲水性为-0.908,属于亲水蛋白,定位于细胞核。氨基酸序列多重比对结果(图1)显示:JrWOX4b 蛋白具有1 个同源异型HD 结构域,属于典型的WOX 家族成员。为了分析JrWOX4b 蛋白在不同植物间的亲缘关系,应用 MEGA7.0 软件,采用 Neighborjoining 方法将核桃JrWOX4b 与其他9 个物种的同源蛋白进行系统进化分析,聚类结果显示:核桃JrWOX4b 与山核桃属的长山核桃(Carya illinoensis)同源蛋白遗传关系最近,与壳斗科栎属白栎(Quercus lobata)次之,而与禾本科的黍稷(Panicum miliaceum)和二柄 短穗草(Brachypodium distachyon)亲缘关系最远(图2)。

图1 核桃JrWOX4b 与其他植物的氨基酸序列多重比对Fig.1 The alignment of amino acid sequences of JrWOX4b in walnut and other plants

图2 JrWOX4b 与其同源序列的系统进化分析Fig.2 Phylogenetic analysis of JrWOX4b and its homologous
2.2 亚细胞定位分析
为了确定JrWOx4b 蛋白在细胞中的表达位置,进而明确其作用机制。将35S::YFP-JrWOX4b融合表达载体在烟草叶片中瞬时表达,结果(图3)表明:在288 nm 的条件下激发,烟草下表皮细胞的细胞核呈现明显的黄色荧光信号,且细胞核的轮廓清晰。在与明场叠加后,可见35S::YFPJrWOX4b 黄色荧光蛋白表达的位置在细胞核上。

图3 JrWOX4b 蛋白在野生烟草叶片中的亚细胞定位分析Fig.3 Analysis of Subcellular Localization of JrWOX4b Protein in Wild Tobacco Leaves
2.3 JrWOX4b 转基因阳性植株鉴定
分别提取不同转基因株系和对照‘84K’植株的基因组DNA,通过PCR 验证目的基因的插入,图4A 表明:共鉴定得到JrWOX4b基因过表达阳性株系14 个。进一步通过qRT-PCR 技术检测JrWOX4b在对照‘84K’和转基因注释中的表达水平,结果(图4B)显示:对照组84K 中未检测到JrWOX4b基因的表达,将11#中的基因表达量设为1,在获得的14 个阳性株系中,OE-JrWOX4b-3#、5#、8#、9#、13#的表达量较高,均达到11#表达水平的4 倍以上。
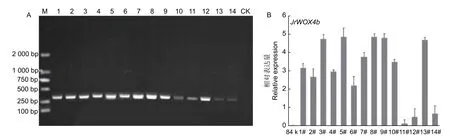
图4 ‘84K’杨阳性再生植株鉴定(A)和JrWOX4b 基因的相对表达量(B)Fig.4 Identification of Populus alba × P.glandulosa cl.‘84K’ positive regenerated plants (A) and relative expression of JrWOX4b gene (B)
2.4 JrWOX4b 基因过表达对‘84K’杨不定根发生的影响
为了分析JrWOX4b基因对于‘84K’杨不定根发生的影响,选取已验证的阳性植株进行不定根诱导试验。诱导过程中,利用体视镜观察‘84K’杨茎段基部形态变化,结果(图5A)显示:在诱导5 d 时JrWOX4b-OE#9 和对照(Control)中同时观察到茎基部出现不定根原基向外突出产生的小突起,诱导6 d 时,JrWOX4b-OE#9 和对照基部可观察到不定根的出现。过表达株系和对照植株在不定根发生时间方面没有显著差异,但过表达植株的不定根粗度增加,并且根尖部位发生明显弯曲(图5B)。
诱导后14 d,过表达和对照株系的不定根相关表型分析结果显示:JrWOX4b基因的过表达能显著促进不定根发生数量,不定根的长度显著缩短(图5B)。在JrWOX4b基因过表达的植株中,不定根的数量为8.3 根,平均不定根的长度约为1.25 cm,对照‘84K’杨的平均不定根数量为3.2根,平均不定根长度为3.26 cm(图5C、D)。
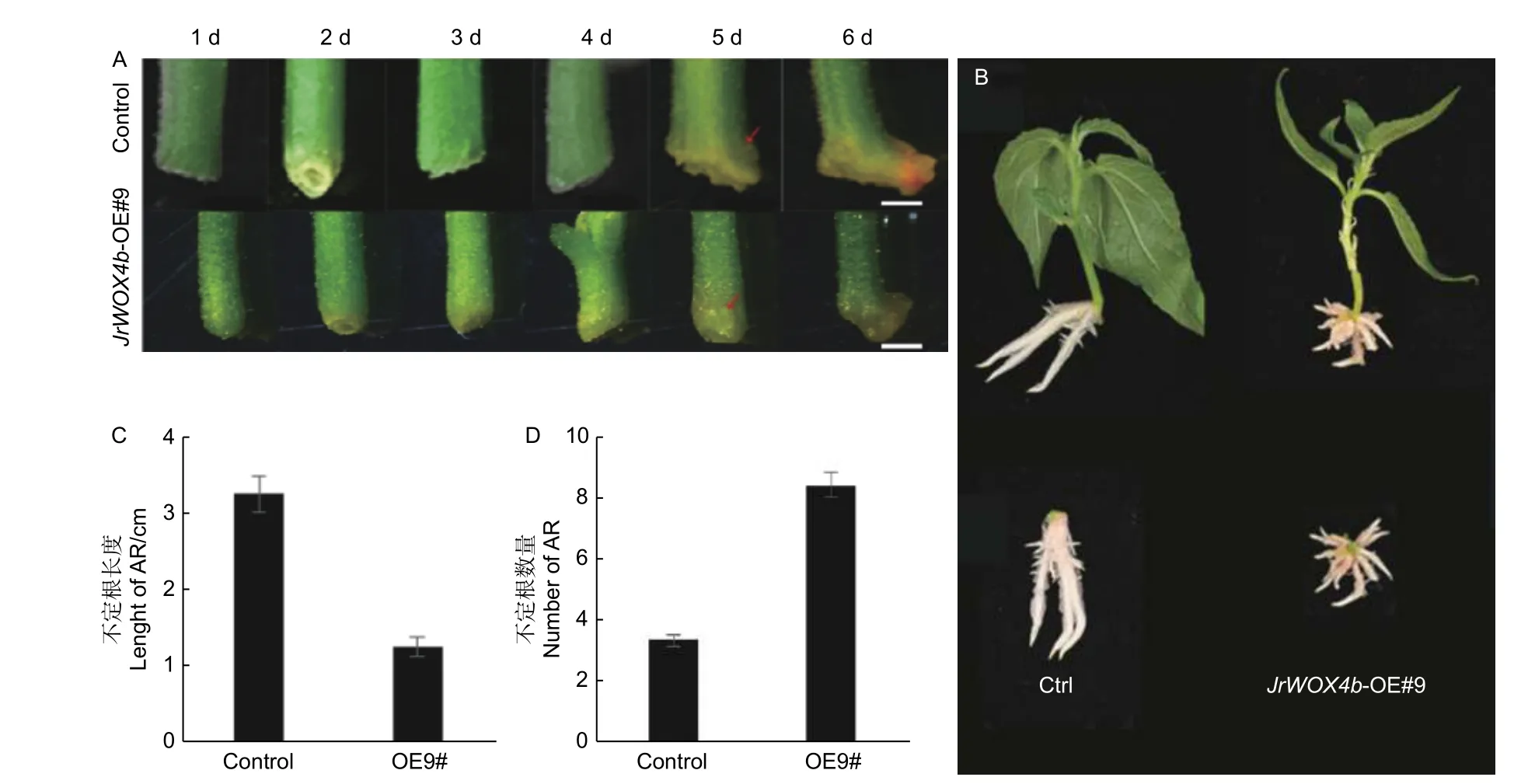
图5 ‘84K’杨阳性转基因植株不定根发生相关表型分析Fig.5 Phenotypic analysis of adventitious root of Populus alba × P.glandulosa cl.‘84K’ positive transgenic plants
3 讨论
通常情况下具有相似的物理和化学性质的蛋白可能具有相似的生物学功能。本研究成功地从核桃中克隆到1 个WOX转录因子家族成员基因JrWOX4b,其编码氨基酸的多重序列比和系统进化分析结果显示,该基因编码的JrWOX4b 蛋白与山核桃属的长山核桃同源蛋白具有97.79%的高相似性,并且具有典型的HOX 结构域,说明WOX4b基因在生物演变过程中的高度保守性,同时也说明JrWOX4b基因可能具有WOX 转录因子家族在分生组织调控方面的功能。
根原基的形成是不定根发生的先决条件。前人研究结果显示,不定根原基原始细胞通常为具有潜在分生能力的细胞,如形成层、中柱鞘或者薄壁细胞等[18]。对于草本植物而言,不定根起始于下胚轴或叶片微管组织中的形成层细胞。在木本植物中,不定根通常起源于茎段微管组织中的形成层细胞或近缘的薄壁细胞[19]。作为植物中最重要的转录因子家族之一,WOX基因家族成员在干细胞维持和分生组织中重要的调控作用已得到研究人员的广泛关注[20]。拟南芥、杨树等模式植物有关研究过程中也发现,WOX4/5/11等WOX家族成员表达水平变化会显著影响植物的不定根发生能力[21-22]。本研究中,笔者通过对JrWOX4b基因的过表达能显著促进转基因‘84K’杨的不定根数量,并显著抑制不定根的伸长,证实了其在不定根发生过程中的调控作用。植物激素在植物不定根形成中起着重要的作用,IAA 能够通过调节茉莉酸(Jasmonic Acid,JA)的稳态来调控不定根的形成,但JA 会破坏不定根的根尖优势,抑制不定根的根尖伸长[23]。ABA 对不定根的形成和发育有多种作用,较低浓度的ABA 会促进不定根的形成,但同时ABA 也会抑制不定根的伸长[24]。LkWOX4过表达植株中不定根内JA 和ABA 含量升高,IAA 含量降低,这可能是不定根数量增多但长度缩短的原因[25]。因此,笔者推测JrWOX4b基因的过表达可能通过对转基因植株中内源激素的含量和分布影响,促进了不定根的发生,同时也抑制了其伸长。这一推测,笔者将通过对转基因植株内源激素和基因表达水平的分析进一步研究。
研究过程中,笔者还观察到JrWOX4b过表达的‘84K’杨叶片边缘向着近轴面卷曲的现象。据报道,在杨树中,PtWOX4的过量表达也会导致杨树叶片的卷曲[26],原因可能是PtWOX4的超量表达影响了叶片维管的正常发育,进而导致叶片与叶脉的夹角改变,与本研究中观察到的表型相似。同样,在水稻中,与JrWOX4b基因同属于WUS 分支的OsWOX3b,其缺失突变体同样也会影响水稻叶片的形状[27],但其中的深层机制仍需进一步的试验探索。
4 结论
本研究从核桃叶片中成功克隆了WOX基因家族成员JrWOX4b基因,该基因编码的蛋白具有WOX 家族成员特有的保守结构域。亚细胞定位分析发现,JrWOX4b 蛋白定位于细胞核。基因功能分析结果显示,JrWOX4b基因的过表达可显著促进转基因植株的不定根数量,暗示了其在不定根发生方面的重要作用。研究结果不仅能够为其他难生根树种不定根发生的研究提供优良基因资源,同时也为林木和园艺作物优良品种的快速繁殖提供理论支撑。

