市政排水管网水力水质条件对底泥微生物组多样性的影响
丁国平,陈 浩,朱 弈,孙晓楠,刘 辉,马长文,叶建锋*
1. 上海第二工业大学工学部,上海 201209
2. 上海市环境科学研究院,上海 200233
3. 东华大学环境科学与工程学院,上海 201620
市政重力流排水管网中存在着较大的碳排放现象,污水和雨水中大量有机物在管网输送过程中被微生物降解消耗[1],这直接导致了下游污水厂普遍出现进水碳源不足的现象[2-3]. Mclellan等[4]认为,管网底泥中的微生物是其碳转化的重要执行者,多样的微生物利用管网缺氧环境对有机物进行水解发酵、产甲烷、硫酸盐还原,并完成自身菌体的繁殖生长与代谢.因此,研究重力流管网中底泥微生物菌群结构的变化规律具有重要意义.
目前对城市排水系统底泥微生物多样性的研究多集中于污水处理厂和河道,且其均受不同水力水质条件的影响. 而重力流排水管网内水力水质条件的变化是否会影响底泥微生物组的多样性,进而影响微生物碳转化的策略与效率,却鲜见报道. 污水处理厂和河道的底泥微生物通过选择性地消耗特定的底物,进行不同的生长和碳分配,其底物的性质受化学因素(如pH、不同碳的来源、SO42-浓度等)影响. 另外,一些物理因素(如温度、剪切力等)大多会通过影响有机物组成和微生物群落状态,造成碳转化的差异. 例如,已有研究发现,河流pH的变化可以引起藻细胞膜电荷的变化以及影响代谢过程中酶的活性[5],当pH为10时,对细菌群落产生更多的挥发性脂肪酸(VFA)有缓冲作用[6];Schulz等[7]研究发现,康斯坦斯湖底泥中温度每升高10 ℃,细菌代谢速率将增加2~3倍,这表明温度是影响微生物细胞内某些酶活性的重要因素,进而影响微生物的生长速率和微生物对基质的代谢速率;Liu等[8]对高海拔湖泊有机物的研究发现,较大的剪切力有利于促进有机物在底泥中的渗透,对碳的转化效率有显著的影响. 不同碳源可能会影响微生物的丰度,在污水处理厂相似的污染进水源中,微生物群落具有相似性[9],而不同的进水源会影响活性污泥菌群组成和多样性[10]. 尽管早在1992年就有少数研究团队已经注意到了重力流管网底泥中的一些生物行为[11],但对底泥生物的研究却主要集中在生物作用下底泥的形成过程和管道腐蚀等方面[12-13],很少有研究致力于不同水力水质工况对底泥微生物多样性变化的影响.
该研究通过控制上覆水的剪切力、温度、SO42-、pH、外源性碳这5个水质水力工况进行批次试验,应用微生物16S rRNA基因测序分析方法,对微生物的相对丰度、多样性结构和微生物组间差异显著性检验进行分析,并结合三维荧光光谱法(EEM)以及底泥COD降幅,探究不同环境因子对底泥中微生物组多样性的影响,以期通过控制水力水质工况减少市政重力流排水管网中微生物碳转化的现象.
1 材料与方法
1.1 采样点布设
该研究所用污水和雨水管网底泥分别于旱季采自上海某排水系统a、b管网. 其中a管网为生活小区污水管支管,承接完全的生活污水. 径流雨水采自b管网沿管雨水篦,为完全的路面雨水径流. 底泥于旱季采集自c、d、e管网. 生活污水、径流雨水和初始底泥间隙水经0.22 μm聚醚砜滤膜后,测定其COD、TN和SO4
2-浓度(见表1).

表 1 初始水样和底泥中的指标浓度Table 1 Index concentration in initial water sample and sediment
1.2 批次试验
为模拟重力流排水管道内黑暗厌氧环境和泥液分层的环境,该研究采用文献[14]的设计理念,设计了直径为140 mm、高度为210 mm反应器(见图1).该反应器上部密封盖设有气体出入口、水样采集口、温度计和搅拌器. 试验前先将底泥用0.4 mm筛滤去石头、树枝等大型固体物,再将0.6 L底泥和2.3 L上覆水置入反应器中. 待泥水分层后(约4 h),用锡纸包裹住反应器表面,模拟黑暗环境,引入氮气以保持顶空厌氧,并控制搅拌器转速来调整水力剪切力. 同时,依据底泥微生物生长周期(约为6 d[15])及上海重力流排水管网水力停留时间(旱季为4~6 d),设定反应时间为6 d. 最后取上覆水和泥水交互界面的上层底泥进行16S rRNA基因测序分析.

图 1 市政重力流排水管网模拟反应器示意Fig.1 Schematic diagram of simulated reactor for municipal gravity flow drainage pipe network
为模拟不同水力水质工况,该研究进行批次试验. 其中,为避免雨污水中微生物对底泥中微生物多样性的影响,所有的雨污水样本均通过0.22 μm聚醚砜滤膜,滤去绝大多数的微生物. 因不同碳源试验组的需要,分别设计以超纯水、在超纯水中添加葡萄糖(≥99.5%)、径流雨水以及生活污水为上覆水的试验组,其超纯水和葡萄糖源水水质指标见表1;设计烘干污泥,以研究灭活了绝大部分微生物活性的底泥与不同碳源的上覆水在反应后微生物的变化情况. 此外,不同转速对应不同的剪切力,其剪切力计算方法根据Blasius方程计算. 批次试验设计及样本编号如表2所示.
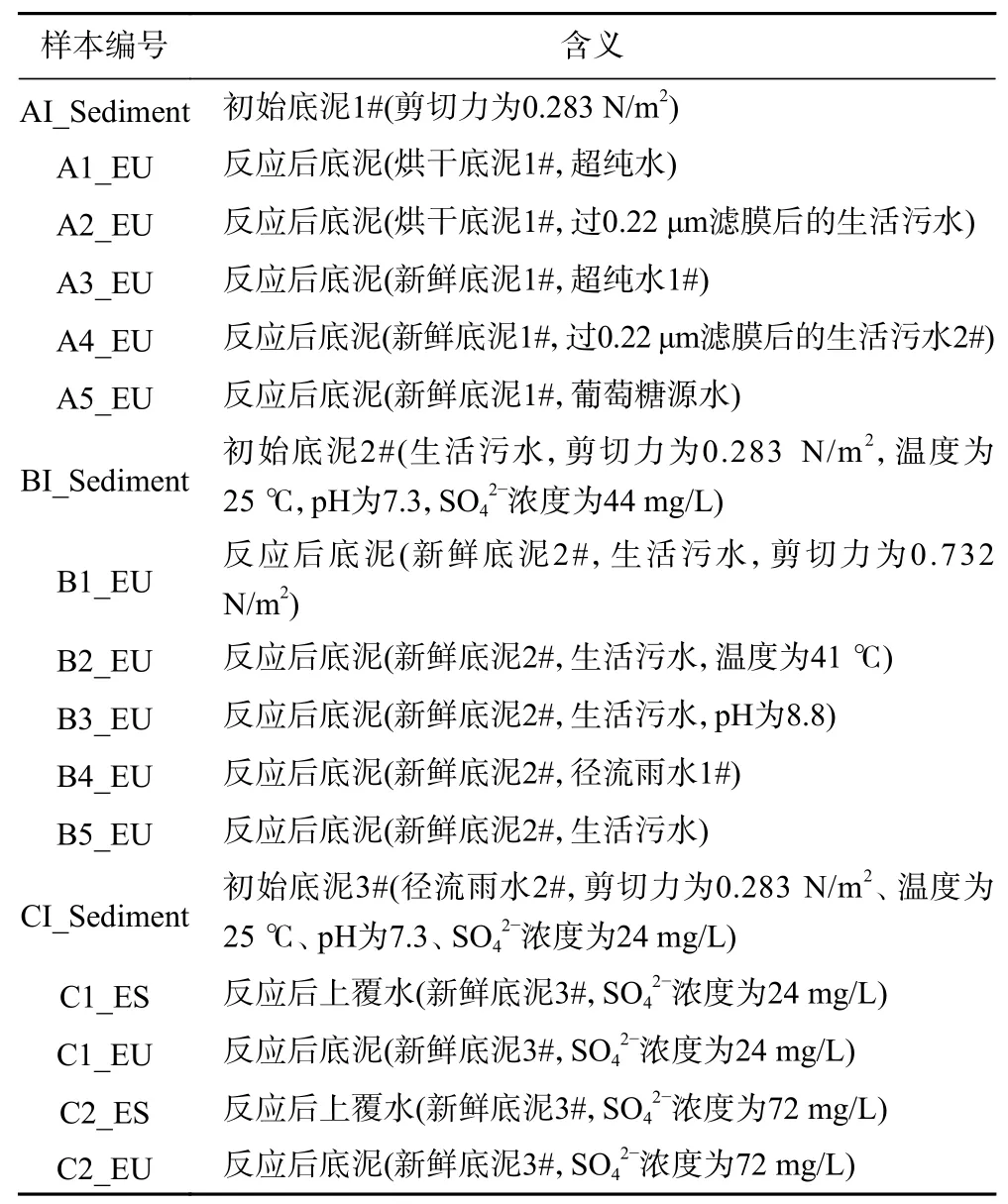
表 2 模拟重力流排水管网批次试验的设计Table 2 Batch experimental design of simulated gravity drainage pipe network
1.3 化学分析
上覆水及底泥的化学指标包括COD、TN、SO42-.底泥的化学指标定义为其间隙水的化学指标,通过将底泥在8 000 r/min下离心,取上清液获得. 根据国家标准方法测定上覆水和间隙水中TN、COD和SO42-的浓度.
结合荧光光谱(EEM)(F-7 100,日本日立公司)分析上覆水和底泥中DOM的组成. 反应前生活污水中主要为色氨酸类有机物(λEx/λEm=270~290 nm/320~350 nm),其多为氨基酸类、肽类及蛋白类物质,一般为新近产生[16]. 径流雨水中主要为腐殖酸及难降解腐殖酸成分(λEx/λEm≤250 nm/380 nm),但微生物对这些成分的转化效率并不高[17]. 因此在控制变量的条件下,通过分析底泥中类色氨酸荧光强度峰值的变化,判断沉积物中的微生物对碳转化效率的不同. 该研究底泥样本中类色氨酸荧光强度峰值见表3.

表 3 底泥样本中类色氨酸荧光强度峰值Table 3 Kurtosis value of tryptophan-like in sediment sample
1.4 微生物16S rRNA基因相对定量测序与分析方法
试验前取约20 mL管网底泥或1 L污水,污水过0.22 μm Whatman GF/F滤膜,至膜上有明显覆盖物后装于离心管,-20 ℃保存(并在一周内测定),用于基因组DNA提取. DNA 提取采用试剂盒Fast DNA Spin Kit (MP bio),提取后以1%琼脂糖凝胶电泳检测. 采用PCR仪(ABI GeneAmp®9700,Applied Biosystems,德国)进行PCR扩增. 参照电泳初步定量结果,将PCR产物用QuantiFluor™-ST蓝色荧光定量系统(Promega公司)进行检测定量,IlluminaMiSeq测序后以silva123/16s_bacteria数据库进行分类学分析[18].
结合微生物的Alpha多样性分析,利用Shannon-Wiener、Simpson、Chao 1和Coverage指数估计环境群落的物种丰度和多样性;用微生物的Beta多样性对底泥微生物群落间的物种多样性进行组间相对定量比较分析. 同时,通过Wilcox秩和检验对组间微生物进行差异显著性分析,判断两样本中微生物的分布是否存在差异,并通过P值判断其显著性.
2 结果与讨论
2.1 微生物Alpha和Beta多样性分析
该研究基于OTU水平,进行Alpha多样性分析,绘出Shannon-Wiener曲线〔见图2(a)〕,曲线坡度随测序深度增加趋于平坦,测序数量足够大,可反映测序样本微生物种群多样性的真实情况. 在16S rRNA测序中共得到651 958条有效序列和28 516个OTUs数. OTUs数以及物种多样性如表4所示.

表 4 细菌多样性指数分析Table 4 Bacterial diversity index analysis

图 2 初始底泥微生物的Alpha和Beta多样性分析Fig.2 Analysis of Alpha and Beta diversity of microorganisms in initial sediment
根据OTUs数以及物种多样性(见表4)可知:不同外源性碳组中,A1_EU微生物群落相对丰度和多样性较反应前降低;A2_EU微生物群落相对丰度和多样性相对A1_EU增大;A3_EU微生物群落多样性低于A4_EU. 此外,B4_EU微生物群落相对丰度和群落多样性均低于B5_EU. 剪切力组中,B1_EU微生物群落多样性略低于B5_EU,且B1_EU微生物群落相对丰度更为明显较低. 温度组中,B2_EU和B5_EU微生物群落多样性相似,但B2_EU微生物群落相对丰度较低. pH组中,B3_EU微生物群落多样性略低于B5_EU,但B3_EU微生物群落相对丰度显著较低.SO42-组中,C2_EU微生物群落多样性和相对丰度与C1_EU相似,但上覆水中C2_ES微生物群落多样性和相对丰度远低于C1_ES.
通过Beta多样性分析可知,底泥1#、2#、3#〔见图2(b)〕微生物在门水平上的优势种主要为Proteobacteria (变 形 菌 门,占 比 为29% ~ 37%)、Bacteroidetes (拟 杆 菌 门,占 比 为24% ~ 39%)、Chloroflexi (绿 弯 菌 门,占 比 为28% ~ 41%)、Firmicutes (厚壁菌门,占比为26% ~ 38%)等. 其中,Proteobacteria、Bacteroidetes及Firmicutes作为管网底泥在门水平上的优势种,是厌氧消化系统中最为重要的发酵菌门[19],可见排水管网内的生化反应过程以发酵作用为主.
属水平上优势种主要为Candidatus_Competibacter(聚 糖 菌 属,占 比 为 6.5%~8.0%)、norank_c_Bacteroidetes_vadinHA17(无分类_拟杆菌门属,占比为4.0%~8.6%)、Defluviicoccus(占 比 为4.7%~3.2%)、Dechloromonas(脱 氯 单 胞 菌, 占 比 为2.8%~5.0%)、vadinBC27_wastewater-sludge_group( 占比为1.1% ~4.9%)等〔见图2(c)〕. 其中,Candidatus_Competibacter在管网厌氧过程中产生并积累聚-β羟基-链烷酸酯(PHA),再以硝酸盐和亚硝酸盐作为电子受体在缺氧段还原PHA,随后在好氧条件下可以将聚羟基脂肪酸氧化成二氧化碳或转化成糖原[20];norank_c_Bacteroidetes_vadinHA17是一种厌氧杆菌,可分解蛋白胨或葡萄糖,产生乙酸、乳酸和丙酸等[21],与Candidatus_Accumulibacter类似,具有PHA与脂肪酸合成功能[22],是降解管网中有机碳的重要菌属.
2.2 不同水力水质工况对微生物组多样性的影响
2.2.1外源性碳
在外源性碳的影响下,通过门水平的相对丰度分析〔见图3(a)〕可知,A1_EU中仅有Proteobacteria、Bacteroidetes、Firmicutes,而A2_EU除这三类细菌门外,还发现相对丰度较低的Actinobacteria(放线菌门,0.38%)、Synergistetes(互养菌门,0.5%)和Spirochaetae(螺旋菌门,0.4%). 烘干底泥在没有外源性碳源和微生物补充的情况下,原底泥中vadinBC27_wastewater-sludge_group、norank_c__Bacteroidetes_vadinHA17等厌氧消化的菌属几乎消失. 而过膜后的污水虽滤去大多微生物,但仍留有大量溶解性有机物,为底泥补充了适量的碳源,因此A2_EU中厌氧发酵菌丰度得到提高,出现Synergistete、Spirochaetae等产甲烷阶段的新增菌群. 对A3_EU和A4_EU进行属水平的组间差异性分析〔见图3(b)〕,发现优势菌属在有外源性碳补充的底泥中相对丰度更高,其中厌氧杆菌norank_c__Bacteroidetes_vadinHA17差异性最显著(P≤0.001),在样本中相对丰度分别为7.6%和11.7%.
此外,径流雨水和生活污水中因所携带的有机物种类不同,使得微生物对其作用效率不同,所以不同的外源性碳对底泥中微生物组的多样性也有影响. 通过对B4_EU和B5_EU中微生物的门水平组间差异性分析〔见图3(c)〕,优势菌门均为Bacteroidetes、Chloroflexi、Firmicutes、Acinetobacter等有机物降解类相关菌门,但在污水组底泥中相对丰度更高.Bacteroidetes能分解底泥中蛋白胨或葡萄糖,产生乙酸、乳酸和丙酸等;Chloroflexi作为一种严格的厌氧微生物,能利用一系列的短链脂肪酸产生H2、CO2及乙酸,并且能与氢营养的产甲烷菌共生参与有机化合物的降解;Firmicutes可以水解蛋白、脂肪和碳水化合物等大分子物质,在厌氧发酵过程中对挥发酸的产生具有重要作用. 这些优势菌门可快速分解底泥中部分蛋白质及有机酸等简单小分子物质,完成自身的微生物呼吸及代谢过程[23],因此这些优势菌门在得到污水中大量有机物的补充后,相对丰度显著高于雨水组(0.01<P≤0.05). 同时通过EEM分析,反应后污水组底泥中类色氨酸荧光峰强度较反应前的增幅(142.7%)大于雨水组(72.6%)(见表3),可侧面证明污水组底泥中有机物降解类微生物相对丰度更高,微生物作用产物更多.
2.2.2剪切力
不同剪切力对底泥表层生物环境和微生物群落结构影响较大. 剪切力的增大有利于DOM在底泥中的渗透,促进底泥中微生物的生长和碳降解效率. 基于门水平下剪切力组底泥微生物的组间差异性〔见图4(a)〕,发现Proteobacteria和Chloroflexi在B5_EU中相对丰度分别为44.4%和8.9%,在B1_EU中相对丰度分别为46.5%和10.9%,呈显著性差异(P≤0.001),因此反应后较高剪切力组的底泥COD降幅(81.1%)大于对照组(74.0%)〔见图4(c)〕,且反应后类色氨酸荧光强度的增幅(294.2%)高于对照组(142.7%)(见表3).
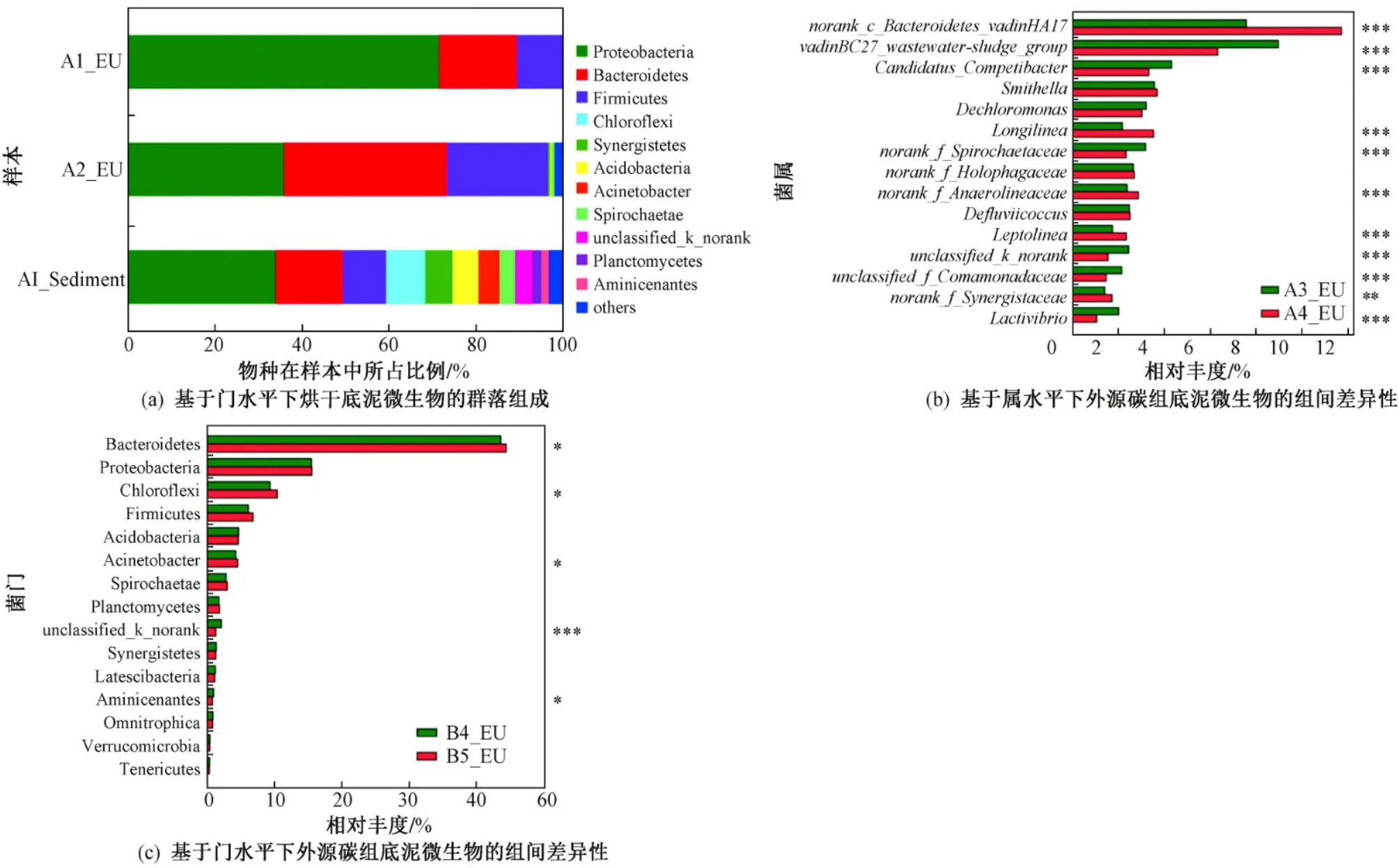
图 3 外源碳组底泥微生物的群落分析和组间差异性分析Fig.3 Analysis of sediment microbial community and inter-group difference in exogenous carbon group
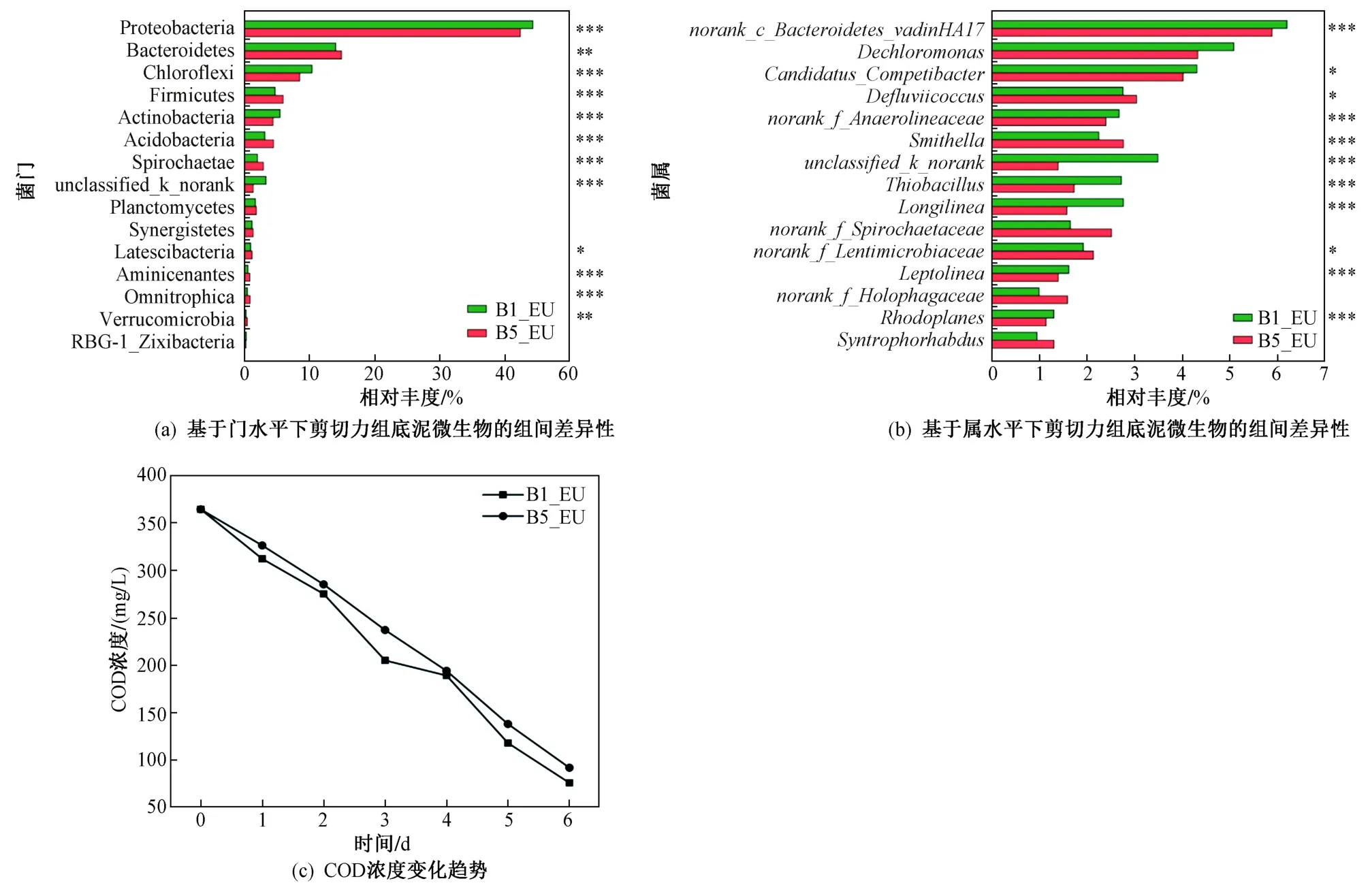
图 4 剪切力组底泥微生物的组间差异性分析和COD浓度变化趋势Fig.4 Analysis of the difference between microbial groups in the sediment of shear stress group and the change trend of COD concentration
剪切力一方面影响了上覆水中碳源向底泥的渗透,另一方面造成水流湍动加大溶解氧逸散. 基于属水平下剪切力组底泥微生物的组间差异性〔见图4(b)〕,发现优势菌属Dechloromona、norank_f_Anaerolineaceae(厌氧绳菌属)、Longilinea(长绳菌属)在B1_EU中相对丰度显著(P≤0.001)高于B5_EU中的相对丰度,其在B1_EU相对丰度分别为5.5%、2.3%和2.8%,而在B5_EU中的相对丰度分别为4.3%、2.3%和1.5%. 因此高剪切力为这些主要功能是分解蛋白、碳水化合物的底泥厌氧微生物提供了良好的厌氧环境,使厌氧类微生物的丰度增加. 此外,低剪切力下可富集更多微生物,形成紧密的活性高的生物膜[24],0.732 N/m2的剪切力可能影响了管网中泥水分层的界面,破坏了上层底泥的环境,因此使得微生物群落多样性降低.
2.2.3温度
在不同温度的影响下,底泥中主要优势菌门Proteobacteria、Bacteroidetes和Chloroflexi的相对丰度〔见图5(a)〕均呈现显著性差异(P≤0.001). 因温度会影响微生物蛋白质活性,同时较高温度会降低底泥中溶解氧浓度,所以在25 ℃环境下,B5_EU中Proteobacteria、Bacteroidetes等菌门相对丰度更高;而Chloroflexi(11.1%)可适应温度较广,可在41 ℃环境下的底泥中进行厌氧反应,所以在B2_EU中相对丰度更高. 结合EEM分析,B5_EU中类色氨酸荧光强度的增幅(142.7%)高于对照组(94.6%)(见表3),可侧面证明25 ℃环境中微生物组相对丰度更大,微生物作用产物更多.
从属水平〔见图5(b)〕分析,优势菌属Candidatus_Competibacter、Defluviicoccus等相对丰度较高且呈显著性差异(P≤0.001),且在B2_EU中相对丰度更高(分别为4.9%和3.8%).Defluviicoccus适宜温度较高,在厌氧阶段吸收并储存糖类有机物,为厌氧代谢提供能源[25];Candidatus_Competibacter的厌氧最适温度为35 ℃左右,合成PHA的速率随温度的升高而降低,而好氧温度最高不超过30 ℃,因此相比于25 ℃,41 ℃更有利于Candidatus_Competibacter生存.

图 5 温度组底泥微生物的组间差异性分析Fig.5 Analysis on the differences of the bottom mud microorganisms of the temperature group
2.2.4pH
微生物生长有最适的pH范围,不同的pH会改变营养物质的供给状态,影响菌体细胞膜的带电荷性质和稳定性,还会影响对物质的吸收能力,最终影响微生物群落和丰度.
通过门水平的组间差异分析〔见图6(a)〕可知,只有优势菌门Proteobacteria、Chloroflexi在B3_EU中的相对丰度分别为49.4%和10.1%,显著(P≤0.001)大于在B5_EU中的相对丰度(分别为44.4%和8.9%).在B3_EU的碱性环境中,这两个优势菌门均为杆状菌,没有过量的丝状菌,这与朱哲等[26]研究结果一致.而其余呈显著性差异的优势菌门(P≤0.001)在B5_EU中相对丰度更高,如Bacteroidetes、Firmicutes等. 这些细菌因胞外聚合物多带负电荷,在碱性环境下,胞外聚合物中酸性基团发生了裂解,使多糖和蛋白质流出[27],且优势种在有充足碳源的情况下产生并积累有机酸,使B3_EU的COD降幅(75.7%)低于B5_EU的COD降幅(54.6%)〔见图6(b)〕. 这与黄健等[28]研究在碱性环境下,大量细胞裂解和累积的有机酸,使得类色氨酸荧光强度的增幅(201.5%)高于中性环境下的(142.7%)(见表3)的结果一致,因此B3_EU中微生物的相对丰度较低,但微生物种类却略少于B5_EU中的微生物种类.

图 6 pH组底泥微生物的组间差异性分析和COD浓度的变化趋势Fig.6 Analysis of difference between microflora and change trend of COD concentration in sediment of pH group
2.2.5SO42-浓度
在不同SO42-条件下,C1_EU和C2_EU中微生物群落相似且相对丰度变化不明显,但上覆水中微生物组成和相对丰度变化明显,且属水平组间差异显著(见图7),优势种主要为Zavarzinia(扎瓦尔金氏菌属)、Methyloparacoccus和Kerstersia(克斯特菌属). C2_ES中Zavarzinia(25.9%)、Methyloparacoccus(30.5%)、Kerstersia(18.4%)相对丰度均大于C1_ES中的相对丰度(依次分别为12.6%、2.3%和7.5%). 同样作为上覆水优势种的Methylocystis(甲基孢囊菌属)也呈显著性差异(P≤0.001),但C1_ES的Methylocystis(10.7%)的相对丰度远大于C2_ES中的相对丰度(3.2%). 这是因为高SO42-浓度为嗜酸菌、酸杆菌、硫酸盐还原菌等菌属提供了良好的生存环境,对厌氧反应类的微生物有较大抑制性. 但改变SO42-浓度对底泥中微生物影响不大,这不仅是因为SO42-渗透有限,也是因为产硫过程只发生在底泥表面0~1 cm处[2]. 同时,Methylocystis和其他噬酸甲烷氧化菌一样,无法在有机酸或糖中生长[29],能够利用甲烷和甲醇,又能够利用一些含C-C键的多碳有机物作为其生长底物[30].
上覆水SO42-浓度对上覆水中微生物产生了较大的影响,尤其高浓度的SO42-会对厌氧微生物产生强烈的抑制作用,且SO42-浓度越大,厌氧发酵气体产排量越低,这与Jeong等[31]研究甲烷菌在含SO42-污泥中受抑制的结果一致. 上覆水中优势菌Zavarzinia,对酸性条件有较高的耐受能力,可在pH小于5的酸性环境中生长. 新鲜的径流雨水含大量的溶解氧,且SO42-浓度为72 mg/L,这为严格好氧的优势种Zavarzinia提供了良好的生存环境. 大量Zavarzinia将乙醇氧化成醋酸,减少了碳的转化. 同样是优势种且适宜生存在酸性和有溶解氧环境中的Methyloparacoccus,可利用CH4或甲醇这类C1化合物作为其生长底物[32],直接或间接地减少CH4的产生.
3 结论
a) 市政重力流排水管网底泥中优势菌门Bacteroidetes、Chloroflexi、Firmicutes、Acinetobacter等均为有机物降解类细菌. 当混接的污染源越多,类色氨酸类有机物就越多,细菌群落多样性就越高;当 外 源 性 碳 浓 度 越 高,Bacteroidetes、Chloroflexi、Firmicutes、Acinetobacter等菌门丰度就越高. 因此整治管网混接,实行分流制排水系统,有利于控制底泥微生物的多样性,减少碳的转化.
b) 在一定范围内,剪切力越高,底泥中Dechloromona、norank_f_Anaerolineaceae、Longilinea等厌氧微生物(其主要功能是分解蛋白、碳水化合物)的丰度就越高. 而过高的剪切力,可能会破坏泥水分界面,减少生物膜的形成,降低微生物群落的多样性.
c) 在一定范围内,温度越高,底泥微生物组丰度就越高. 在41 ℃环境下,适应温度较广的优势菌门Chloroflexi和优势菌属Defluviicoccus、Candidatus_Competibacter丰度最高,其合成大量有机物,存在CH4排放的潜势;而Proteobacteria、Bacteroidetes等菌门因微生物蛋白质活性受温度影响,微生物组丰度降低.
d) 在碱性环境中,微生物胞外聚合物中酸性基团发生了裂解,只有Proteobacteria、Chloroflexi等杆状菌丰度较高,没有过量的丝状菌,且可能因累积的大量有机酸,从而产生了大量类色氨酸. 而pH为中性的环境中,Bacteroidetes、Firmicutes等菌门丰度更高.
e) SO42-浓度对底泥微生物影响较小,但较高SO42-浓度提高了上覆水中Methylocystis、Zavarzinia等微生物丰度,抑制了Methylocystis等厌氧微生物的生长,有利于抑制COD的降解,但可能会造成H2S浓度的提高,这个问题还需进一步研究.

