16q缺失调节miR-3145-5p/CYP2E1表达对肝癌细胞增殖、迁移和凋亡及患者预后的影响*
邱龙凤,卢玉飞,吴圣明,木和·穆罕默德,胡启平,3△
(1.广西医科大学基础医学院细胞生物学与遗传学教研室,南宁 530021;2.广西医科大学附属肿瘤医院影像诊断中心,南宁 530021;3.广西医科大学长寿与老年相关疾病教育部重点实验室,南宁 530021)
肝细胞癌(hepatocellular carcinoma,HCC)是一种起源于肝细胞、最常见的肝脏恶性肿瘤,但其发病机制尚不清楚[1]。染色体片段缺失是人类实体癌的共同特征,其缺失通常代表了驻留在缺失区域内的特定肿瘤抑制基因失活[2]。已有研究表明,癌症患者的染色体缺失与患者的不良结局之间存在密切的联系[3]。其中染色体16q 片段不同程度的缺失在多种癌症中均有发现,但其具体影响机制尚不明确。本课题组前期研究发现,75 例广西HCC 患者中有约50%的患者癌组织中存在16q 缺失,但未对16q 缺失影响HCC 发生发展的机制作进一步的分析[4]。miRNA 是一种非编码小RNA,参与细胞增殖、新陈代谢、分化和凋亡等关键生物学过程的调节[5],在HCC 诊断、预后和治疗等方面发挥的作用已被证明。然而,16q 缺失及其差异表达基因(differentially expressed genes,DEGs)在HCC 中的研究尚未深入。本研究旨在探索HCC 中16q 缺失对患者预后的影响及其相关的miRNAs和关键DEGs,为临床HCC的治疗和预后提供参考依据。
1 材料与方法
1.1 TCGA数据收集 从TCGA数据库中获取TCGA-LIHC 数据集,包含全转录组数据(372 个HCC样本和50 个非肿瘤样本)和16q CNV 数据(缺失片段筛选阈值为Mean_Log_Ratio≤-0.25)[6-7]。
1.2 miRNAs 及关键靶基因的筛选 基于TCGALIHC 全转录组数据,使用DECenter 筛选出与HCC 16q 缺失相关的miRNAs 和DEGs。通过miRWalk(http://miRwalk.umm.uni-heidelberg.de/)预测miRNAs 与关键DEGs 的表达调节关系。在TCGA-LIHC 数据库和Kaplan-Meier Plotter 数据库中获取关键DEGs 在HCC 中的表达图谱以及对患者生存影响图谱。
1.3 免疫组织化学染色法检测关键蛋白表达水平
根据HPA 数据库获取HCC 患者癌组织及其癌旁组织关键蛋白(CYP2E1)的免疫组织化学染色图,按照组织化学评分法(H-score)进行评分,Hscore=∑pi(i+1),其中pi 为阳性细胞数占切片中所有细胞数量的百分数,i代表着色强度。
1.4 细胞培养和转染 人肝癌细胞株Huh7(中国科学院典型培养物保藏委员会细胞库)用含10%胎牛血清(FBS)的DMEM培养基,置于37 ℃、5%CO2培养箱中培养。将miRNA 过表达(mimic)慢病毒载体LV-hsa-miR-3145-5p、对照慢病毒载体con294(上海吉凯基因科技有限公司)分别转染HCC 细胞株,即miR-3145-5p mimic组、NC-con294组。
1.5 实时荧光定量PCR(RT-qPCR) 提取细胞总RNA,miRNA 采用加尾法进行逆转录,mRNA 逆转录采用PrimeScriptTMRT Reagent Kit with gDNA Eraser(TaKaRa)试剂盒。定量试剂均采用TB Green® Premix Ex TaqTMⅡ(TaKaRa)试 剂 盒。GAPDH用作待测基因的内参,U6用作miRNA的内参。采用2-ΔΔCt法计算miRNA/mRNA 相对表达量。引物序列如下:miR-3145-5p上游:5’-CGCGAACTCCAAACACTCAAAACTCA-3’;U6 上游:5’-TAGCAGCACGTAAATATTGGCG-3’;所有通用下游引物均由TaKaRa公司提供。
1.6 Western blotting法检测CYP2E1蛋白表达
细胞贴壁长满后,使用RIPA Lysis Buffer 裂解细胞,冰上裂解30 min 后,12 000 r/min 离心5 min,收集上清;采用BCA 法测定蛋白浓度,煮沸变性,SDS-PAGE电泳分离蛋白,将蛋白转移至PVDF膜;5%脱脂牛奶封闭1 h,加入一抗CYP2E1(1∶1 000,Abcam)、β-actin(1∶1 000,Absin)4 ℃孵育过夜;TBST洗膜3次,二抗(1∶5 000,Absin)室温孵育1 h,TBST 洗膜3 次,ECL 显色、曝光,蛋白凝胶成像仪(SGC2020126,ChampChemi 610 Plus)进行显影,保存图像后,用Image J软件进行定量分析。
1.7 CCK-8法检测细胞增殖 细胞计数后,将转染后的Huh7细胞株(3×103个/孔)接种于96孔板,按照CCK-8试剂盒说明书操作,用酶标仪检测450 nm波长处各孔的吸光度值。
1.8 细胞克隆形成实验 将稳定转染的Huh7细胞株接种于6孔板中(1×103个/孔),置于37 ℃、5%CO2培养箱中培养,培养皿中出现肉眼可见的克隆团时终止培养。使用4%组织细胞固定液和结晶紫溶液,按照试剂说明书对细胞克隆团进行染色,晾干后进行计数并分析。
1.9 细胞侵袭实验 向Transwell小室中加入200 μL用新鲜无血清培养基稀释的Huh7 细胞(3×104个/孔),下室中加入600 μL含10%FBS完全培养基,并置于37 ℃、5%CO2培养箱中培养24 h。使用4%组织细胞固定液和结晶紫溶液,按照试剂说明书对小室进行染色。计算侵袭细胞数。
1.10 细胞划痕实验 取对数生长期细胞并计数,将转染后的Huh7细胞株(1.5×106个/孔)接种于6孔板,置于37 ℃、5%CO2培养箱中培养,待细胞平铺长满后进行划痕,并于同一位置不同时间段(0 h 和24 h)进行拍照,计算划痕愈合率,划痕愈合率=(0 h划痕面积-24 h划痕面积)/0 h划痕面积×100%。
1.11 细胞周期和细胞凋亡检测 取对数生长期、生长状态良好的细胞,分别按照细胞周期检测试剂盒(上海翊圣生物科技有限公司)和细胞凋亡检测试剂盒(MULTI SCIENCES)说明书步骤,采用流式细胞仪进行检测和分析。
1.12 统计学方法 采用SPSS 20.0 统计软件对数据进行处理,正态分布的资料组间比较采用t检验,偏态分布的资料采用秩和检验;以P<0.05 为差异具有统计学意义。
2 结果
2.1 320 个DEGs 与16q 缺失和肿瘤发生、发展相关 根据TCGA-LIHC数据集中16q CNV数据和全转录组数据,筛选出320个与16q缺失和肿瘤发生、发展相关(相对于癌旁组织,在癌组织中上调或下调的基因)的DEGs(其中169 个上调、151 个下调),其中19个DEGs位于16q上,且均为下调DEGs(表1)。通过DAVID 对DEGs 进行KEGG 通路富集分析,综合考虑P值和富集倍数,发现其主要富集于“细胞色素氧化酶P450代谢有害异物”、“化学致癌”和“药物代谢—细胞色素氧化酶P450”通路(图1A),相关DEGs 包 括UGT2B10、GSTM1、UGT1A1、ADH1C、ADH1B、UGT2B15、UGT2B17、CYP3A4、HSD11B1、ADH4、AKR7A3、GSTA2、CYP1A2、CYP1A1、UGT1A4、UGT1A3、CYP2E1、UGT2B7、UGT2B10、NAT2和AOX1;然而,16q 上所有DEGs 并不在上述通路中。进一步分析DEGs中细胞色素氧化酶P450表达发现,当16q 缺失时13 种CYP 中有9 种表达下调(CYP11A1、CYP2A6、CYP 17A1、CYP2E1、CYP1A1、CYP8B1、CYP3A4、CYP1A2和CYP39A1),即16q缺失可能通过减弱有害异物的代谢使细胞表型更加恶化。
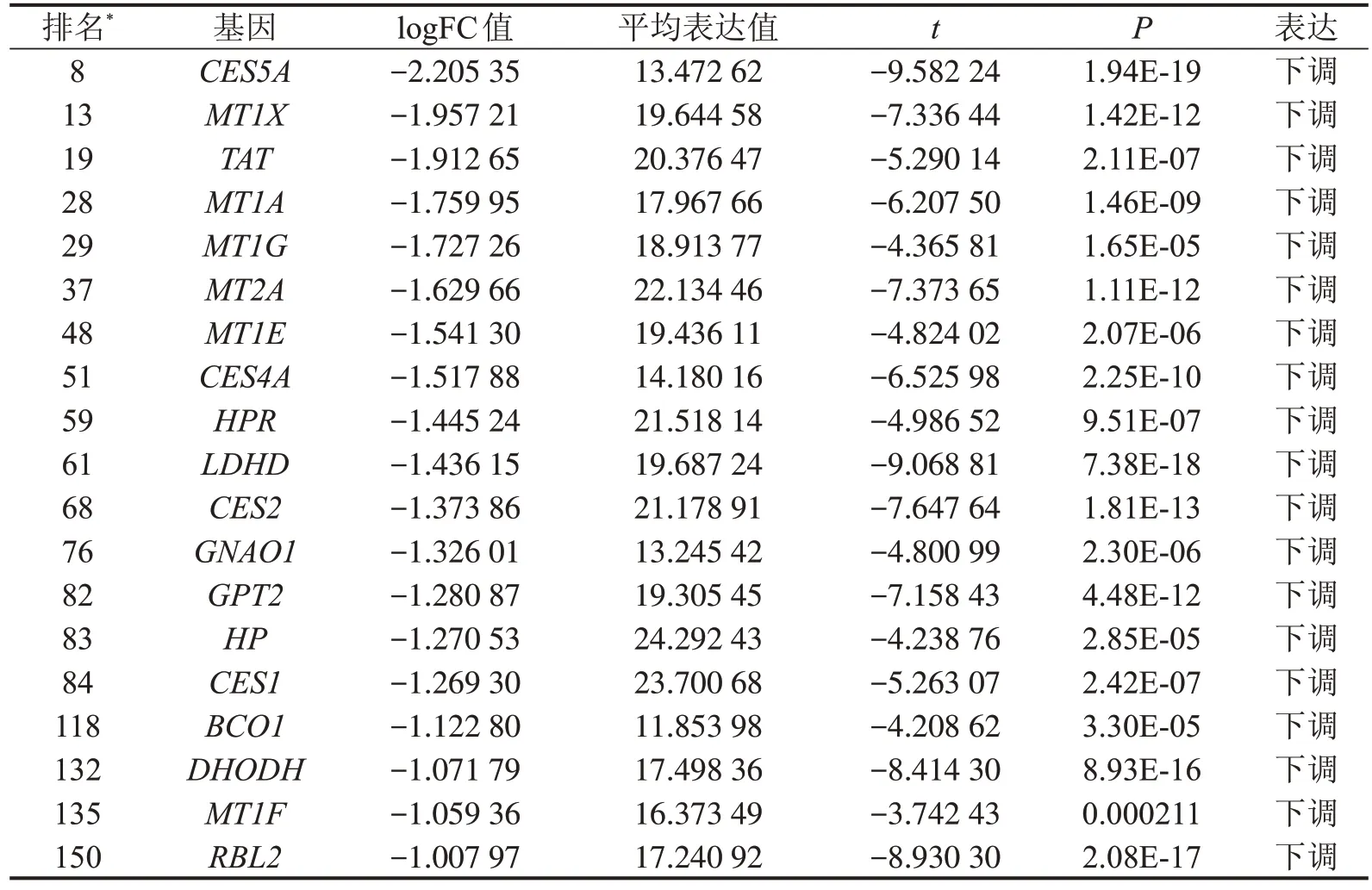
表1 16q上与16q缺失相关基因的差异表达
利 用Cytoscape、MCODE 和cytoHubba 分 析DEGs 之间相互作用关系发现12 个关键基因(图1B)存在较强的相互作用关系,其中下调关键DEGs(CYP3A4、UGT1A1、CYP2E1、AOX1和CYP1A1)中有3 个是CYP(表2)。随后,根据TCGA-LIHC 与Kaplan-Meier Plotter 数据库,将CYP2E1 在HCC 患者癌组织和正常(癌旁)组织中相对表达水平以及对患者的生存影响进行了分析,与癌旁组织比较,HCC 癌组织CYP2E1 mRNA 相对表达量降低(图1C);HPA数据库免疫组织化学结果显示,与癌旁组织比较,CYP2E1 蛋白表达在HCC 组织中下调(图1D)。生存分析显示,在HCC患者中,CYP2E1低表达组患者生存率低于CYP2E1高表达组(图1E)。
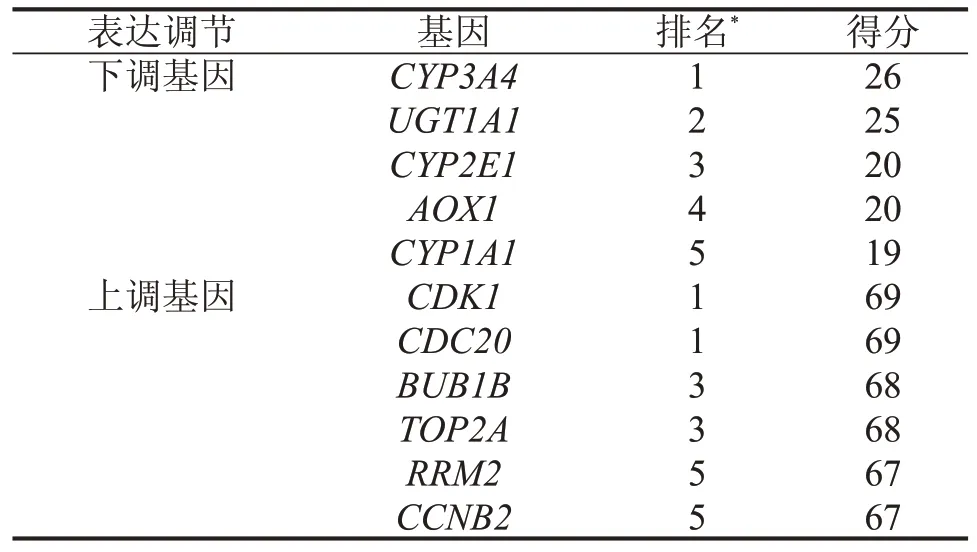
表2 Cytoscape、MCODE 和CytoHubba 分析16q 缺失相关DEGs的关键基因

图1 16q缺失相关DEGs通路分析和DEG(CYP2E1)表达及其对患者预后的影响
2.2 miR-1226-3p、miR-3145-5p可能调控CYP3A4、CYP2E1表达根据TCGA-LIHC 中miRNA 和CNV 数据,筛选出8 个16q 缺失相关的差异表达miRNAs(miR-483-5p、miR-483-3p、miR-3145-5p、miR-1226-3p、miR-378d、miR-4788、miR-204-3p 和miR-204-5p),其中miR-483-5p、miR-483-3p、miR-3145-5p 和miR-1226-3p 表达上调、miR-378d、miR-4788、miR-204-3p 和miR-204-5p 表达下调;进一步用miRWalk 筛选上述miRNAs 的靶基因,预测结果发现16q 缺失后CYP3A4 和CYP2E1 等2 个关键DEGs可能与miR-1226-3p 和miR-3145-5p 等2 个DEmiRs存在表达调节关系。
根据CYP的平均表达值(AveExpr)、DEmiRs筛选时的效应量(effect size)、P值和靶基因的预测关系,本选择miR-3145-5p和CYP2E1的表达调控关系及其对HCC 细胞行为的影响来验证16q 缺失对HCC预后的影响。
2.3 miR-3145-5p mimic 对miR-3145-5p 基因和CYP2E1 蛋白表达的影响与NC-con294 组比较,miR-3145-5p mimic 组miR-3145-5p 表达 上调,CYP2E1 的蛋白表达水平下调(P<0.01),见图2。

图2 miR-3145-5p mimic对miR-3145-5p基因和CYP2E1蛋白表达的影响
2.4 miR-3145-5p mimic 对Huh7 细胞增殖和细胞周期的影响 在miR-3145-5p mimic转染Huh7细胞后,与NC-con294 组比较,miR-3145-5p mimic 组细胞增殖和侵袭能力增强,细胞凋亡率升高(均P<0.01),没有发现明显的细胞周期阻滞现象,两组细胞迁移能力比较亦无明显差异(P>0.05),见图3、图4。

图3 miR-3145-5p mimic对Huh7细胞增殖和细胞周期的影响

图4 miR-3145-5p mimic对Huh7细胞侵袭、迁移和凋亡的影响
3 讨论
HCC 是全球癌症死亡的常见原因,其基因组、表观遗传和转录改变对HCC的发生发展、转移和预后发挥着关键作用[8-9]。另外,16q 片段不同程度的缺失已在KBG综合征[10]、乳腺癌[11]、前列腺癌[12]等多种癌症中出现,并且在癌症的发生发展和预后中发挥了一定作用,然而目前尚未在分子水平上对16q缺失与HCC的发生发展关系进行探讨。
有496个基因定位于16q 上,但在16q缺失的患者癌组织中,只有其中19 个基因发生了差异表达(均为下调表达)。本研究筛选出320个与16q缺失相关的DEGs,这些DEGs 主要富集于“细胞色素氧化酶P450代谢有害异物”、“化学致癌”和“药物代谢—细胞色素氧化酶P450”通路,但16q 上的19 个DEGs 均未在上述通路中,可见16q 缺失影响HCC细胞的表型可能是通过影响16q以外基因(如CYP)表达来实现的。与16q缺失相关的13种CYP中有9种表达下调,并且其中3 种(CYP3A4、CYP2E1和CYP1A1)下调CYPs 是蛋白-蛋白相互作用较强的hub基因。
CYP2E1 是一种Ⅰ相毒物代谢酶,参与药物代谢以及大脑生物活性过程,具有解毒作用,与多种疾病和病理生理状况有关[13],其中,较高的CYP2E1活性与二乙基亚硝胺诱导的HCC发生相关,而抑制CYP2E1 活性可降低DEN 对肝细胞的增殖、肝损伤和HCC 的发生[14]。本研究根据TCGA-LIHC、HPA和Kaplan-Meier Plotter 等数据库分析发现,相对于正常组织,HCC 癌组织中CYP2E1在mRNA 和蛋白水平表达都是下调的,且CYP2E1低表达对患者的生存是不利。CYP3A4 是CYP3A 亚家族中研究最多的异构体,负责CYP3A 亚家族的大部分代谢活动,免疫反应性强,分布范围广,是当前HCC治疗的预后标志[15-16]。因此,16q 缺失可能通过下调CYP2E1和CYP3A4表达来减弱有害异物的代谢使细胞表型更加恶化。
随后筛选出8 个16q 缺失相关的DEmiRs,并预测其中miR-3145-5p 与CYP2E1、miR-1226-3p 与CYP3A4和CYP2E1存在表达调节关系。已有研究表明,miR-1226-3p 通过下调DUSP4 表达促进HCC索拉非尼敏感性[17],还可调节ITGB1进而促进HCC细胞增殖和侵袭[18]。而miR-3145-5p在HCC中的作用及机制目前尚无研究报道。经本研究推测,16q缺失可能通过miR-3145-5p、miR-1226-3p 下调CYP2E1和CYP3A4表达使细胞表型更加恶化,进而使HCC患者预后不良。
根据CYP的表达值和DEmiRs筛选时的效应量P值等因素,本研究选择miR-3145-5p和CYP2E1的表达调控关系及其对HCC 细胞行为的影响来验证16q 缺失对HCC 预后和生存的影响。实验结果表明,HCC 细胞中miR-3145-5p 可在mRNA 和蛋白水平下调CYP2E1的表达,并促进HCC 细胞的增殖和侵袭;在对细胞凋亡的影响方面,miR-3145-5p mimic 可使细胞凋亡增加,但可能细胞增殖速度相较于细胞凋亡的速率快,故细胞总体呈增殖状态,此效应对HCC 细胞的恶性表型的影响有待进一步研究。结合CYP2E1的功能及其表达对患者生存的影响以及miR-3145-5p和CYP2E1的表达调节关系,本组推测在16q 缺失的HCC 患者中,上调的miR-3145-5p 和miR-1226-3p 等miRNAs 可能靶向下调CYP2E1和CYP3A4的表达,尤其是miR-3145-5p 通过下调CYP2E1表达来促进HCC 细胞的增殖和侵袭而进一步增加细胞的恶性表型,促进HCC 发展,降低患者预后。
为了更进一步了解16q 缺失与HCC 发生发展的相关机制,还应进一步在荧光素酶实验、更多HCC 细胞系(株)和在动物水平上分析miR-1226-3p、miR-4788 和miR-378d 等miRNAs 与CYP2E1和CYP3A4的表达调节关系及其对HCC恶性生物学行为的影响,为HCC 的诊断、治疗提供更加有效的依据。
总之,本研究通过综合生物信息学分析对16q缺失相关的差异表达miRNAs及差异表达基因进行筛选,并通过基因、蛋白水平以及细胞水平对其进行验证,发现16q 缺失可能增强HCC 相关miRNAs(miR-1226-3p、miR-3145-5p)及其靶基因(CYP3A4和CYP2E1)的表达调控,进而影响HCC细胞的恶性生物学行为,导致HCC 患者的不良预后。综上所述,DEGs(CYP2E1和CYP3A4)和DEmiRs(miR-1226-3p 和miR-3145-5p),尤其是miR-3145-5p 和CYP2E1,可能是预测HCC 患者16q 缺失预后的生物分子标志物,可作为16q缺失HCC患者潜在的治疗靶点。

