肢体动静脉畸形介入治疗效果初探
李 臻, 余 鹏, 詹鹏超, 叶书文, 谢炳灿, 张玉元, 李 鑫, 吴 刚, 周朋利,韩新巍
动静脉畸形(arteriovenous malformation,AVM)是一种少见的先天性血管发育异常疾病,最终可能导致周围正常组织低血流灌注,引发相关临床症状。外科治疗存在完全切除病灶困难、失血量大等不足,术后1年复发率约40%[1]。介入治疗具有微创、精准、可重复等特点,已成为AVM重要治疗方法[2]。本文回顾性分析单中心收治的11例肢体AVM患者临床资料,探讨介入治疗的可行性和安全性。现将结果报道如下。
1 材料与方法
1.1 一般资料
收集2015年1月至2020年10月郑州大学第一附属医院收治的11例肢体AVM患者临床资料。其中男5例,女6例,年龄11~63(36.3±19.2)岁;2例分别为外科术后18、22个月AVM复发。所有患者均有典型临床表现,如异常血管搏动、杂音等;8例自诉疼痛,5例伴有局限性肿胀,4例出现皮肤红斑,4例浅表静脉曲张,2例伴有皮肤溃疡、感染,1例病灶广泛,动静脉分流明显,出现肌间血肿、心力衰竭及肢体功能障碍等症状。
所有患者术前均完善CTA或MR动态增强扫描,诊断明确。根据患者临床症状,参考Schobinger标准对AVM进行分期[3];根据影像学表现,参考Cho等[4]提出的标准对AVM进行分型。患者基线资料见表1。
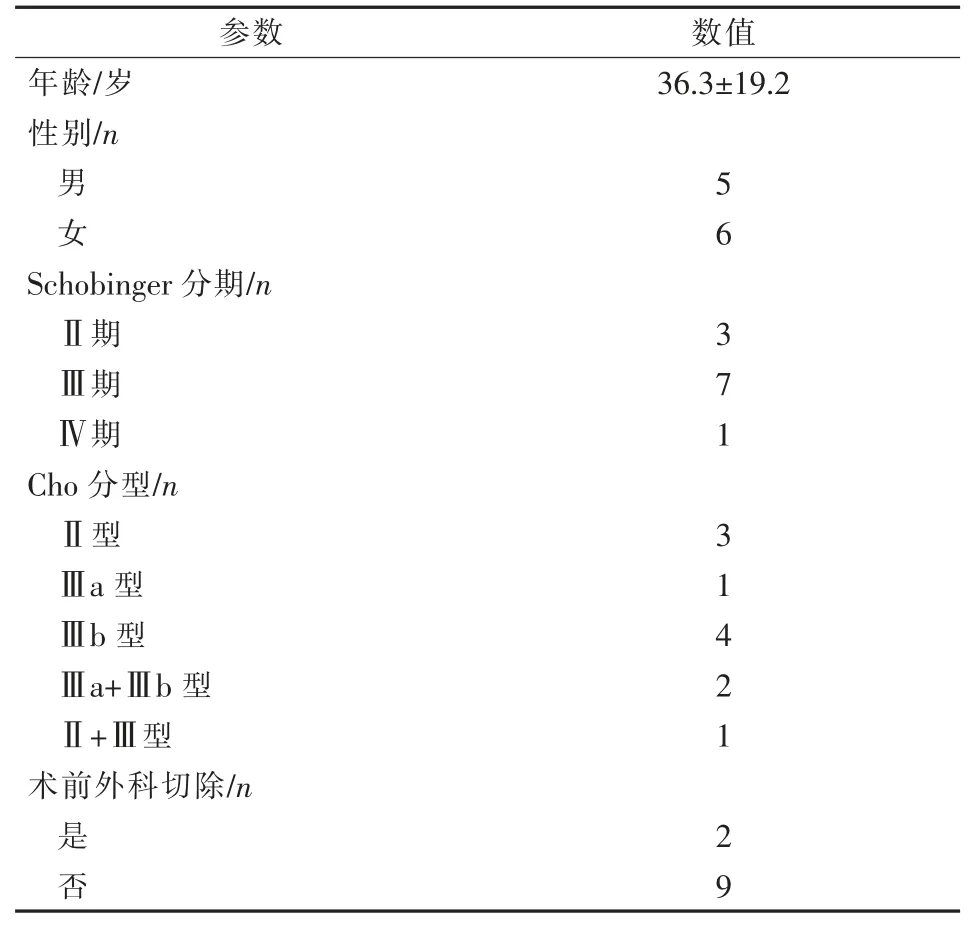
表1 患者基线资料 n=11
1.2 介入设备及器材
Artis Zeego DSA机[德国Siemens公司,高压造影参数:高压注射器注射压力为300 psi(1 psi=6.895 kPa),上肢动脉流率4~5 mL/s、12~15 mL/次,下肢动脉流率7~8 mL/s、15~20 mL/次,延迟注射],栓塞材料[聚乙烯醇(PVA)颗粒(美国Cook公司,粒径350~560μm、560~710μm)、多规格可控弹簧圈、无水乙醇、康派特医用胶(α-氰基丙烯酸正丁酯)],介入手术器械[5 F单弯导管、5 F Cobra管、SP微导管和微导丝、0.035英寸亲水膜导丝、18 G或21 G千叶针、头皮针等]。
1.3 介入治疗方法
术前立即静脉推注地塞米松(0.1 mL/㎏),连接心电监护,鼻导管吸氧。常规右腹股沟区消毒铺巾,Seldinger改良法穿刺股动脉,置入5 F血管鞘,以同轴导管技术超选至供血动脉主干高压造影,明确病灶区域血流动力学改变;动脉栓塞:SP微导管和微导丝配合逐一超选至畸形血管团近端供血动脉分支,选择合适的PVA颗粒或弹簧圈栓塞供血动脉,待血流速度明显减慢,缓慢注入无水乙醇(单次注入量不超过0.1 mL/㎏,总量不超过0.8 mL/㎏),观察5~10 min,期间严密观察患者生命体征,然后手推造影评估栓塞效果,若效果欠佳则重复上述操作,直至畸形血管团完全或大部分消失;直接穿刺栓塞:放大透视图像后动脉造影显示畸形血管团,定位穿刺靶点,局部浅表浸润麻醉,穿刺成功后以止血带束缚于畸形血管团近端肢体,缓慢注入无水乙醇,无水乙醇注入量、观察内容、栓塞终点同动脉栓塞,如此逐一完成各靶点栓塞;医用胶动脉栓塞:注入速率维持在0.1~0.2 mL/min,若胶液开始向引流静脉弥散或供血动脉反流即停止注射,观察数分钟,缓慢手推造影评估栓塞效果,效果欠佳则反复注射,直至栓塞程度满意。术后局部加压包扎,连续3 d静脉滴注甲泼尼龙(40 mg/d)。Ⅱ型AVM以直接穿刺或经静脉栓塞为主,Ⅲa型宜采用经动脉栓塞,Ⅲb型可采用经动脉、经静脉或直接穿刺栓塞,混合型和Ⅲa型无论采用何种方法,治疗效果均欠佳。根据血管造影结果,灵活采用不同栓塞方法[5]。
1.4 疗效评估
治愈:末次复查血管造影AVM消失,临床症状消失至少1年;明显缓解:>90%AVM消失,临床症状消失;缓解:50%~89%AVM消失,临床症状改善,且不影响日常生活;无变化:<50%AVM消失,有持续的临床症状;失败:临床症状加重或栓塞失败[4]。临床治疗成功:治愈和明显缓解。
2 结果
本组11例患者中治愈4例,临床治疗成功8例。9例患者出现轻微并发症,如一过性疼痛、肿胀、皮肤色泽改变或浅表破溃,予对症处理后消失,无严重并发症发生。1例患者经历4次介入手术、外科局部清创术,肌间血肿治愈,心力衰竭缓解[美国纽约心脏病协会(NYHA)分级由Ⅳ级下调至Ⅱ级,射血分数由40%升至53%,N末端脑钠肽前体(NT-proBNP)由1 599 ng/mL降至531 ng/mL,双下肢水肿等临床症状明显缓解],生活质量明显提高。治疗方案见表2,患者介入治疗前后影像见图1。
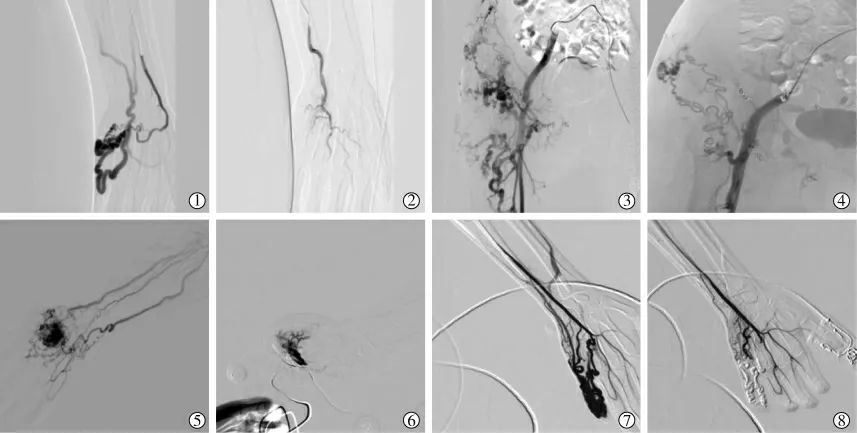
图1 肢体AVM患者介入治疗前后影像
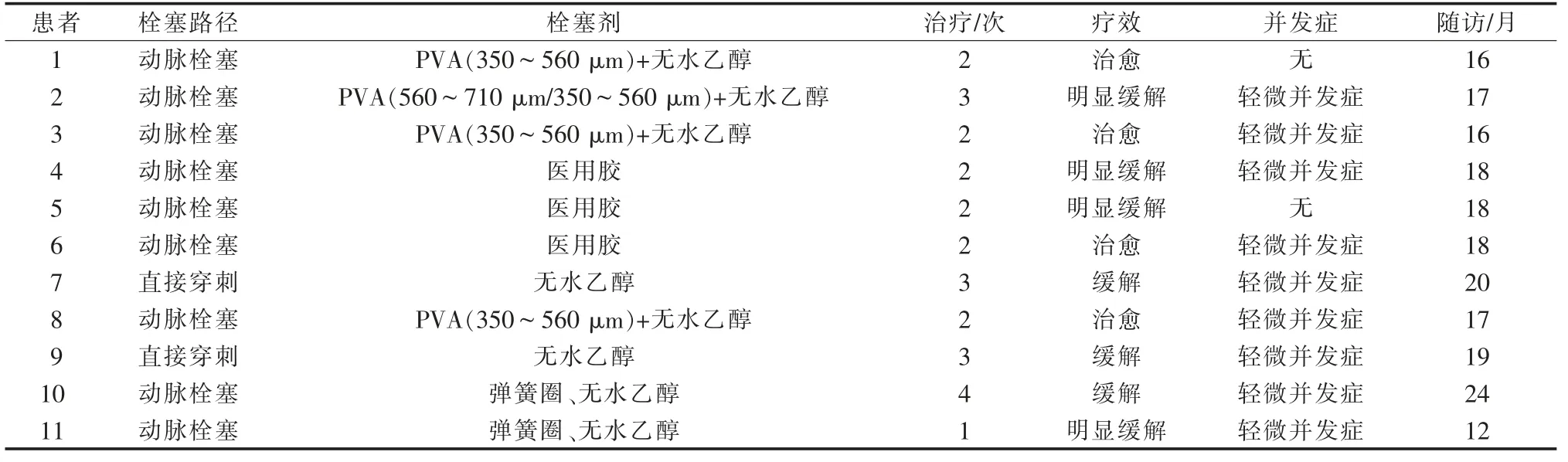
表2 介入治疗方案及预后
3 讨论
AVM是一种少见的复合性高流量血管畸形,占先天性血管畸形5%~10%。40%~60%患者出生时即存在AVM,因缺乏早期临床表现及特异性,未能得到有效诊治。Guillet等[6]研究报道远端肢体AVM确诊的平均延误时间达10年。AVM发生发展是一复杂的动态过程,临床症状与病灶范围、解剖和血流动力学息息相关。四肢尤其是远端肢体AVM由于靠近体表,血管异常搏动、杂音及局部外形改变等症状相对突出。目前常见检查方法有超声成像、CTA、增强MRI或MRA。MR具有高软组织分辨率、能区分高流量和低流量血管畸形等特点,为首先非侵入性检查方法[7]。DSA有极其重要的诊断价值,能准确反映病灶形态、范围及血流动力学状态等,也是介入治疗的主要步骤之一[8]。
随着影像技术的发展和临床对AVM血流动力学认识加深,介入治疗已成为AVM主要治疗方法[9]。经导管动脉栓塞术是常见介入治疗方法,但有栓塞不完全、术后血管再通等缺陷;栓塞术后缺氧缺血环境也会刺激血管内皮细胞生长因子(VEGF)高表达,促进新生血管形成;四肢尤其是远端肢体AVM呈复杂的高流速血流动力状态,即使多次栓塞仍难以完全消灭畸形血管团[10-11]。目前临床共识认为,畸形血管团去内皮化是介入治疗的核心,栓塞材料优选末梢性栓塞剂[5]。常用栓塞剂包括机械性栓塞剂(PVA颗粒、弹簧圈、医用胶等)、化学硬化栓塞剂(无水乙醇、聚桂醇等)。PVA颗粒为常用末梢性栓塞剂,相对有效,术后反应轻,但粒径大小的科学合理选择是治疗关键,否则可能发生异位栓塞风险,部分存在血管再通现象。有研究推荐以供血动脉注入对比剂至引流静脉显影时间为主要参考指标,而非畸形血管直径[9]。弹簧圈栓塞供血动脉仅适用于挽救性AVM急诊止血或限流。李臻等[2]报道以弹簧圈配合PVA颗粒栓塞下颌骨AVM急性大出血,取得确切疗效,但单独以弹簧圈栓塞尚不能破坏畸形血管床,术后易形成侧支循环导致复发。近年来,Onyx等医用胶逐步在临床得到广泛应用[12-13],具有可控性好、不易粘管等特点,适用浓度由微导管尖端相对病变的位置与AVM血流量确定,对施术者操作水平要求较高,操作不甚易引起肺栓塞。有研究报道Onyx栓塞术后畸形血管团出现内皮细胞再生、血管再通现象,复发率约32%[14]。因此,以畸形血管团去内皮化为核心的栓塞技术是介入治疗AVM的关键所在。
无水乙醇因具有较强的血管内皮损伤、血清蛋白变性和快速血栓形成的断流作用,成为治疗AVM的主要栓塞剂,完全康复率为40%~50%[5,15]。同时,无水乙醇引发的异位栓塞、皮肤和神经损伤等并发症也高达10%~48%[5]。研究表明,影响无水乙醇栓塞AVM相关并发症的风险因素为通路技术、浓度,而直接穿刺、适当稀释能降低皮肤并发症发生[5,11]。无水乙醇和稀释乙醇混合应用可有效降低皮肤坏死等并发症,50%乙醇可用于YakesⅣ型和ChoⅢa型AVM栓塞治疗[5,16]。乙醇对Ⅰ、Ⅱ、Ⅲb型AVM治疗效果较好,对Ⅲa型AVM效果欠佳,当存在组织浸润和弥漫性微动静脉分流时难有确切疗效[5,17]。
如何安全、有效地应用液体栓塞剂是介入医师面临的挑战。临床上常先采用弹簧圈栓塞、局部外压等辅助手段减缓血流速度,然后注射液体栓塞剂,以提高其安全性和有效性。直接穿刺、经静脉弹簧圈栓塞及多种通路技术联合应用,目前越来越受到重视,与经动脉栓塞相比更为直接、安全、有效。许多研究认为联合多种通路技术,可有效增加消除畸形血管的面积,从而降低治疗次数、提高治愈率[5,15-18]。
本组11例肢体AVM患者通过个体化介入治疗,症状得到明显改善,生活质量得到提高;随访期间无严重并发症发生。尤其是对AVM伴急性出血、高排量心力衰竭等严重并发症患者,介入治疗更有立竿见影的效果。本组患者治愈率相对较低,以单纯Ⅱ、Ⅲb型病变为主,这与文献报道基本一致。究其原因,与肢体AVM高流速血流动力学及复杂的疾病特点有关。
本研究局限性在于样本量有限,仍需进一步研究。

