急性前循环串联闭塞血管开通治疗临床研究
李水仙, 陈星宇, 阳清伟, 庄晓荣, 王显锏, 葛 华, 林晓芳, 林 威,彭忠伟, 朱仁敬, 翁磊华, 金首跃, 赖天宝
急性前循环串联闭塞指颈内动脉(ICA)闭塞伴发同侧脑动脉闭塞,后者多为大脑中动脉(MCA)闭塞。常引起严重缺血性脑卒中,静脉溶栓效果差,若不及时有效再通,严重致残率或致死率高[1-2]。ICA闭塞主要由大动脉粥样硬化(1arge-artery atherosclerosis,LAA)斑块破裂继发原位血栓形成、心源性脑栓塞(cardiogenic cerebral embolism,CE)及动脉夹层(arterial dissection,AD)引 起[2-3],MCA闭 塞 常 由ICA血栓脱落栓塞所致。研究证实,血管内治疗对急性颅内外大血管闭塞再通的效果确切[4],开通方法包括支架取栓、抽吸取栓、球囊扩张、支架植入等。不同病因所致急性前循环串联闭塞的病理机制不同,对不同开通方法的反应可能存在差异。本研究采用血管内介入治疗44例不同病因所致急性ICA颈段伴同侧MCA串联闭塞患者,分析治疗效果及安全性。
1 材料与方法
1.1 研究对象
选择2017年2月至2020年10月在厦门大学附属中山医院接受血管内介入治疗的44例急性ICA颈段伴同侧MCA串联闭塞性脑梗死住院患者,根据中国缺血性卒中亚分类(Chinese ischemic stroke subclassification,CISS)病因分型分为LAA组(18例)、CE组(15例)、AD组(11例)。所有患者中男31例,女13例;年龄为(62.6±12.5)岁。介入治疗前美国国立卫生研究院卒中量表(NIHSS)评分为(19.6±5.2)分(11~38分)。
入选标准:①全脑血管造影和术中微管造影证实急性ICA颈段伴同侧MCA串联闭塞,闭塞段ICA与MCA间血管腔正常,大脑前动脉或/和大脑后动脉通过脑膜支代偿供血;②发病至股动脉穿刺时间<16 h,其中6~16 h患者接受CT或MR灌注成像评估(核心缺血区<70 mL、低灌注区与坏死区体积比值>1.8且不匹配区域>15 mL)。排除标准:①既往严重残疾;②CT或MRI示颅内出血或大面积脑梗死。
1.2 血管内介入治疗
对于发病时间<4.5 h患者,介入治疗前予重组组织型纤溶酶原激活剂(rt-PA)0.9 mg/kg静脉溶栓治疗。介入治疗分为顺行性(先处理ICA病变、后处理MCA病变)与逆行性(先处理MCA病变,后处理ICA病变)治疗。
LAA组患者接受逆行治疗:造影确定ICA颈段粥样硬化斑块继发原位血栓闭塞、同侧MCA闭塞;8 F导引导管置入颈总动脉末端,微导丝导引下将球囊导管送至ICA闭塞段适度扩张;球囊导管支撑下导引导管通过狭窄至其远心端,微导丝导引下先后将6 F Navien中间导管沿导引导管送至ICA海绵窦段、Rebar-27微导管沿中间导管送至MCA闭塞远端,释放Solitaire FR支架,支架锚定下中间导管上行至MCA闭塞近心端,5 min后负压维持下中间导管抽吸,同时回撤Rebar-27微导管及支架行颅内支撑导管辅助Solitaire FR支架取栓(SWIM)+抽吸术(中间导管上行不能,仅支架取栓;同一部位支架取栓可重复2次,中间可微导管推注替罗非班;出现M3段栓塞,则微导丝机械碎栓并经微导管推入替罗非班);复查造影,若ICA颈段仍重度狭窄,导管推注替罗非班,仍不能维持前向血流,保护伞沿微导丝置于颈内动脉狭窄远端,再次球囊扩张狭窄病变,仍不能维持前向血流,则植入支架。
CE组患者接受顺行治疗:造影确定ICA颈段血栓栓塞、同侧MCA闭塞;8 F导引导管置入ICA颈段接近闭塞,负压维持下抽吸血栓至再通(若远段ICA仍有闭塞,由近及远继续抽吸,导引导管上行困难,则微导丝导引下6 F Navien中间导管上行抽吸);微导丝导引下先后将6 F Navien中间导管送至ICA海绵窦段、Rebar-27微导管送至MCA闭塞远端,释放支架行SWIM取栓或仅支架取栓(同LAA组),若ICA末端闭塞、再通困难,经中间导管推注替罗非班,MCA段闭塞开通前先行ICA末端SWIM取栓。
AD组患者接受逆行治疗:造影确定ICA颈段夹层病变、同侧MCA闭塞;8 F导引导管置入夹层近心端,同轴技术将微导丝、Rebar-27微导管、6 F Navien中间导管通过夹层(中间导管通过夹层困难时保留微导丝撤出微导管,微导丝引导球囊导管上行至夹层段,两标准大气压预扩张球囊);微导丝导引下将中间导管送至ICA海绵窦段、Rebar-27微导管越过MCA闭塞处,跟进中间导管至MCA闭塞近端,释放支架,行SWIM取栓或仅支架取栓(同LAA组);回撤微导丝、微导管至ICA末端,回撤中间导管至ICA起始段,再次造影评估夹层血流和形态,夹层开通不予植入支架,夹层仍闭塞或残留重度狭窄则植入支架。
介入治疗后即刻行脑DynaCT扫描,若无出血或对比剂明显外渗,持续予替罗非班静脉泵注,24 h复查CT排除出血和大面积脑梗死,予双联抗血小板治疗,重叠4 h后停用替罗非班。常规予阿托伐他汀(40 mg/d)稳定斑块,根据脑梗死情况予脱水,必要时去骨瓣减压。
1.3 观察指标
①血管再通:手术结束时评估改良溶栓治疗脑梗死(mTICI)血流分级为≥2b级;②手术操作相关指标:发病至股动脉穿刺时间、替罗非班应用、穿刺至血管再通时间、血栓逃逸、支架植入;③神经功能判定:术前、术后1周NIHSS评分;④预后评定:术后90 d改良Rankin量表(mRS)评分≤2为预后良好;⑤不良事件:术后1周内颅内出血转化、90 d内死亡。
1.4 统计学分析
采用SPSS 24.0软件进行统计学分析。正态分布的计量资料以±s表示,3组样本均数两两比较先用Levene方差齐性检验,方差齐性再用q检验;计数资料以频数、构成比表示,先用Fisher确切概率法检验3组数据间有无差异,存在差异再用Bonferroni法行3组数据两两间比较。P<0.05表示差异有统计学意义。
2 结果
2.1 临床基线资料比较
3组患者年龄相比,AD组明显低于LAA组、CE组(均P<0.05);既往史,LAA组患者伴高血压病、伴高脂血症比例明显高于CE组、AD组;伴心房颤动、伴心瓣膜病比例,CE组明显高于LAA组、AD组;3组患者性别、伴糖尿病、伴冠心病、静脉溶栓、MCA-M1段与M2段闭塞等差异无统计学意义(均P>0.05),见表1。
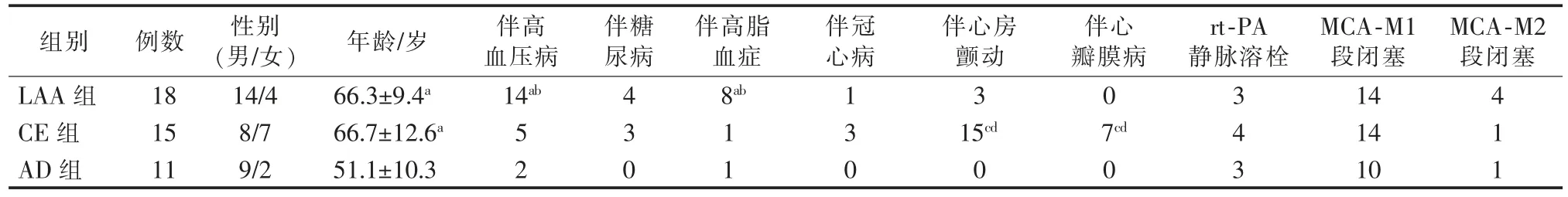
表1 3组患者基线资料比较
2.2 治疗结果及不良事件
3组患者均成功完成穿刺、置管及取栓(图1)。发病至股动脉穿刺时间,LAA组明显长于CE组(P<0.05);支架植入率,LAA组、AD组明显高于CE组(均P<0.05);mTICI血流分级≥2b比率,CE组明显低于LAA组、AD组(均P<0.05);术后症状性脑出血发生率,CE组明显高于LAA组、AD组(均P<0.05);3组术中替罗非班应用率、穿刺至血管再通时间、远端血栓逃逸率相比,差异无统计学意义(均P>0.05),见表2。术前、术后NIHSS评分,术后90 d病死率,CE组明显高于相同时点LAA组、AD组(均P<0.05);3组患者术后NIHSS评分较术前明显降低(均P<0.05),预后良好率差异无统计学意义(均P>0.05),见表3。

表2 3组患者术中资料及术后脑出血情况比较

表3 3组患者术前、术后NIHSS评分和mRS评分比较

图1 急性前循环串联闭塞患者血管内介入开通手术过程影像
3 讨论
急性前循环串联闭塞患者ICA、MCA血流同时受阻断,以致MCA供血区更不易得到侧支循环代偿,灌注差、病情重、自然病死率高。静脉溶栓对这类大动脉闭塞开通的可能性小,应尽快行血管内介入治疗[1-2]。目前国内外对串联闭塞的研究多集中在动脉粥样硬化所致ICA闭塞[2,5],串联闭塞处理是先处理颅内(逆行治疗)还是颅外(顺行治疗)及选用何种介入方法开通闭塞血管,尚无定论[6]。本研究结果提示,应根据串联病变不同病因,采用相宜开通顺序和介入方法。
本研究中对LAA组患者采用逆行治疗,先球囊扩张ICA起始部打开通路,再支架取栓再通MCA、最后再次球囊扩张ICA起始部,18例患者中16例达到再通,9例患者未植入支架也取得良好再通率,较高于Sallustio等[1]报道近端支架植入的串联病变成功再灌注率(64%);其中3例患者在ICA起始部球囊预扩张后,远心端MCA闭塞自发再通。本研究认为采用上述方法开通LAA类串联闭塞血管,是一种可选择的较好方法。这类患者ICA颈段急性闭塞是粥样硬化斑块基础上继发原位血栓形成,血栓负荷一般不重,球囊预扩张常能开出满意的颅内血管进入路径,之后行MCA取栓能在最短时间改善缺血区灌注,最后再次球囊扩张ICA起始部,必要时再行支架植入。入组患者术中未出现继发血栓形成、栓子脱落与再发栓塞,可能与应用替罗非班、术中介入导管对管壁斑块挤压、应用保护伞良性相关。
对CE组患者采用顺行治疗,用8 F导引导管抽吸完全开通ICA起始部,再支架取栓开通MCA闭塞,15例患者中9例达到再通。其中6例患者ICA起始部抽吸出大量暗红色血栓,如果不采用大直径导管抽吸取栓,可能很难将其完全再通并易导致血栓逃逸、延长再通时间。这类患者ICA急性闭塞由心源性栓子栓塞引起,血栓负荷重、易碎裂、与管壁黏附力不强,且此处动脉管径粗,采用大直径导管抽吸取栓,可能是血管再通最完全、开通时间最短、费用最低的不二选择[7]。
对AD组患者采用逆行治疗,MCA取栓再通后再处理ICA夹层,其中2例患者夹层自发好转而未行支架植入。AD所致真腔闭塞,多为血管内膜下血肿形成并在内膜与中膜间扩张、内膜移位引起,内膜撕裂、壁内血肿进入管腔时可致远端栓塞,形成串联闭塞[8]。介入导管常可顺利通过真腔到达远端正常血管。ICA夹层多为长节段管腔闭塞,病变通常延伸至颅底,重建夹层往往需要植入多枚支架,难度大、耗时长[9]。因此,本研究先行远端MCA再通,以通过Willis环尽早开通其供血区血供,最后再处理近端夹层,可能是取得较好疗效的主要原因。
目前对MCA急性闭塞开通常采用支架取栓,再通率为62.7%~83.2%[10]。本研究采用中间导管负压维持下支架取栓,再通情况好于大部分研究报道。这可能与本研究中该处闭塞大多是栓塞、应用中间导管负压抽吸有关。有研究报道,中间导管负压维持辅助支架取栓可提高血栓吸取成功率,减少血栓逃逸和远端栓塞,尤其适用于栓塞性闭塞;对支架无法捕获的局部血栓抽吸,可进一步提高取栓效率[11-12]。
本研究在支架取栓时发现,CE组患者远端闭塞血栓负荷重,闭塞原因可为LAA。如2例患者伴发ICA末端闭塞,其中1例微导管不能通过闭塞,1例替罗非班推注后SWIM取栓3次仍闭塞并因持续低血压、心率波动大等终止手术;3例患者M1段分叉处T型血栓,其中2例再通失败;3例患者MCA闭塞为动脉粥样硬化性,其中2例介入开通失败。这可能是该组患者ICA起始部完全开通后均未出现MCA闭塞自发再通及血管再通率明显低于LAA、AD组的原因,以后可尝试应用更大管径抽吸导管,以提高血管再通率。LAA组患者MCA闭塞处血栓负荷较CE组小,7例为M1段分叉前闭塞,6例为M1段分叉后单干栓塞,4例为M2段栓塞,另1例存在M1下干起始处重度狭窄。这提示串联病变也可在ICA颈段栓塞、颅内段动脉粥样硬化狭窄基础上,再发栓塞或原位血栓形成。
尽快开通颅内闭塞动脉、恢复其供血区有效灌注是介入治疗的核心。本研究分析3组患者手术持续时间,发现AD组明显长于LAA组、CE组,CE组明显短于LAA组、AD组;股动脉穿刺至MCA闭塞再通时间,CE组明显长于LAA组、AD组,可能与CE组闭塞血管血栓负荷重、需多次抽吸与取栓有关,并可能是症状性脑出血发生率较高、预后较差、死亡率较高的主要原因。
本研究为单中心回顾性研究,样本量还不够大,不可避免地存在偏倚,有待扩大范围及样本量进行前瞻性研究。
——以渤海A 油藏为例

