美沙拉秦干预下IBD小鼠结肠组织的转录组分析
王怡如周唯蒋笑影潘一滨许言午曹永清*
(1.上海中医药大学附属龙华医院肛肠科,上海 200032;2.上海中医药大学基础医学院生物化学教研室,上海 201203)
炎症性肠病(inflammatory bowel disease,IBD)是一组慢性、复发性的消化道炎症性疾病,包括克罗恩病(Crohn’s disease,CD)和溃疡性结肠炎(ulcerative colitis,UC)。UC临床表现常见腹痛、腹泻、粘液血便等。近年来,IBD已从传统的西方常见病逐渐发展为一种全球性疾病,世界胃肠病学组织(World Gastroenterology Organization,WGO)2015年发布的指南报道欧洲与北美UC最高患病率分别为505/10万、249/10万[1]。据预测,由于人口基数庞大,我国IBD总病例数或将在2025年达到150万[2],据粗略估算,当前我国UC的患病率为11.6/10万,已居亚洲之首[3-4]。IBD反复发作,迁延难愈,患者多为20~40岁的青壮年,患病不但极大影响患者生存质量,还带来沉重的经济负担,对IBD的防治和机制研究艰巨而迫切。
IBD的发病机制通常认为与环境、感染、免疫、遗传等因素有关,免疫因素被认为是诱发IBD的关键因素[5]。IBD继发于肠道黏膜免疫系统的异常应答可能引起持续的慢性炎症,免疫细胞激活后及其分泌的炎性细胞因子,在IBD的发生发展过程中发挥着重要的调控作用[6-7]。
IBD的治疗药物包括氨基水杨酸制剂[8]、糖皮质激素[9]、抗生素、免疫抑制剂及生物制剂等[10]。其中,美沙拉秦(5-aminosalicylic acid,5-ASA)是5-氨基水杨酸的新型衍生药物,在肠道内通过接触肠粘膜直接作用于黏膜及黏膜下组织,发挥抗炎作用,临床上对于轻、中度UC的疗效较好,而副作用较柳氮磺吡啶小[11-12],但该药物的体内药理机制尚不明确,以往相关研究大多集中于蛋白水平,而在IBD这类复杂疾病的病理过程中,病变组织经治疗好转后,其基因表达可能发生显著变化,故基因水平的药理机制急需进一步探索。
前期以 “IBD”、 “UC” 和 “5-ASA”、“mesalazine”、“RNA-seq”为关键词在中英文数据库中进行检索,未查询到应用转录组测序技术探索美沙拉秦治疗IBD小鼠结肠组织中基因表达情况的研究。故课题组以葡聚糖硫酸钠(dextran sulfate sodium,DSS)诱导建立IBD结肠炎小鼠,并以美沙拉秦进行干预,经测量小鼠体重、粪便性转、DAI评分、结肠组织炎症程度及血清IL-6和TNF-α水平,提示成功建立了IBD小鼠肠炎模型,证实美沙拉秦有效减轻了小鼠结肠炎症,在IBD小鼠肠炎发展过程中发挥了治疗作用[13],现将通过对结肠组织进行转录组测序,从分子层面探索美沙拉秦治疗IBD的作用机制,试图增进对这一过程的深入理解,为其临床应用提供更多的理论依据。
1 材料与方法
1.1 材料
1.1.1 实验动物
15只10周龄SPF级C57BL/6雌性小鼠,体重20~23 g,购于上海西普尔必凯实验动物有限公司【SCXK(沪)2018-0006】,饲于上海中医药大学实验动物中心【SYXK(沪)2020-0009】,予灭菌饲料、蒸馏水自由食饮,房间每12 h光照/黑暗循环,温度22~25℃,湿度50%~70%。本研究经过上海中医药大学附属龙华医院伦理审查批准【审批号:2018LCSY452】,实验动物按照3R原则给予人道关怀。
1.1.2 主要试剂与仪器
美沙拉秦缓释颗粒剂(艾迪莎,批号:15237,上海爱的发制药有限公司)研磨成粉后用灭菌蒸馏水配制成25 mg/mL的混悬液。DSS(分子量36 000~50 000,CAS#9011-18-1 M.W.)(MP Biomedicals公司,美国),用灭菌蒸馏水配制成2.5%(质量体积比)的溶液。超纯水机(Millipore,型号:Millipore,德国),4℃冰箱(中科美菱公司,型号:YC-260L,中国),超低温冰箱(SANYO,型号:MDF-U 32V,日本),包埋机(Thermo,型号:HistoStar,美国),切片机(Leica,型号:RM2235,德国),组织脱水机(Leica,型号:TP1020,德国),涡旋振荡器(其林贝尔仪器制造有限公司,型号:D1008E,中国),掌上离心机(其林贝尔仪器制造有限公司,型号:D1008E,中国),低温离心机(Eppendorf,型号:5810R,德国),电子天平(光学仪器厂,型号:FA1604,中国)。
1.2 方法
1.2.1 动物造模
适应性饲养1周后,将15只小鼠完全随机分为3组,每组5只,分别为对照组(Control组)、模型组(DSS组)和美沙拉秦组(DSS+5-ASA组)。参考Chassaing等[14]造模方法,给予DSS组和DSS+5-ASA组小鼠2.5%DSS(每组300 mL,每2 d一换)自由饮用7 d,第8天起给予灭菌蒸馏水继续自由饮用7 d;对照组小鼠自由饮用等量的灭菌蒸馏水。第8天开始,DSS+5-ASA组小鼠给予美沙拉秦(0.5 g/(kg·d))灌胃7 d,每天2次,每次0.2 mL,对照组和DSS组小鼠灌胃等量的灭菌蒸馏水。
1.2.2 模型评估指标
记录各组小鼠体重变化、粪便性状、血便、疾病活动指数[15](disease activity index,DAI)、结肠组织炎症程度指标评估造模效果。使用ELISA试剂盒(pg/mL,Abcam,美国)检测美沙拉秦用药后各组小鼠血清中IL-6与TNF-α的表达水平,评估美沙拉秦治疗作用。
1.2.3 转录组测序
每组随机选取3只小鼠的结肠组织作为样本,送至上海云序生物科技有限公司进行高通量转录组测序。
(1)总RNA提取与质控:使用TRIzol(TaKaRa,日本)从小鼠结肠组织中提取总RNA,分别通过NanoDrop®ND-1000分光光度仪(Thermo Fisher Scientific,美国)和变性琼脂糖凝胶电泳测定RNA浓度、纯度和完整性。
(2)文库制备与测序:使用rRNA去除试剂盒移除总RNA中的rRNAs后,通过总RNA文库制备试剂盒预处理RNA。将10 pM文库变性为单链DNA分子,在Illumina flowcell上捕获后原位扩增为簇(cluster),通过BioAnalyzer 2100生物分析仪(Agilent,美国)进行文库质控和定量后,在Illumina HiSeqTM4000(Illumina,美国)测序仪上采用双端模式(PE mode)进行150 cycle测序。
(3)测序分析:经过图像和碱基识别后,从Illumina HiSeq测序仪上收获原始序列(reads);经cutadapt软件(v1.9.3)修剪,删除低质量reads,获得高质量reads用于分析。使用hisat2软件(v2.1),将高质量reads比对到小鼠参考基因组(UCSC MM10)上,根据ensembl gtf基因注释文件中已注释的mRNA,通过cuffdiff软件(cufflinks的一部分)获得FPKM(fragments per kilobase of transcript per million mapped fragments),作为mRNA的表达谱。使用R的heatmap2函数,以FPKM值进行差异表达mRNA聚类分析。基于倍数变化(fold change)≥2.0,即log(FC)≥1.0,P-value≤0.05及FPKM值至少在一个样品中≥0.1作为差异筛选阈值,并在此基础上进行基因本体论(gene ontology,GO)和京都基因与基因组百科全书(Kyoto encyclopedia of genes and genomes,KEGG)富集分析。GO分析包括生物过程(biological process,BP)、细胞成分(cellular component,CC)和分子功能(molecular function,MF),GO分析注释并推测这些差异表达mRNA的功能;KEGG通路分析则是推断它们可能参与的生物学信号通路,以P≤0.05作为显著富集的阈值。应用TargetScan和miRanda软件预测关键环状RNA(circular RNA,circRNA)、微小RNA(microRNA,miRNA)和差异mRNA之间的相互作用,用Cytoscape软件构建circRNA-miRNA-mRNA关系网络。
1.2.4 UC患者结肠组织活检数据
以“IBD”、“UC”、“CD”和“5-ASA”、“mesalazine”为关键词在GEO数据库中进行搜索,仅得到了一个与人类UC相关的公共数据集(GSE46451)。该数据集通过微阵列(Microarray)技术检测了3组(无炎症无用药组、有炎症无用药组和有炎症美沙拉秦治疗组,n=3)UC患者结肠组织的基因表达谱,以探究美沙拉秦对UC患者的治疗效果与副作用[16]。具体操作为:将活检组织切片置于24孔培养板的一个孔中,内有300μL无血清HL-1培养基,依次加入100 U/mL青霉素钠、100 mg/mL硫酸链霉素、50μg/mL庆大霉素,分别加入和不加5-ASA(50 mmol)后在37°C、5%CO2条件下培养6 h。FC>2和P<0.05定义为基因差异表达。更多细节见MacFie等[16]的原始论文。
1.3 统计学分析
使用GraphPad Prism 7.0软件(GraphPad Software公司,美国)进行数据统计与分析。计量资料均采用平均值±标准差(±s)表示。正态分布的计量资料组间比较采用t检验(student’sttest)或单因素方差(One-way ANOVA)分析,偏态分布的计量资料组间比较采用秩和检验(Kruskal-Wallis test)。转录组测序基因表达差异分析采用Quasi-likelihood(QL)F检验。P<0.05为差异具有统计学意义。
2 结果
2.1 mRNA表达谱
转录组测序在3组小鼠结肠组织中共检测到22 585个mRNA,其中有2983个差异表达。当DSS组与对照组比较时,分别有820个上调和806个下调的mRNA;DSS+5-ASA组与DSS组之间分别有604个上调和753个下调的mRNA。表1列举了DSS+5-ASA组与DSS组比较中上调和下调的前10个差异表达基因(differentially expressed genes,DEGs)及其基因描述。散点图描述了差异表达mRNA的分布(图1A),热图展示了对这些差异表达mRNA使用分层聚类分析的结果(图1B),每一列代表一个样品的表达模式,高和低表达水平分别由红线和绿线指示。编码-非编码基因共表达网络(coding and non-coding coexpression,CNC)分析确定了一个由72个mRNA、39个miRNA和9个circRNA组成的circRNA-miRNAmRNA网络(图2)。

图1 应用转录组测序分析美沙拉秦治疗DSS诱导的IBD的基因表达谱Figure 1 Bioinformatics analysis of gene expression profiling during mesalazine treatment of DSS-induced IBD by RNA-seq

图2 编码-非编码基因共表达网络Figure 2 Coding-noncoding co-expression(CNC)network analysis

表1 DSS+5-ASA组与DSS组比较中差异表达前10位的mRNATable 1 Top 10 DEGs in DSS+5-ASA vs.DSS
2.2 GO和KEGG分析
差异表达mRNA的GO分析结果显示,在生物学过程(BP)方面,DSS组与对照组相比,最丰富BP的条目是免疫系统过程(上调)和单生物体过程(下调,图3A)。同时,DSS组与DSS+5-ASA组相比,最重要BP的条目分别是单生物体运输(上调)和对其他生物的防御反应(下调,图3B)。在细胞成分(CC)方面,DSS组与对照组相比较时,最富集的CC条目集中于细胞外区域(上调)和细胞器(下调,图3C);DSS组与DSS+5-ASA组比较时,最富集的CC条目是囊泡(上调)和细胞外区域(下调,图3D)。
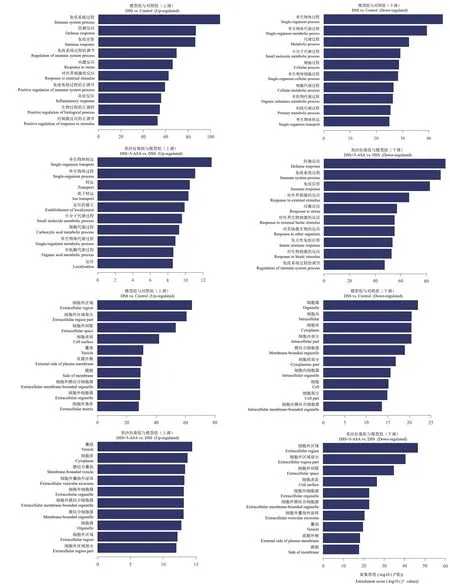
图3 差异表达基因的GO(BP和CC)分析Figure 3 GO(BP and CC)analysis of DEGs
在分子功能(MF)域中,DSS组与control组比较,最丰富的MF条目为蛋白质结合(上调)和催化活性(下调,图4A);而当DSS组与DSS+5-ASA组相比时,结果显示催化活性(上调)和转运活性最为重要(下调,图4B)。

图4 差异表达基因的MF分析Figure 4 MF analysis of DEGs
对差异表达mRNA进行KEGG分析,共鉴定出285条通路。根据P值和富集分数,分别列出了DSS组与对照组比较、DSS+5-ASA组与DSS组比较时上调和下调的前10个通路(图5A和5B)。比较结果中的相同通路包括粘蛋白O-聚糖生物合成、胰腺分泌物、丙酸代谢、外源性物质通过细胞色素P450的代谢、近端小管碳酸氢盐回收(DSS+5-ASA组与DSS组相比表达上调,DSS组与对照组相比下调)和金黄色葡萄球菌感染、细胞因子-细胞因子受体相互作用、TNF信号通路、肺结核、利什曼病和弓形虫病(DSS+5-ASA组与DSS组相比表达下调,DSS组与对照组相比较时上调)。

图5 差异表达基因的KEGG分析Figure 5 KEGG analysis of DEGs
2.3 部分差异表达mRNA的验证
为进一步验证上述结果,在DSS+5-ASA组和DSS组比较中,选择了差异表达最显著的10个上调和下调的DEGs(表2),在GEO数据库(GSE46451)中将这些DEGs与UC患者结肠组织样本中的表达水平进行对照。如表2所示,与无炎症无用药组和有炎症美沙拉秦治疗组相比,有炎症无用药组中的角蛋白6B(Keratin 6B,KRT6B)和γ干扰素诱导蛋白-10(interferon-γinducible protein-10,CXCL10)表达升高,核糖核酸酶1(ribonuclease 1,RNASE1)和胰羧肽酶B1(carboxypeptidase B1,CPB1)表达下调。微阵列结果与我们的转录组测序结果部分一致。

表2 UC患者结肠活检组织验证差异表达基因Table 2 Validation of selected DEGs from colonic biopsies of UCpatients
3 讨论
转录组测序技术可在单核苷酸水平高效全面的获得组织器官在特定状态下的整体转录过程,mRNA作为DNA与功能蛋白之间的生物信息桥梁,测定肠粘膜组织在不同生理、病理状态下的转录活动有助于对基因表达模式及表达水平进行量化,为疾病研究提供重要策略。5-ASA是临床治疗IBD肠道炎症的常用药物,其药理作用可能与花生四烯酸代谢、抑制反应性氧自由基生成、逆转丁酸代谢障碍、抑制免疫细胞活性及细胞因子表达有关[17],研究报道,5-ASA能下调肠道黏膜IL-6与TNF-α等与IBD密切相关的炎性细胞因子水平,经5-ASA治疗后的炎性结肠组织中NF-κB原位激活被强烈抑制,提示其可能通过干扰促炎性NF-κB信号传导,抑制AMPK活性从而减轻了大鼠的结肠炎症[18-19],但以上美沙拉秦的药理机制是否为5-ASA的特异性作用尚存在争议。尽管RNA-seq技术已发展成熟,以DSS诱导的经典IBD小鼠模型及以5-ASA作为阳性对照药物的研究也在IBD领域广泛应用,但目前仍缺乏应用RNA-seq技术在基因水平研究5-ASA治疗IBD作用机制的报道。本研究建立了DSS诱导的IBD小鼠模型,其肠炎表现与人类UC相似[20],经5-ASA灌胃治疗7 d后,小鼠实验性肠炎得到减轻[16],通过RNA-seq检测各组肠粘膜组织mRNA的表达谱,将两组间的显著差异基因与GEO数据库中UC患者活检样本的基因表达进行对比,部分DEGs(如Krt6b、Cxcl10、Rnase1和Cpb1)得到了验证,一方面说明了测序结果的准确性,另一方面提示经美沙拉秦治疗后的IBD小鼠模型与UC患者的基因表达变化具有相似性,这些表达趋势相同的基因可能揭示了部分药理机制的一致性,也可能是治疗IBD的潜在靶点。Krt6b属于角蛋白基因家族,组织受损时,促炎信号能够调节Krt6b的表达。Klinghammer等[21]发现,TNF-α对角质形成细胞具有强烈的刺激作用,可诱导Krt6b的表达,尽管尚未见文献报道Krt6b与IBD之间的关系,基于上述理论和研究结果,推测TNF-α可能上调了DSS诱导的IBD小鼠结肠黏膜中Krt6b的表达,从而导致肠上皮屏障的破坏。Cxcl10是一种炎症趋化因子,在IFNγ诱导的单核细胞促进促炎细胞因子的释放方面起着重要的作用,在IBD患者的体内CXCL10表达水平显著上升[22]。Hyun等[23]认为,阻断Cxcl10能够缓解C57BL/6小鼠结肠炎症状,减轻肠道炎症。测序结果示,DSS组小鼠结肠组织中的Krt6b和Cxcl10的表达水平显著高于DSS+5-ASA组和对照组,与前人研究具有一致性。Rnase1是一种对血管和组织起保护作用的细胞外循环内切酶。它可以被促炎细胞因子调节,从而影响炎症过程中的内皮细胞功能[24]。Bedenbender等[25]发现,TNF-α或IL-1β诱导的炎症内皮细胞中Rnase1的表达显著降低。测序结果发现,与其他两组相比,DSS诱导的小鼠炎性结肠组织中Rnase1的表达明显下降,与前人研究趋势相符。
同时,基于这些差异表达mRNA的GO(BP)分析结果显示,其功能条目与免疫系统过程、代谢过程(包括免疫反应和炎性反应)和防御反应等相关,表明黏膜免疫,尤其是T细胞反应可能在结肠炎性损伤及5-ASA的治疗过程中起到了重要作用。Holleran等[26]指出先天性和适应性免疫途径的功能障碍导致了IBD中异常的肠道炎症反应,测序结果为这一观点增加了证据支持。最后,基于差异表达mRNA的KEGG分析,提示5-ASA治疗肠炎的体内过程不仅与细胞因子-细胞因子受体相互作用、TNF信号途径、感染等炎症和免疫过程有关,还涉及胰腺分泌、黏蛋白型O-聚糖型生物合成、细胞色素P450(cytochrome P450,CYP450)、丙酸代谢等多种机制,具有广谱治疗作用[17],证明了以往药理研究中的部分机制。其中,外分泌型胰腺功能不全(exocrine pancreatic insufficiency,EPI)是由于原发性胰腺疾病或继发性外分泌型胰腺功能受损导致的消化不良和吸收不良的重要原因。EPI在IBD患者中发病率较高,国外研究统计,在38%的CD患者和53%的UC患者中,胰腺病变没有胰腺炎的先兆。大约三分之一的CD患者具有针对胰腺成分的自身抗体,这提示EPI可能是由免疫诱导的途径削弱了外分泌的功能引起的,且这些抗体似乎对CD具有特异性[27]。黏蛋白型O-聚糖是黏蛋白的主要成分,它们分布在人体的各种黏膜部位,特别是在携带细菌的肠黏膜中表达。黏蛋白是黏液的主要成分,由杯状细胞分泌,并在常驻菌群和结肠中潜在的免疫细胞之间形成保护性的稳态屏障[28]。Xuan等[29]发现大肠癌细胞中的Core 3黏蛋白型O-聚糖修复可以促进MUC1/p53/mir-200c依赖的上皮功能。细胞色素在人类的许多组织中表达,尤其是在肝脏和肠道组织中。细胞色素P450是一种可自身氧化的单氧酶,能够代谢多种异源物质。感染和炎症过程与细胞色素的代谢密切相关,大多数细胞色素酶具有类似于促炎性细胞因子的功能,此外,它们通过直接激活感觉神经元和炎性细胞因子参与病理性疼痛的发生和发展[30]。近期研究示,肠道细菌代谢的短链脂肪酸(short chain fatty acids,SCFA),如乙酸和丁酸,可减轻IBD动物模型的炎症程度,对于增强肠道屏障功能和维持肠道稳态也具有重要性[31-33]。最后,基于差异的DEGs,预测并构建了一组由72个mRNA、39个miRNA和9个circRNA组成的编码-非编码基因组成的共表达网络,基因共表达网络主要围绕枢纽基因(Hub gene)或基因模块(Gene modules)展开,枢纽基因是某个通路或生物过程的关键基因,而有相似表达的基因则会被归为同一模块,枢纽基因与其链接的基因模块的相关性可以初步鉴定一些候选基因,为疾病诊治提供预测及靶点,也为我们的进一步研究提供了方向。
综上,本研究表明,5-ASA治疗DSS诱导的IBD小鼠实验性肠炎的机制涉及了与免疫、炎症、代谢等一系列生物学过程,改变了炎性肠粘膜的基因表达,治疗前后部分差异表达的基因与UC患者的基因表达一致,虽然这些结果尚待进一步验证,但仍为5-ASA的机制提供了部分依据,也今后的研究提供新的线索和思路。

