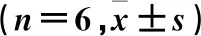DA7R肽修饰的红细胞膜包裹纳米粒的制备与评价
林 雯,史琼枝,李银科,曾 媛,谢向阳 ,胡 华*
1. 黄石市爱康医院检验科,黄石 435000;2.中国人民解放军中部战区总医院药剂科,武汉 430070
药物递送到脑部肿瘤部位,一般需要跨越血脑屏障和脑瘤屏障[1-2]。由于肽类的相对分子质量比蛋白质更小,故其更适合作为靶向修饰分子,引导载体携带药物穿越体内屏障到达靶向部位[3]。A7R(ATWLPPR)是一种七肽,该肽在体外可以选择性地抑制人内皮细胞的增殖。它是血管内皮生长因子受体-2(vascular endothelial growth factor receptor-2, VEGFR-2)和神经毡蛋白-1(neuropilin-1, NRP-1)的特异性配体,这2个受体在血管内皮细胞和一些肿瘤细胞中有较高水平的表达[4-7]。将A7R肽的序列倒转过来,并且采用d-氨基酸合成,可得到脑靶向能力更强的DA7R肽[8]。
红细胞膜包裹纳米粒(red blood cell membrane-camouflaged polymeric nanoparticles,RBC-NP)是将红细胞载体体内清除慢而释药行为可控性差与纳米粒体内清除快而释药行为可控强的特点综合起来的一种载体,其能充分发挥这2种载体各自的优势[9-12]。
本研究拟将兼具跨血脑屏障与跨脑瘤屏障能力的靶向分子DA7R融合于红细胞膜表面,赋予其体内长循环脑肿瘤靶向的特性,延长纳米载体的体内循环时间,提高载体在脑血管部位的暴露概率,增强载体在脑部肿瘤部位的靶向递药功能,实现对脑部肿瘤的高效药物递送。
1 仪器与材料
1.1 仪器
RE52CS型旋转蒸发器(上海亚荣有限公司);Optima超速低温离心机(美国Beckman公司);脂质体挤出器(加拿大Avestin公司);JY92-IID型细胞超声破碎仪(宁波新芝生物科技有限公司);NICOMP 380ZLS Zeta电位/粒度分析仪(美国Santa Barbara公司);7500型透射电子显微镜(日本Hitachi公司);1260型高效液相色谱仪(美国Agilent公司);UV-2550紫外可见光分光光度计(日本岛津公司);FACSCalibur流式细胞仪(美国BD公司)。
1.2 试药
替莫唑胺(质量分数99.6%,武汉康隆世纪科技发展有限公司);DA7R肽(批号20200622,上海强耀生物科技有限公司);DSPE-PEG2000-Mal、DSPE-PEG2000、1,2-二油酰基-sn-丙三基-3-磷脂酰乙醇胺[1,2-dioleoyl-sn-glycero-3-phosphoethanolamine-N-(carboxyfluorescein),PECF]均购自上海艾韦特医药科技有限公司;PLGA(LA∶GA=50∶50,相对分子质量30,山东济南岱罡生物工程有限公司);1640培养基、DMEM培养基、胎牛血清(fatal bovine serum, FBS),均购自浙江天杭生物科技股份有限公司。
1.3 动物
SD大鼠购自湖北省逸挚诚生物科技有限公司[SYXK(鄂)2016-088]。
2 方法与结果
2.1 DSPE-PEG2000-DA7R的制备
参照文献合成DSPE-PEG2000-DA7R[8]。分别称取DA7R肽(RPPLWTA-cys)与DSPE-PEG2000-Mal 适量(1∶1)溶于含有三乙胺(5 eq)的二甲基甲酰胺溶液中,在氮气保护下室温搅拌48 h,加入L-半胱氨酸(10 eq)反应4 h封闭未反应的马来酰亚胺残基。对该反应液以双蒸水避光透析(截留相对分子质量3 500)48 h,冷冻干燥,得白色膨松状产物,-20 ℃保存备用。
2.2 DA7R-NP的制备
2.2.1红细胞膜的提取和纯化 取雄性SD大鼠,体质量(220 ± 20) g,麻醉,固定,将采血针刺入心尖,收集血液存于含肝素的采血管中。将收集到的血液在1 500 r·min-1(4 ℃)条件下离心15 min,弃去上层的血浆、白细胞和血小板。加入等渗的磷酸盐缓冲生理盐水(phosphate-buffered saline, PBS)缓冲液,以1 500 r·min-1(4 ℃)离心15 min,弃去上清,重复操作3次[13]。将获得的红细胞浓缩液贮存于4 ℃冰箱中,备用。
取浓缩的红细胞液1.0 mL置于离心管中,加入去离子水0.9 mL,摇匀,再加入10倍的PBS溶液0.1 mL,混匀。在10 000 r·min-1(4 ℃)条件下离心10 min,弃去上清液。重复上述步骤,直至上清液几乎无色。收集离心管下层的淡红色红细胞膜,用去离子水定容至原全血体积,-20 ℃保存备用。
2.2.2PLGA纳米粒的制备 采用分散挥发法制备纳米粒。称取PLGA约100 mg,溶于氯仿10 mL中;另取替莫唑胺5 mg,溶于二甲基亚砜1 mL中;将上述2种有机溶剂混合,缓慢滴加到去离子水20 mL中(1 000 r·min-1磁力搅拌),室温下继续搅拌(200 r·min-1)4 h,挥去有机溶剂,得到带蓝色乳光的纳米粒(nanoparticles, NP)溶液,置于4 ℃冰箱中备用。PECF标记的纳米粒制备方法同上,只是在载体溶解时加入适量的PECF(终质量浓度15 μg·mL-1)。
取红细胞膜50 μL和DSPE-PEG2000-DA7R 1 mg混合于PBS溶液1 mL(10 mol·L-1,pH为7.4)中,在37 ℃下孵育4 h(摇床振荡频率50 r·min-1),得到DA7R修饰的红细胞膜。
将功能化的红细胞膜在超声条件(150 W,3 min,冰浴)下进行破膜,通过脂质体挤出器(400 nm)20次,随后将挤出的细胞膜与纳米粒混合再通过挤出器(200 nm),通过20次, 即得分散均匀的经靶向肽修饰的红细胞膜包裹的纳米粒(DA7R-NP)。
2.3 DA7R-NP理化性质的考察
2.3.1DA7R-NP形态 采用透射电子显微镜(transmission electron microscope,TEM)对DA7R-NP的形态进行观察[14]。取适量的样品悬液用去离子水稀释至合适浓度,小心滴加至带有支持膜的专用筛网上,自然风干,滴加质量浓度为0.2 g·L-1的磷钨酸液染色,自然干燥后用透射电镜观察形态。结果见图1。
由图1可见,制备的DA7R-NP粒径约为100 nm,纳米粒外层有膜状物包裹,呈壳-核结构。纳米粒外观圆整,多为球形或近球形。

图1 DA7R-NP的透射电镜照片
2.3.2DA7R-NP的粒度分布和Zeta电位 用Zeta电位/粒度分析仪测定DA7R-NP的粒径和Zeta电位。仪器的激光波长设定为639 nm,入射光与散射光的夹角为90°,测定温度为23 ℃。仪器同时测定Zeta电位。结果见图2。
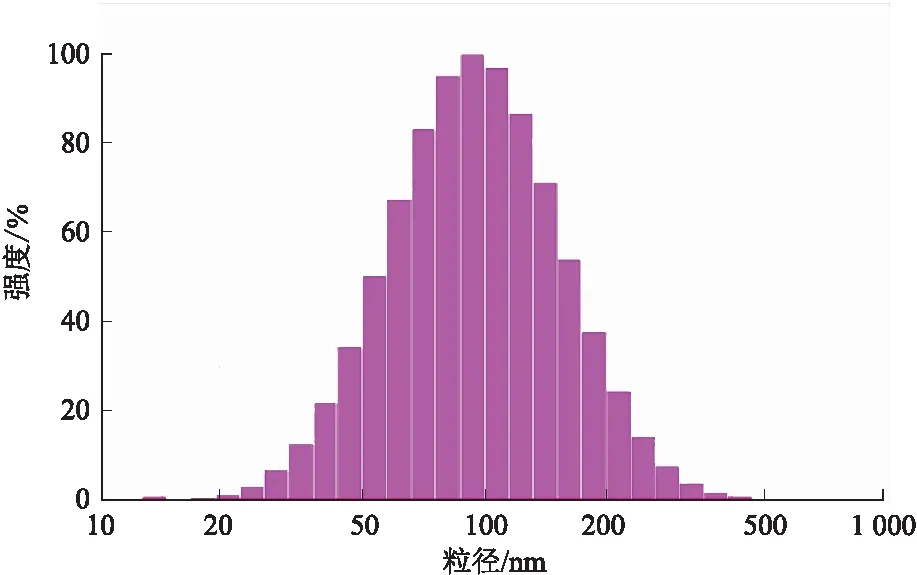
图2 DA7R-NP的粒径分布
由图2可见,DA7R-NP的平均粒径分别为(102.8±11.7) nm,多聚分散系数(polymer dispersity index,PDI)为0.138±0.009,Zeta电位为(-4.96±1.13) mV。
2.3.3包封率 Agilent TC-C18色谱柱(150 mm×4.6 mm,5 μm);流动相为冰醋酸水溶液(质量浓度5 g·L-1)-甲醇(90∶10);柱温为40 ℃;检测波长为329 nm;流速为1 mL·min-1;进样量为20 μL。
替莫唑胺主峰与其他杂质分离度良好,辅料不干扰主药的测定。用流动相溶液配制系列替莫唑胺对照品溶液(质量浓度0.1~30 μg·mL-1),以峰面积(A)对质量浓度(C)进行线性回归,得回归方程A=60.165C+1.534 8(r=0.999 9),替莫唑胺的质量浓度在0.1~30 μg·mL-1范围内与峰面积线性关系良好。高、中、低3个质量浓度的平均回收率为100.3%,RSD值为1.72%,日内精密度RSD值为1.41%,日间精密度RSD值为1.78%,溶液在5 d内的RSD值为1.75%,均符合方法学要求。
采用离心法分离纳米胶体溶液中的游离药物,经液相色谱仪测定药物质量浓度后,计算纳米粒的包封率。将样品液加入离心管中,离心45 min(25 000 r·min-1,4 ℃),收集上清液,用液相色谱仪测定其中游离药物的质量浓度(C游)。
根据公式包封率=(C总-C游)/C总×100%计算纳米粒的包封率,C总按投料量计算。计算得DA7R-NP的包封率为79.14%±2.57%。
2.4 稳定性考察
精密量取制备的样品(DA7R-NP)50 μL加入PBS溶液1 mL(pH 7.4)中,混合,密封,备用。将该样品放置于4~8 ℃环境中,于样品制备的当天(第0天)和制备后的第30天取样测定样品的粒径、电位、透光率(750 nm)和包封率,考察4 ℃条件下制剂的稳定性。
将PBS(pH 7.4)与FBS按照1∶9混合配制成稀释液(模拟血浆),取DA7R-NP样品适量用混合稀释液稀释(1∶20),放置于37 ℃条件下,分别于12、24 h测定透光率(750 nm)。
结果表明,在4~8 ℃条件下放置30 d后,DA7R-NP的粒径(100.3±49.6) nm、PDI(0.135±0.011)、Zeta电位(-5.02±1.09) mV以及透光率与第0天基本一致(波动小于5%),说明所得的纳米粒在PBS中的稳定性良好,未发生聚集或沉淀。DA7R-NP的包封率在第30天时略有下降,为78.61%±2.44%。
DA7R-NP在模拟血浆中24 h的透光率波动小于5%,说明在该模拟环境下,24 h样品的光学特征未发生明显变化,胶体体系基本稳定。
2.5 体外释药行为考察
采用动态膜透析法进行体外释药行为考察[15-16]。分别精密量取含药的DA7R-NP和NP混悬液2.0 mL置于透析袋(截留相对分子质量8 000)中,两端夹紧后置于100 mL PBS(pH 5.0)中,置于恒温水浴中(37 ℃,100 r·min-1)振荡,在0、0.5、1、2、4、8、12、24、48 h取释放介质200 μL,同时补加等体积空白释放介质,按照2.3.3项下方法测定释放介质中的药物质量浓度,绘制药物释放曲线。见图3。
由图3可知,没有红细胞膜包裹的纳米粒(NP)在8 h时基本已释放完毕,后继释放增加量不大。红细胞膜包裹的纳米粒(R-NP,DA7R-NP)在12 h时释放量几乎不再增加。在红细胞膜的阻滞作用下,红细胞膜包裹的纳米粒呈现出较好的缓释性能。
图3 DA7R-NP、R-NP、NP的体外释药曲线 (n=6)
2.6 细胞摄取实验
2.6.1bEnd.3细胞对纳米粒的摄取 将bEnd.3细胞接种于6孔细胞板内(1×105个/孔),37 ℃培养(体积分数5%的二氧化碳)3 d后,移除孔中的培养基,分别加入适量经PECF标记的NP、R-NP和DA7R-NP纳米混悬液,用培养基调整浓度为0.3 μmol·mL-1。孵育0.5、1、2、4 h后,弃去纳米悬液,用PBS缓冲液(4 ℃)洗涤3次,胰酶溶液(质量浓度2.5 g·L-1)消化,以3 000 r·min-1离心5 min,弃去上清液,将细胞用PBS溶液0.5 mL(4 ℃)重新混悬,用流式细胞仪测定bEnd.3细胞的荧光强度。结果见表1。
表1 bEnd.3细胞对不同制剂纳米粒的摄取量
由表1可知,bEnd.3细胞对3种纳米粒的摄取量都随时间的延长而增加。从2 h开始,DA7R-NP的荧光强度明显强于无红细胞膜包裹的NP、R-NP。NP与R-NP之间的荧光强度无显著性差异。说明红细胞膜经DA7R修饰后,被bEnd.3细胞的摄取量较未修饰的纳米粒有显著提高。
2.6.2体外初步药效评价 根据参考文献建立体外血脑屏障模型[17-20]。用明胶D-Hank’s溶液(质量浓度20 g·L-1)将细胞插入器包被后,在每个插入器(孔径0.4 μm、直径12 mm、面积1.12 cm2)中接种1×104个鼠脑毛细血管内皮细胞,每2天更换1次培养液,培养6 d。于显微镜下观察到细胞汇合后,将培养基加到细胞插入器的上池中,使上、下池液面差大于0.5 cm,此液面差可维持4 h以上,说明细胞已经形成了紧密连接;用电阻仪检测插入器内、外两侧的电阻值为(213±9) Ω·cm2,说明体外血脑屏障模型基本建立成功。在细胞插入器的下池中接种入2×103个C6细胞,共培养24 h。移除细胞插入器上池中的培养基,分别加入空白培养基、含药培养基、含药NP、含药R-NP和含药DA7R-NP(替莫唑胺的终浓度为3 μmol·L-1),继续培养48 h,经磺基罗丹明B染色后,于540 nm波长下测定每孔A值,计算存活率。
不同替莫唑胺制剂在跨越血脑屏障后,对C6细胞的生长抑制效果见表2。脑胶质瘤C6细胞存活率从小到大依次为:DA7R-NP组 红细胞相关的载药系统较传统的药物载体在延长药物体内循环时间、提高药物稳定性等方面具有一定的优势[9]。本文将红细胞膜用靶向肽修饰后,包覆于PLGA纳米粒表面,可延长纳米粒在体内的停留时间,给予纳米粒更长的时间到达脑血管周围,从而提高靶向效率。此外,本方法还适用于红细胞膜包封率不高而纳米粒包封率高的药物。 表2 不同替莫唑胺制剂穿越体外血脑屏障模型对C6细胞存活率的影响 靶向材料的合成采用肽类修饰中常用的加成反应合成。其原理是利用DSPE-PEG2000-MAL中的马来酰亚胺基团(-MAL)与DA7R(RPPLWTA-cys)肽半胱氨酸残基带有的巯基(-SH)之间的迈克尔加成反应而制备DSPE-PEG2000-DA7R。该反应条件温和,产物质量分数高。实验过程需要注意防止巯基氧化并控制反应温度。 本文制备的红细胞膜包覆的纳米粒在粒径、电子显微镜照片等方面与文献报道一致[9-11]。DA7R-NP的稳定性实验结果表明,经红细胞膜包裹后的纳米粒在低温条件下30 d内基本稳定,制剂具有较好的稳定性。模拟血浆中稳定性实验结果表明,DA7R-NP可以在模拟血浆中至少稳定存在24 h。这些结果可能是红细胞膜自身良好的稳定性使然。体外释药行为考察结果也表明,在红细胞膜的阻滞作用下,药物从纳米粒中的释放速度减慢,缓释作用显著。 初步的体外血脑屏障模型结果表明,在DA7R肽的介导下载体跨越血脑屏障的能力显著提高,这可能与DA7R肽可与血管内皮生长因子受体-2、神经毡蛋白-1特异性结合相关。下一步需要进一步在动物模型中考察DA7R-NP的药物脑靶向递送能力。 红细胞膜表面抗原的组织相容性是制约该技术发展的重要因素。目前的策略有2种,一是采用个体化的血细胞分离制备药物载体,二是去除红细胞表面主要的抗原成分(如多糖、蛋白质等)。 本实验制备的由DA7R肽修饰的红细胞膜包裹的PLGA纳米粒理化特性、稳定性良好,具有很好的药物脑靶向递送应用潜力。3 讨论