1项初诊中国慢性淋巴细胞白血病患者的IGHV基因使用特征的单中心回顾性研究
陈睿泽,夏 奕
南京医科大学第一附属医院血液科,南京医科大学血液研究重点实验室,江苏省肿瘤个体化医学协同创新中心,江苏 南京210029
慢性淋巴细胞白血病(chronic lymphocytic leukemia,CLL)是一种以成熟B 淋巴细胞在骨髓、淋巴组织和血液中克隆性聚集为特点的血液系统恶性肿瘤,是西方白种人最常见的成人白血病[1]。与西方相比,中国CLL具有发病率低(仅为西方1/10)、初诊年龄低、预后差的特点[2]。造成疾病特征差异的原因目前尚不明确,多数学者推测是来源于不同人种的遗传学特征。
CLL病程长、难以治愈,不同的治疗方式导致肿瘤细胞发生耐药性克隆演变。因此,在治疗伊始选择合适的药物至关重要。B 细胞受体(B cell receptor,BCR)对正常B 细胞及肿瘤B 细胞的生存至关重要。BCR 由免疫球蛋白(immunoglobulin,IG)和Igα/Igβ构成。其中免疫球蛋白重链可变区基因(immunoglobulin heavy-chain variable region gene,IGHV)突变状态是CLL 最重要的预后标志物之一。与胚系基因相似度≥98%的CLL 患者IGHV无突变(IGHV-UM),预后不良;与胚系基因相似度<98%的CLL 患者IGHV 有突变(IGHV-M),预后较好[3-4]。
前期数据显示,中国CLL 患者在IGHV 基因的突变状态和片段使用上均存在较大差异[5]。本研究为一项单中心、回顾性分析,拟在较大样本量的基础上,系统研究中国初诊CLL 患者包括IGHV 基因突变、片段使用特征及其与临床和预后的相关性。发现与西方CLL 患者的数据比较,中国初诊CLL 患者IGHV3-7和IGHV4-39基因片段使用率高,其中使用IGHV4-39的患者预后差,并与晚期疾病、细胞遗传学12号染色体三体、NOTCH1基因突变和黏附因子CD49d高表达相关,为细化中国CLL 患者的预后分层、探索疾病的遗传学特点提供理论依据。
1 对象和方法
1.1 对象
本中心回顾性研究纳入2005—2019 年在南京医科大学第一附属医院就诊的291 例初诊CLL 患者。诊断符合国际CLL 工作组2018(IWCLL 2018)诊断标准,临床信息在首次入院后24 h 内采集。所有患者随访截止日期为2020年6月。
1.2 方法
1.2.1 PCR扩增与测序
基因组DNA(gDNA)使用QIAmpDNA 试剂盒(QIAGEN 公司,美国)提取。gDNA PCR 扩增采用IGHV 试剂盒IGH Somatic Hypermutation Assay v2.0(InVivo Scribe 公司,美国)。该试剂盒正向引物包括Leader引物和FR1引物,反向引物为JH引物。正向引物方面,优先采用Leader 引物进行扩增,在Leader引物扩增失败后再尝试使用FR1引物。利用直接测序法来确定IGHV、IGHD、IGHJ 基因的序列。如测序序列图出现双峰,则采用克隆测序。测序序列由3130 Genetic Analyzer 检测(Life Technologies公司,美国)。
1.2.2 IGH序列鉴定
IGH 重排结果由IMGT 数据库和IMGT/VQUEST 工具进行分析。与胚系IGHV 序列相比,相似性<98%的IGHV序列被定义为IGHV-M,相似性≥98%被定义为IGHV-UM。
1.2.3 细胞遗传学和TP53、NOTCH1、SF3B1、MYD88基因突变检测
采用荧光原位杂交技术(fluorescence in situ hybridization,FISH)检测了CLL 细胞del(11q)、del(17p)、del(13q)和12 号染色体三体的情况[6]。并利用Sanger 测序的方法研究了TP53 基因(4 号-9 号外显子)、NOTCH1 基因(PEST 功能域)、SF3B1 基因(14 号-16 号外显子)和MYD88 基因(3 号-5 号外显子)的突变状态[7]。
1.2.4 免疫表型分析
CD38、ZAP70和CD49d的流式细胞术检测方法如前所述,三者的阳性截断值分别为30%、20%和30%[8]。
1.3 统计学方法
所有数据均使用SPSS 25.0 软件进行统计分析。分类变量以百分比(%)表示,并使用χ2检验或Fisher 确切概率法进行分析。连续变量以平均值±标准差()表示,并使用非配对t检验和Mann WhitneyU检验分析。总生存期(overall survival,OS)被定义为从诊断到死亡或最后一次随访的时间,至首次治疗时间(time to first treatment,TTFT)被定义为诊断至首次治疗的时间。生存曲线由Kaplan-Meier 方法构建,各组患者生存曲线比较使用Log-rank 检验。P<0.05 为差异有统计学意义。
2 结果
2.1 患者临床特征
本研究共回顾性分析了291例于本中心就诊的初诊CLL 患者,中位年龄为59 岁(范围:16~86 岁)。患者临床特征如表1所示。
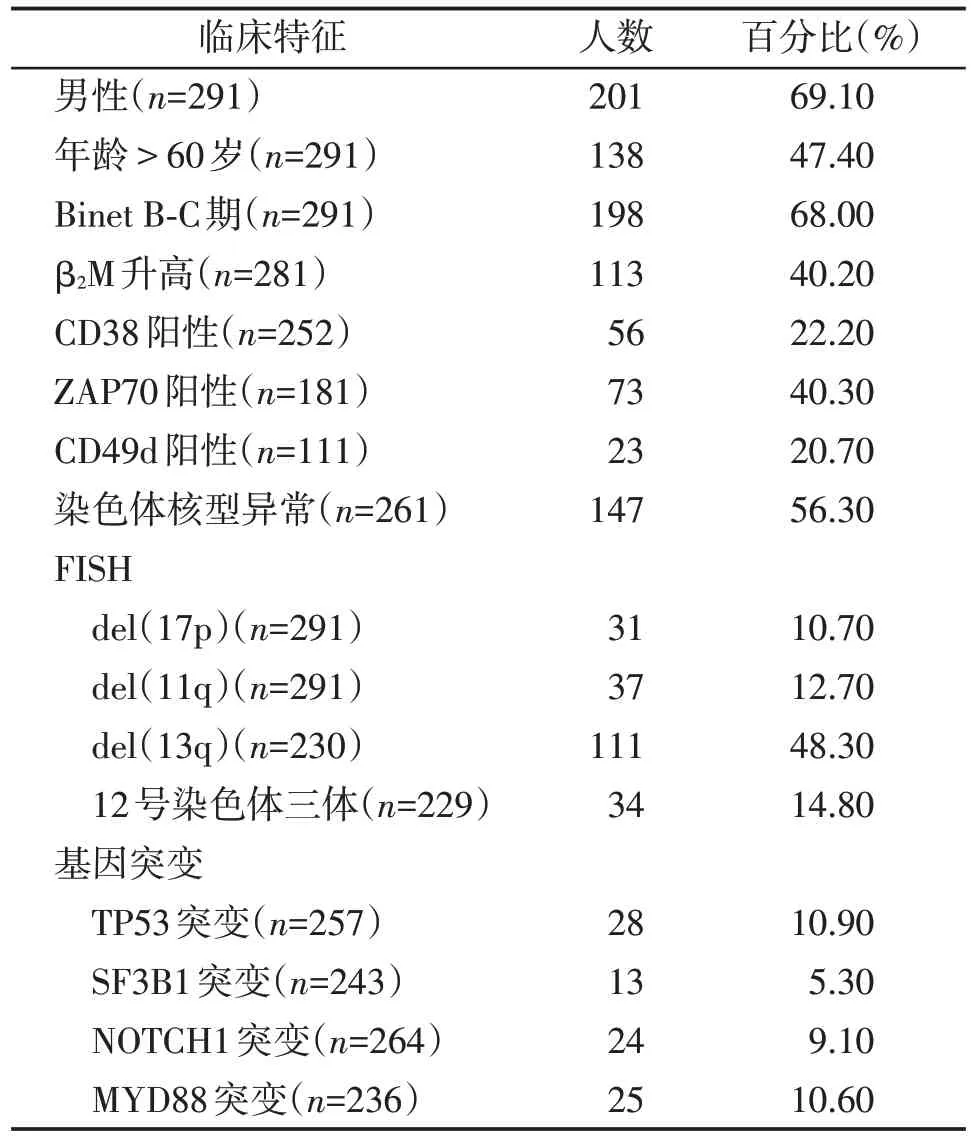
表1 初诊CLL患者的临床特征
2.2 IGHV突变状态与预后
291 例初诊CLL 患者中,119 例IGHV-UM(119/291,40.9%),172 例IGHV-M(172/291,59.1%)。中位随访37 个月,IGHV-UM 的患者TTFT(P<0.001)和OS(P=0.003)均显著短于IGHV-M 的患者(图1)。本研究中我国CLL患者IGHV-M的比例与西方CLL患者无显著差异(59.1%vs.55.0%,P=0.158)。
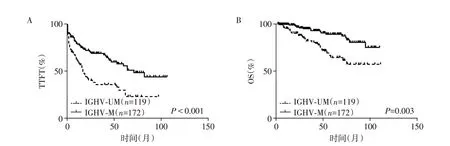
图1 IGHV突变状态对中国初诊CLL预后的影响
2.3 IGHV基因家族和片段的使用
所有CLL 患者中,最常用的IGHV 家族分别为IGHV3(145/291,49.8%)、IGHV4(76/291,26.1%)、IGHV1(46/291,15.8%)、IGHV2(9/291,3.1%)、IGHV5(9/291,3.1%)、IGHV7(4/291,1.4%)、IGHV6(2/291,0.7%)。
最常用的IGHV基因片段分别为IGHV3-7(28/291,9.6%)、IGHV3-23(24/291,8.2%)、IGHV4-34(23/291,7.9%)、IGHV4-39(21/291,7.2%)、IGHV1-69(15/291,5.2%)、IGHV4-59(10/291,3.4%)、IGHV3-30(10/291,3.4%)。
与西方CLL 患者数据相比,本中心中国CLL 患者IGHV4 家族使用率偏高(26.1%vs.20.6%,P=0.024),IGHV1 家族使用率偏低(15.8%vs.23.8%,P=0.002)。IGHV3-7 基因片段(9.6%vs.5.7%,P=0.006)、IGHV4-39(7.2%vs.3.7%,P=0.002)使用率偏高,IGHV1-69 使用率偏低(5.2%vs.12.8%,P<0.001,图2)。
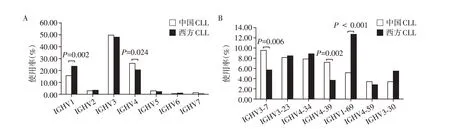
图2 中国初诊CLL患者IGHV基因家族和使用片段与西方CLL患者的比较
2.4 IGHV4-39患者预后差且携带多种不良预后因素
选择使用率显著偏高的IGHV3-7 和IGHV4-39基因片段使用者进一步分析,发现使用IGHV4-39的CLL 患者TTFT 显著缩短,而IGHV3-7 对TTFT 和OS的影响均不显著(图3)。
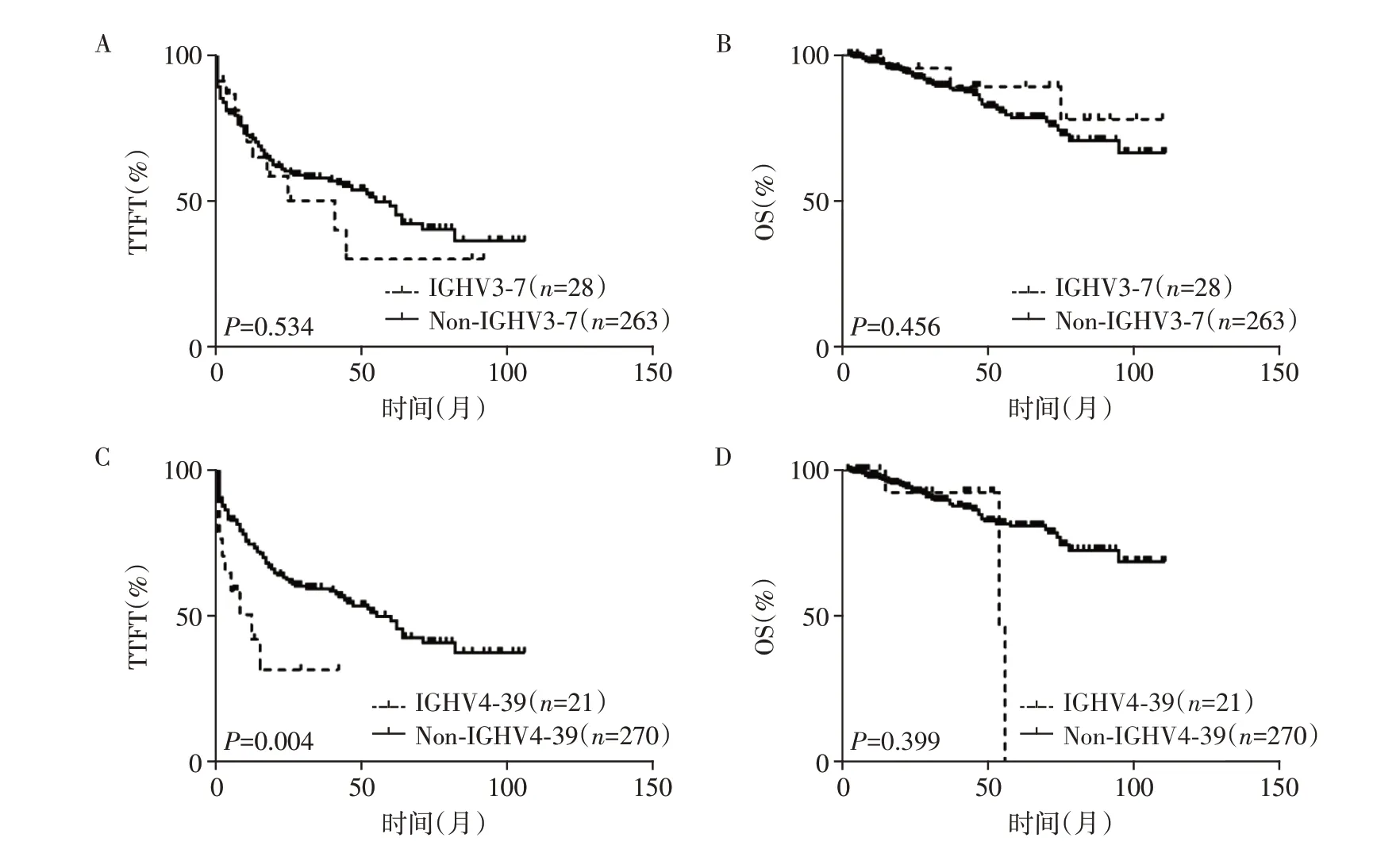
图3 中国CLL患者IGHV基因使用片段对预后的影响
临床指标相关性分析显示,IGHV4-39与Binet BC 期(90.5%vs.66.3%,P=0.022)、IGHV 无突变状态(76.2%vs.38.1%,P=0.001)、细胞遗传学12号染色体三体(35.0%vs.12.9%,P=0.008)、NOTCH1基因突变(23.8%vs.7.8%,P=0.014)、CD49d 表达(54.5%vs.17.0%,P=0.004)等预后不良因素相关,而与TP53 基因异常、染色体核型异常、SF3B1 突变、MYD88突变等指标无相关性。
3 讨论
IGHV 使用片段和突变状态是CLL 的克隆性证据,在CLL 整个病程中保持不变[1]。IGHV 突变状态是判断CLL 预后的依据,在CLL 国际预后指数(international prognostic index,IPI)预后评分系统中,IGHV无突变积分2分,是仅次于TP53基因异常的最重要的预后指标[9]。曾有报道显示,中国CLL患者IGHV 有突变的比例高于意大利CLL 患者(66%vs.49%)[5]。但本研究并没有发现中西方人种在IGHV 突变状态上的分布差异,这可能与本研究选取的对照组来自全球多中心研究,而非仅仅是白种人有关[3]。
长期以来,中国CLL 患者与西方CLL 患者在发病率、临床特征上的差异备受关注[2,10]。现有证据表明,造成这些差异的原因在于遗传因素,而非环境影响。本研究发现中西方CLL患者IGHV基因使用模式不同佐证了这一观点:在中国CLL 患者中,IGHV4 家族的使用率高,IGHV1 家族的使用率低;在具体基因片段使用方面,IGHV3-7和IGHV4-39的使用率高,而IGHV1-69 使用率低。以上结果与其他来自亚洲人群的IGHV研究一致[5,11],提示亚洲人独特的IGHV 使用特征并非偶然现象,可能是由不同人种间遗传因素的差异导致。
在中国CLL 患者使用率高的2 个IGHV 基因片段中,IGHV3-7对TTFT和OS均无影响,而IGHV4-39使用者TTFT 显著缩短。因此本研究进一步对IGHV4-39使用者进行临床特征分析,发现IGHV4-39与晚期疾病、细胞遗传学12 号染色体三体、NOTCH1基因突变和黏附因子CD49d高表达等一系列预后不良因素有统计学相关性。这是国内学界首次针对中国CLL 患者中IGHV4-39 基因使用者进行详细的亚组分析。IGHV4-39 作为一类特殊的免疫球蛋白重链基因,常常出现于BCR 同型模式8 亚群(BCR stereotypy subset#8)中,形成8 亚群固定的IGHV4-39-IGHD6-13-IGHJ5 搭配模式[3,12]。1 项包含29 856例CLL患者的全球多中心研究报道8亚群和8B 亚群的使用者约占所有CLL 患者的0.5%和0.2%[4],此类患者大多数IGHV 无突变、预后较差,与CLL 发生弥漫大B 细胞转化(即Richter 转化)相关。在抗原性反应方面,以IGHV4-39 为特征的同型模式8 亚群CLL 也具有独特的特征。体外实验中,8 亚群的CLL 细胞释放的抗体具有多重抗原反应性,可以与微生物病原体、自身抗原的分子结构以及细胞凋亡过程中化学修饰产生的新抗原表位等多种抗原结合,显著高于其他CLL同型模式亚群[13]。这种紧密结合造成的BCR持续激活,很可能是导致此类患者病程较长的原因。
本研究发现IGHV4-39 的使用与NOTCH1 基因突变及黏附分子CD49d 高表达相关。IGHV4-39 与NOTCH1 突变的关联性早有报道[5,14]。近期文献表明,NOTCH1 基因突变可通过激活NFκB 信号通路导致CD49d高表达,使CLL 细胞更易黏附于保护性微环境中,免于被药物杀伤[15]。即使是在采用当前CLL 标准疗法的BTK 抑制剂治疗的患者群中,NOTCH1突变患者6个月时淋巴结治疗反应仍显著差于NOTCH1 野生型患者,同时伴随CD49d 高表达和更短的无进展生存期[16],预示着此类NOTCH1 突变和CD49d 高表达共存的患者是标准治疗下疾病复发的高危人群。但在CLL 病程中,NOTCH1 突变和CD49d 表达随着疾病进展变化,NOTCH1 突变在初诊时阳性率仅8%~10%,而在难治患者可高达25%[7],这种在初诊时的低阳性率易误导临床判断。因此,作为CLL 病程中保持不变的克隆性标志IGHV 基因,IGHV4-39 是预警NOTCH1 突变和CD49d高表达相关BTK抑制剂耐药的合理指标。
本研究是国内首个针对IGHV4-39 的CLL 患者群体的统计分析,进一步阐述了CLL 患者群体的异质性,并提供了针对IGHV4-39 CLL的进一步研究的线索。但是本研究也有一些不足,例如因重链互补决定区3(HCDR3)部分序列缺失,本研究并未进行同型模式B 细胞受体亚群分析,同时针对IGHV4-39 CLL 的独特疾病特征缺乏相应的机制研究,这些将在今后的工作中进一步阐述。
综上,本研究通过回顾性分析291 例单中心初诊CLL 患者的IGHV 基因突变状态和使用片段特征,证实了中国CLL 患者与西方CLL 患者具有不同的遗传学特性。本研究发现,IGHV4-39在中国CLL患者中使用率高,TTFT短,并与晚期疾病、NOTCH1突变、CD49d高表达等多种不良预后因素相关,可能成为预测CLL疗效的重要指标。

