多糖作为免疫佐剂的研究进展①
姜红蕾 王凤山(山东大学药学院生化与生物技术药物研究所,济南 250012)
接种疫苗是产生充分的保护性免疫反应来预防和控制传染病传播的最有效策略。疫苗需要有强的免疫原性才能刺激机体产生免疫应答,但单纯由抗原组成的疫苗往往因其免疫原性弱而无法起到预防感染性疾病的作用,因此需要佐剂(adjuvant)来增强免疫反应。目前,铝佐剂是FDA 唯一批准用于人体的佐剂,虽然已经使用了80 余年,却只能诱导Th2 型免疫反应[1]。欧洲批准使用的MF59(水包油型乳剂)可同时引起Th1 和Th2 型免疫应答,但其会在注射部位引起不良反应[2]。因此,开发新型的佐剂以克服现有佐剂的不足具有重要意义。许多多糖具有促进机体特异性免疫和非特异性免疫的作用,且具有低毒、安全等特点,可能成为理想的疫苗佐剂。本文综述了壳聚糖、菊糖、葡聚糖、脂多糖(lipopolysaccharide,LPS)、中药多糖等作为免疫佐剂的研究,并对其作为佐剂的前景进行了展望。
1 壳聚糖
壳聚糖(chitosan)是由几丁质N-脱乙酰化形成的天然多聚糖。在酸性介质中,壳聚糖分子上的氨基以-NH3+的形式存在,是唯一一种阳离子多糖,这一特性使壳聚糖能够被制成微颗粒、纳米颗粒等剂型[3]。壳聚糖作为免疫佐剂的特性由NISHIMURA 等[4]在1984年首次报道。在之后的30多年间,对壳聚糖进行了大量研究。壳聚糖可通过TLR4 促进树突状细胞(dendritic cells,DC),能上调CD80 和CD86 表达,但未能激活T 细胞产生相应的细胞因子[5],这表明单纯壳聚糖不能引起T细胞相关免疫反应。而壳聚糖及其衍生物与抗原结合后,可弥补壳聚糖本身的免疫缺陷。研究表明壳聚糖包裹卵清蛋白(OVA)的纳米颗粒后可刺激主要组织相容性复合体(MHC)Ⅰ类分子的表达,显著上调共刺激因子CD40、CD80、CD86 的表达,促进细胞因子IL-6、IL-12、MIP-1、TNF-α 的分泌,并刺激CD4+和CD8+T 细胞的增殖[6-7]。壳聚糖颗粒已被证实可激活NLRP3 炎症小体,该途径可促进中性粒细胞的募集和抗原提呈细胞(APC)的成熟,并可产生以IL-1β和IL-18 等细胞因子分泌为特征的炎症环境[8]。也有研究表明,壳聚糖可通过参与cGAS-STING 途径激活DC 并促进Th1 反应[9]。这表明壳聚糖能够通过多个途径刺激产生免疫应答。
近年来,壳聚糖在黏膜疫苗佐剂中也展现出了独特应用前景。壳聚糖由于其独特的阳离子特性,具良好的黏膜黏附性,能延长抗原的滞留时间,并且能打开黏膜上皮细胞间的紧密连接,使抗原被黏膜APC 识别引起一系列免疫应答[10]。将EV71 肠病毒的衣壳蛋白VP1 与壳聚糖混合,通过灌胃免疫小鼠后发现产生大量IgG 抗体,诱导脾细胞产生高水平的Th1、Th2 和Th3 免疫反应,且在小肠道、阴道、粪便、呼吸道中检测出大量的VP1 特异性IgA 抗体,说明VP1 与壳聚糖混合给药后可引起小鼠黏膜免疫应答[11]。将O-季铵化壳聚糖和硫酸化可德兰多糖制备形成纳米颗粒荷载OVA 抗原,对小鼠滴鼻给药后,在其口腔和阴道黏膜部位中也均发现了OVA特异性IgA 的表达[12]。由壳聚糖(ChiSysTM)、单磷酰脂质(MPL)和诺如病毒VLP抗原制成的粉末喷雾疫苗(NV-VLP)已进行了Ⅰ期临床试验,其结果表明,在人体中NV-VLP 具有良好的耐受性,无严重不良反应,并引起肠黏膜组织(诺如病毒的进入部位)分泌IgA[13]。
2 菊糖
菊糖(inulin),又名菊粉,是一种的天然果糖聚合物,是植物体内的一种贮存多糖。菊糖主要存在α、β、γ、δ 4 种构型。其中α、β 构型在常温下溶解,而γ 构型菊糖要达到37℃溶解。δ 菊糖需要在40℃下才能溶解,但当其开始冷却后需要反复加热处理才可以重新转化为δ-菊糖。在1946 年科学家就发现了可溶的菊糖,这些溶解性的菊糖不能激活补体或增强适应性免疫应答,表明菊糖的免疫作用与其颗粒的特定包装结构密切相关[14]。菊糖的γ 和δ 构型都具有免疫佐剂性质。其中,γ-菊糖能够使巨噬细胞表面的C3 片段沉积,从而导致T 细胞活化,但γ-菊糖在消毒时结构和性质不稳定[15]。而δ 构型具有很好的温度稳定性,其在伽马射线灭菌后结构无变化,还具有很好的免疫活性。目前δ-菊糖主要被制备成AdvaxTM作为免疫佐剂使用,AdvaxTM是由直径1~2µm的层状晶体圆形δ-菊糖微粒,这种特殊的微粒结构是AdvaxTM激活免疫系统的关键[16]。在研究中,证实了AdvaxTM对乙型肝炎病毒(HBV)、日本脑炎病毒、SARS 冠状病毒、艾滋病毒(HIV)、呼吸道合胞病毒(RSV)、李斯特菌、炭疽杆菌等多种病原微生物有免疫佐剂作用。早期研究中,用AdvaxTM和乙型肝炎表面抗原(HBsAg)联合免疫小鼠后发现,HBsAg 特异性抗体滴度升高,能促进CD4+和CD8+T细胞增殖和Th1、Th2 和Th17 细胞因子产生[17]。与明矾组相比用,AdvaxTM至少可节省4 倍的抗原剂量。AdvaxTM用于流感疫苗中也能使免疫细胞增殖,使特异性抗体提高,且效果持久,在免疫后1年免疫作用仍然十分明显。由AdvaxTM为佐剂制成的乙肝疫苗和流感疫苗已经完成临床Ⅰ期试验,其结果表明AdvaxTM具有良好的耐受性,未发现安全性问题[18-19]。除了可以用于传统的免疫方式,AdvaxTM也可通过黏膜给药。TOMAR 等[20]将AdvaxTM与灭活流感病毒混合制成喷雾剂,通过鼻内免疫后与未加佐剂组相比,能够引起更高的全身、黏膜和细胞免疫应答。肺内免疫时,AdvaxTM可增加肺内因子CXCR3、CD69 和CD103 的表达。因此,AdvaxTM是一种很好的潜在黏膜佐剂。
目前,尽管对AdvaxTM有大量研究,但AdvaxTM的免疫机制尚不明确。推测其主要作用机制是先激活APC,与抗原结合,诱导与增强抗原呈递和抗原特异性相关的表型变化,包括使CD4+和CD8+T 细胞增殖,以及抗原刺激的IFNγ、IL-4、IL-5、IL-6、IL-10、IL-13、IL-17 和GM-CSF 的表达上调。并且,不同于传统的佐剂明矾,AdvaxTM没有强烈的Th2 或Th1 偏倚。同时,AdvaxTM佐剂不能诱导巨噬细胞产生促炎细胞因子TNF-α和IL-1,不会诱导炎症小体活化[17]。其佐剂作用不依赖于抗原吸收,因为即使在抗原免疫前1 d注射AdvaxTM,抗体反应也会增强。
3 葡聚糖
葡聚糖可分为α-葡聚糖和β-葡聚糖。大多数葡聚糖来源于植物或微生物,种类繁多。具有佐剂活性的α-葡聚糖主要有右旋糖酐,β-葡聚糖主要有海带多糖、香菇多糖、酵母聚糖等。
3.1 α-葡聚糖 右旋糖酐(dextran)是由多个葡萄糖缩合而成的同聚多糖。右旋糖酐硫酸化后具有广泛的促炎作用,是一种有效的引起细胞介导的迟发型超敏反应的免疫佐剂[21]。二乙基氨基乙基(DEAE)-葡聚糖是右旋糖酐的衍生物,已被用作兽用佐剂。在另一项研究中发现,乙酰化葡聚糖(Ac-DEX)微粒可调节疫苗的释放和抗原的递送。CHEN 等[22]将Ac-DEX 微粒和OVA 共同免疫小鼠后发现,Ac-DEX 微粒作为佐剂可以诱导更强的IgG、IgG1 和IgG2a 水平,这可能是由于增强了细胞摄取和促进了细胞内的通路。此外,与铝佐剂组相比,Ac-DEX 微粒产生了更平衡的Th1/Th2 应答。研究还表明,Ac-DEX 微粒可通过调节抗原的释放从而改变到达最强免疫的时间。这为生产更加安全有效的疫苗佐剂提供了研究基础。
3.2 β-葡聚糖 β-葡聚糖主要来源于生物的细胞壁,如酵母、某些种类的海藻等。在研究中,β-葡聚糖没有明显的毒性或副作用。由于不同种类β-葡聚糖结构的差异,其免疫作用也存在差异。总的来说,β-葡聚糖可作为病原相关分子模式(PAMP)被免疫细胞表面的Toll 样受体、dectin-1、CR3 和CD5受体识别。β-葡聚糖和受体间的相互作用触发细胞内信号激活免疫相关分子的表达和调节免疫应答。从酿酒酵母(Saccharomyces cerevisiae)细胞壁上获得的β-葡聚糖能激活巨噬细胞、单核细胞、DC,导致炎症,刺激分泌TNF-α、IL-8、活性氧自由基(ROS)和花生四烯酸等炎症因子[23]。有研究发现,dectin-1受体的激活同时活化了Toll样受体介导的NF-κB,dectin-1受体和Toll样受体协同介导细胞因子的产生[24]。还有研究表明,蘑菇多糖可降低OVA 诱导的Th2 免疫应答,增强Th1型免疫应答,从而表明其不仅能够激活固有免疫应答,也能激活适应性免疫应答[25]。将葡聚糖制备成微粒后作为抗原载体也能引起强免疫反应。DEEPE 等[26]用葡聚糖微粒包裹荚膜组织胞浆菌的碱性提取物鼻腔免疫小鼠,发现肺和脾脏的菌落数明显下降,且肺内的IFN-γ、IL-17 分泌增加,引起Th1 和Th17 T 细胞免疫应答。为了引起更加强烈和平衡的免疫应答,LIU 等[27]通过添加其他类型佐剂制成微粒来增强葡聚糖的佐剂性,调节免疫反应方向。近年来,进行了葡聚糖通过黏膜给药途径进行免疫的研究。例如,小鼠口服β-葡聚糖后,肠上皮内淋巴细胞数量增加,细胞因子IFN-γ 分泌增加,迅速引起黏膜部位产生T细胞免疫应答[28]。在接触病原的早期,使黏膜部位快速产生免疫应答,防止组织感染的发生。
4 LPS
LPS 是革兰氏阴性菌外膜的一部分,一般占外膜的35%~45%。毫无疑问,LPS 是天然免疫的诱导剂和增强剂。传统上,一般认为LPS 能够被细胞上TLR4 识 别,激 活MyD88(myeloid differentiation primary response gene 88)和TIR(Toll/IL-1 receptor)通路,诱导巨噬细胞活化和炎症细胞因子产生,使T细胞的反应向Th1 转移[29-30]。最近,有研究发现LPS可触发caspase-11 介导的非典型炎症小体[30-31]。而LPS无法作为人类佐剂使用主要是由于其能强烈激活MyD88 通路,导致不必要的、潜在有害的炎症反应。从20世纪70年代开始,对LPS进行了大量的改造实验,并成功制备了毒性更低,免疫作用强的单磷酰脂质A(monophosphoryl lipid A,MPLA)。根据临床研究,MPLA 是一种安全的佐剂[32-33]。MPLA 是70 多年来第1 个被批准作为佐剂使用的TLR 激动剂,也是第1个用于人类的新佐剂。MPLA在保留免疫刺激活性的同时降低毒性的主要原因之一是MyD88 减少信号而TRIF(toll-interleukin 1 receptor domain-containing adapter inducing interferon-beta)途径保留信号[34]。与MyD88 相比,TRIF 途径在允许TLR4 激动剂介导的早期T 细胞反应的刺激方面发挥更显著的作用。目前,由葛兰素史瑞克公司研制的AS01、AS02、AS04佐剂中都含有MPLA,已被批准用于疟疾疫苗、乙肝病毒疫苗、人乳头瘤病毒疫苗等多种疫苗中。表1为几种研究较多的多糖免疫作用及其作为佐剂的研究现状。
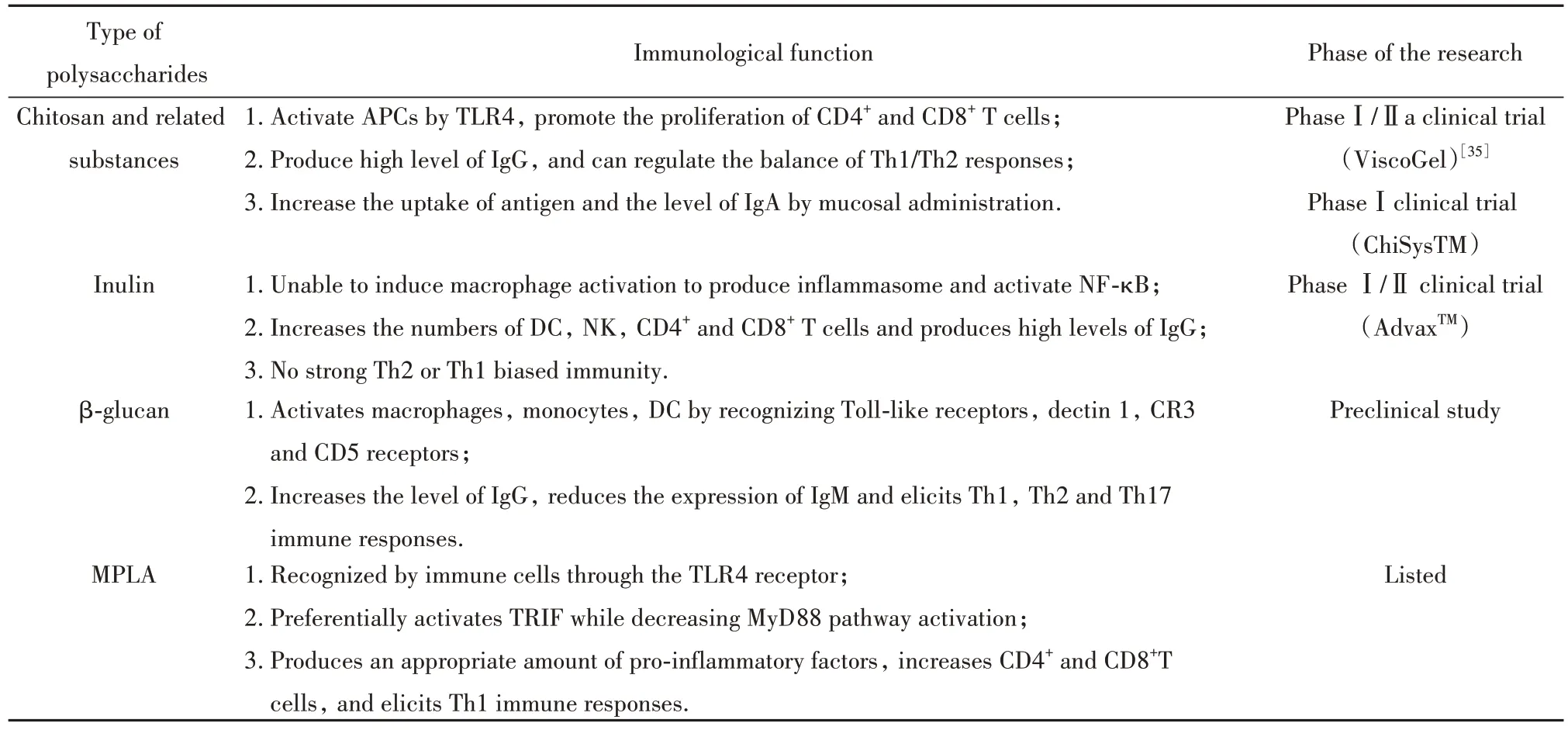
表1 多糖的免疫作用及其研究现状Tab.1 Immunity and research status of polysaccharides
5 中药多糖
除了以上所述的几类多糖以外,中药多糖也具有发展为佐剂的潜能。由于中药来源和种类广泛,中药多糖的种类也很繁多,每种中药多糖具有独特的免疫作用。总的来说,中药多糖可增强细胞因子的表达、CD4+和CD8+T 细胞的活化以及NK 细胞的活性,从而产生强大的免疫调节作用并促进人体的体液免疫功能。科学家们对黄芪多糖、当归多糖、枸杞多糖、茯苓多糖、牛膝多糖、板蓝根多糖等的佐剂作用进行了大量研究,免疫效果也各有不同。黄芪多糖增强网状内皮系统吞噬细胞的吞噬作用,促进淋巴细胞转化,激活T 细胞和B 细胞,并能促进抗体形成,从而发挥免疫调节作用,并且可以增强递呈口蹄疫病毒、禽流感病毒、乙肝病毒等多种抗原的免疫原性[36-37]。当归多糖作为新城疫病毒疫苗佐剂可提高血凝反应,在免疫后期提高抗体滴度[38]。枸杞多糖能显著增强机体神经内分泌免疫网络的调节功能[39]。枸杞多糖脂质体可诱导DCs 的成熟,诱导其活化,促进抗原特异性体液免疫应答,导致Th1 和Th2 细胞因子水平升高。枸杞多糖脂质体还可促进TLR4、MyD88、TRAF6、NF-κB 基因表达[40]。茯苓多糖作为流感疫苗佐剂免疫效果强烈。在攻毒实验中,茯苓多糖能提高小鼠流感病毒的致死剂量,提高了灭活流感疫苗的免疫效果[41]。多种中药多糖可以合理配伍制备成复合成多糖佐剂配方(CPS),从而引起更加广泛且强大的免疫应答。何云富等[42]以对猪O 型口蹄疫病毒(FMDV)灭活抗原具有佐剂效应的黄芪多糖、人参多糖、木蟞子多糖、茯苓多糖和云芝多糖5 种多糖为佐剂成分制备成CPS,免疫后虽然CPS 不能刺激抗体分泌,但能显著提高血清中IL-2、TNF-α、IFN-γ 的分泌,进一步扩大Th1应答效应,使机体发挥更有力的细胞免疫。
6 总结
作为佐剂,多糖无毒且副作用少。由于分子量相对较大、能与免疫细胞表面受体识别结合等特点,易作为抗原被多种免疫细胞识别,从而激发多种免疫机制。许多多糖还能够引起黏膜免疫应答,这为通过黏膜部位感染机体病原体疫苗的研究提供了新的策略和思路。多糖与其他免疫佐剂制成复合佐剂产生协同效应从而引发更加强烈全面免疫效果,也已逐步成为热点研究方向。由于多糖本身的多样化,每种多糖引起的免疫应答的机制并不清晰,需要进一步探索。且其生产质量控制也面临巨大挑战,需要制定更加详细严格的质量标准。这些将成为促进多糖疫苗佐剂的临床开发和商品化进程的关键。
——谷物β-葡聚糖的最新研究进展

