miR-95-5p 介导SATB1-Wnt 信号通路抑制非小细胞肺癌细胞活力和侵袭能力①
姚平波 刘雨露 朱子贵 赵 红 张建新(长沙民政职业技术学院,长沙 410004)
肺癌是最常见的致死癌症种类之一,全球每年大约新增140万肺癌新病例[1-2]。两种主要的肺癌亚型是小细胞肺癌(small cell lung cancer,SCLC)和非小细胞肺癌(non-small cell lung cancer,NSCLC),二者比例分别为15%~20%和80%~85%[3]。尽管随着医学研究的发展,NSCLC 的发生率在不断减少,但其引起的病死率仍然很高,这可能与早期的快速转移有关[4-6]。因此,寻找新的靶标和预后的生物标志物具有深远的意义。microRNA(miRNA)是小的非编码RNA 分子,通过互补碱基配对调节转录后蛋白质的表达[7]。miRNA通过多种信号通路参与肿瘤的形成、侵袭、迁移和转移,揭示了其作为癌症治疗靶点的作用[8-9]。随着基因测序技术的发展,miRNA 在肺癌组织和癌旁组织中的表达已经被检测[10]。研究发现miR-95-5p 参软骨形成、败血症等多种疾病,但miR-95-5p 在肺癌中功能的相关研究较少[11-12]。这项研究的目的是研究miR-95-5p 在NSCLC 中的表达水平及其作为肺癌治疗靶标的潜力。本研究对患者的原发性肺癌组织及细胞系进行了分析。以及揭示了miR-95-5p 对抑制癌细胞增殖和侵袭的治疗作用,并进一步确定了其靶基因SATB1和下游途径。
1 材料与方法
1.1 材料
1.1.1 主要试剂与仪器 正常肺细胞系HBE 和NSCLC 细胞系SPC-A1、H460、H1650和A549购自美国典型培养物保藏中心。RPMI1640 培养基、胎牛血清、青霉素和链霉素双抗溶液购自上海慧颖生物科技有限公司;miR-NC、miR-95-5p mimic、pc-NC、pc-SATB1 质粒及各种引物的设计与合成由今唯智生物公司完成;Lipofectamine2000转染试剂购自上海恪敏生物科技有限公司;BCA 试剂盒、cDNA 逆转录试剂盒购自广州市智取生物科技有限公司;SYBRGreen PCR 试剂盒购自上海天筛科技有限公司;双荧光素酶报告基因检测试剂盒购自上海碧云天生物技术有限公司;辣根过氧化物酶标记的山羊抗兔二抗、SATB1 兔来源的单克隆抗体购自上海艾博抗生物科技有限公司。Gel Doc XR+凝胶成像系统购自美国伯乐公司;CytoFLEX 流式细胞仪购自美国贝克曼库尔特公司。
1.1.2 组织来源 南华大学附属南华医院进行手术时收集68 例NSCLC 患者肿瘤组织及肿瘤相邻的正常组织,所有患者均签署了有关临床数据的书面知情同意书。该研究根据《赫尔辛基宣言》的道德准则进行,并获得南华大学附属南华医院伦理委员会批准。
1.2 方法
1.2.1 细胞及培养 正常肺细胞系HBE 和NSCLC细胞系SPC-A1、H460、H1650 和A549 所有细胞培养在37℃、5%CO2条件下,体积分数为10%的胎牛血清、100 U/ml的青霉素和100µg/ml的链霉素的RPMI-1640培养基中。
1.2.2 RT-qPCR 检 测miR-95-5p 与SATB1 mRNA的表达 将收集的组织样品剪碎并研磨,用QIAzol裂解试剂提取总RNA,并用cDNA 逆转录试剂盒合成cDNA。将各细胞分别接种在6孔板中,当细胞达到近85%融合时,用QIAzol裂解试剂提取了总RNA,再通过cDNA 逆转录试剂盒合成cDNA,并按照SYBR-Green PCR 试剂盒说明书操作进行RT-qPCR测定。反应条件为:52℃2 min、95℃10 min、96℃15 s 和60℃1 min 的40 个循环,用U6 标准化,使用2-ΔΔCt方法计算。miR-95-5p 的正向引物序列:5'-GTGCCTGTTGCGTCTC-3',反向引物序列:5'-GAAAGCCTAGCCGTATTCG-3';SATB1 的正向引物序列:5'-GATGGGGTCAGATGGAGAGA-3',反向引物序列:5'-GAGACACCCTGGCATTGTTT-3';U6 的正向引物序列:5'-GACCGAGTGTAGCAAGG-3',反向引物序列:5'-GTTCTTCCGAGAACATATAC-3'。
1.2.3 细胞转染 将培养至对数期的各细胞接种于6孔板,每孔约1×106个细胞,在37℃、5%CO2的条件下培养。当达到85% 融合,根据Lipofectamine 2000 说明书将100 nmol/L 的miR-NC、miR-95-5p mimic、pc-NC、pc-SATB1 质粒分别或联合转染至H1650或A549细胞。
1.2.4 CCK-8 试剂盒检测细胞增殖 将处理后的H1650 和A549 细胞接种至96 孔板(1×105个/孔)中,然后分别培养0 h、24 h、48 h和72 h。使用细胞计数试剂盒-8(CCK-8)试剂盒(Dojindo)来检测细胞增殖能力,然后将CCK-8和培养基以1∶10的比例混合以制备混合溶液。丢弃先前使用的培养基,并在远离光的37℃下添加110 µl 的混合培养基再孵育1 h。最终,通过ELISA 检查450 nm 处的OD 值,并且在每组中设置6个重复孔。
1.2.5 Transwell 实验检测细胞侵袭 将Transwell小室置于24 孔板上方。先用胰蛋白酶消化,然后将转染的H1650 和A549 细胞悬浮在无血清培养基中,用细胞计数板计数。将细胞用无血清培养基稀释,将其密度调整为1×105个/ml,并向该室中添加上述细胞悬液。然后在培养箱中向无菌24 孔板中的细胞添加含10%FBS 的培养基。48 h 后,弃去培养基,然后用PBS 洗涤,取出Transwell 小室并用4%多聚甲醛固定30 min。加入0.5%的结晶紫染色10~15 min 后,用PBS 冲洗染色剂。最后,使用显微镜进行细胞的观察和计数。
1.2.6 双荧光素酶报告检测miR-95-5p 和SATB1靶向关系 将SATB1 转录物的3'UTR 的序列克隆到含有荧光素酶报告基因作为WT 3'UTR 基团的载体pGL3 中。使用定点诱变试剂盒将3'UTR 上的miRNA 的关键结合区突变为无效的结合序列,以形成控制质粒MUT 3'UTR 组。每组均转染miR-95-5p模拟物和海肾荧光素酶质粒。转染24 h 后,将细胞培养液完全吸出。根据试剂盒的要求,加入适量的裂解液以完全裂解细胞。离心后,收获100µl 裂解物的上清液用于测定。用萤火虫荧光素酶测定的RLU 值除以海肾荧光素酶测定的RLU 值(以萤火虫荧光素酶为内参)。根据获得的比率,比较不同样品靶报道基因的激活程度。
1.2.7 Western blot 检测SATB1 蛋白相对表达水平 通过在12 000 g和4℃下离心20 min,提取总蛋白,并通过BCA 蛋白测定试剂盒(Beyotime)评估其浓度。然后,在10%SDS-PAGE 中分离出相同量的总蛋白,并转移到硝酸纤维素膜上,然后用5%脱脂奶粉在含0.5%Tween-20 的TBS 中密封1 h。之后,加入一抗(SATB1 1∶1 000、GAPDH 1∶1 000、β-catenin 1∶5 000、β-actin 1∶1 000)以在4℃下孵育过夜,然后漂洗蛋白质并与二抗在室温下孵育2 h,加显影液,于Gel Doc XR+凝胶成像系统中曝光,使用软件ImagePro plus6.0分析蛋白条带,蛋白的相对表达水平为目标蛋白积分吸光度值与内参蛋白GAPDH 积分吸光度值比值。
1.3 统计学分析 所有统计数据通过SPSS19.0分析,图形采用GraphPad Prism 6.0 构建。实验数据以表示,数据经Shapiro-Wilk 检验发现均呈正态分布,多组比较进行One-Way ANOVA 分析,两组比较使用SNK检验,P<0.05为差异有统计学意义。
2 结果
2.1 miR-95-5p 在NSCLC 中的表达情况 为了评估miR-95-5p 在NSCLC 中的表达水平,检测了癌组织和癌旁正常组织、肺癌细胞和正常细胞中miR-95-5p 表达水平。与癌旁正常组织比较,miR-95-5p在肺癌组织中表达下调(图1A,P<0.01);与正常肺癌细胞HBE 相比,NSCLC 细胞SPC-A1、H460、H1650 和A549 中miR-95-5p 表达下调(图1B,P<0.01)。上述结果显示,A549 和H1650 细胞中miR-95-5p 表达较低,故选择A549 和H1650 细胞进行后续试验。为了验证miR-95-5p 表达对NSCLC A549和H1650 细胞生物学行为的影响,本课题组对细胞进行了分组转染。与miR-NC 组相比,miR-95-5p mimic 组NSCLC A549 和H1650 细胞miR-95-5p 表达上调(图1C,P<0.01),表明转染成功,可进行后续试验。
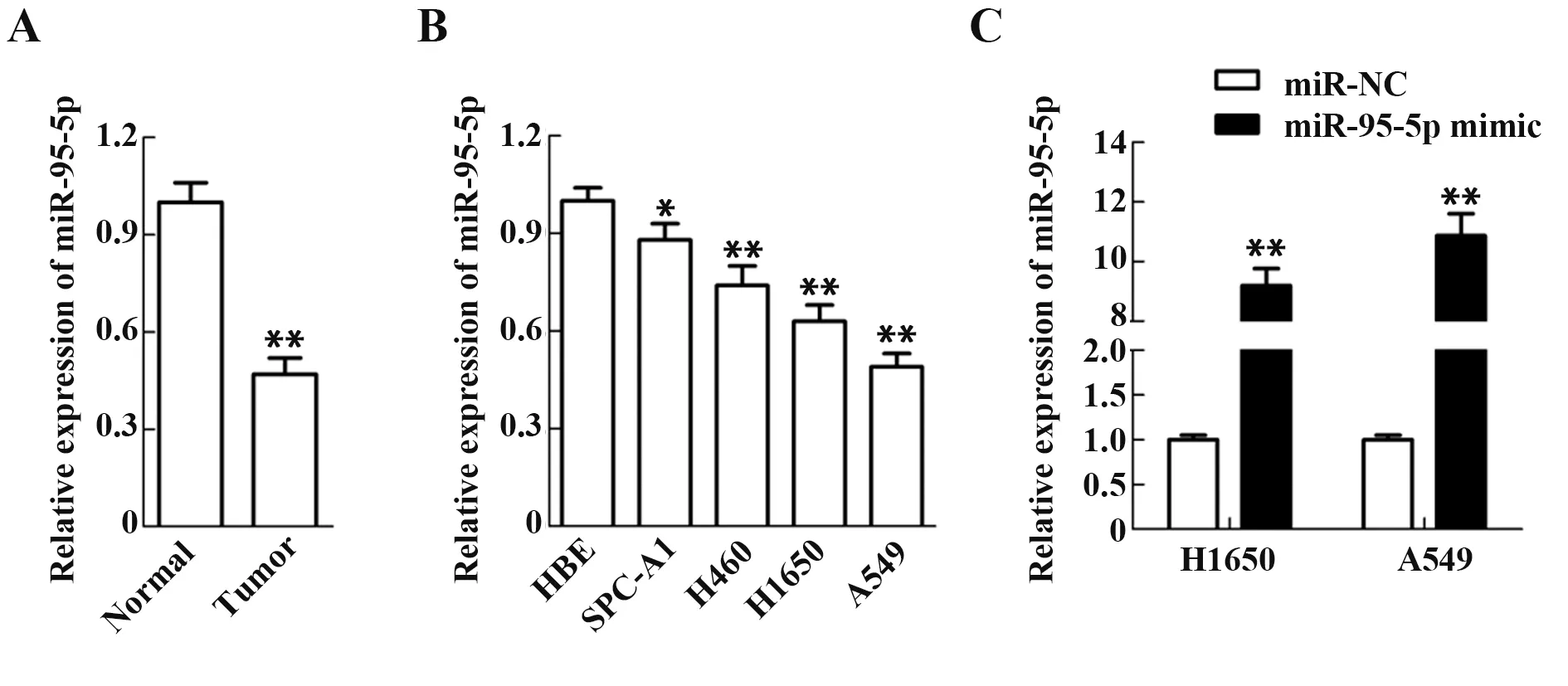
图1 RT-qPCR检测miR-95-5p mRNA 的表达水平Fig.1 miR-95-5p mRNA expression level detected by RT-qPCR
2.2 miR-95-5p 抑制A549 和H1650 细胞增殖和侵袭 为了评估miR-95-5p 过表达对NSCLC A549 和H1650 细胞增殖和侵袭的影响,运用CCK-8 试剂盒检测了各组细胞的增殖能力,运用Transwell 实验检测了各组细胞的侵袭能力。与miR-NC 组相比,miR-95-5p mimic 组NSCLC A549 和H1650 细胞增殖能力受到明显抑制(图2A,P<0.01)。与miR-NC 组相比,miR-95-5p mimic 组NSCLC A549 和H1650 细胞侵袭能力也受到明显抑制(图2B,P<0.01)。以上结果表明,miR-95-5p 抑制NSCLC A549 和H1650 细胞增殖和侵袭。

图2 miR-95-5p 对A549 和H1650 细胞增殖和侵袭能力的影响Fig.2 Effects of miR-95-5p on proliferation and invasion of A549 and H1650 cells
2.3 miR-95-5p 与SATB1 存在靶向关系 为了评估miR-95-5p 对H1650 和A549 细胞增殖和侵袭抑制相关机制,研究了miR-95-5p 与SATB1 在非小细胞肺癌中的相关性。TargetScan 数据库的预测结果显示,miR-95-5p 与SATB1 3'UTR 区存在结合位点(图3A)。为了进一步确认二者关系,通过双荧光素酶报告基因实验验证二者靶向关系。结果显示在含有野生型SATB1 质粒细胞中,miR-95-5p 高表达显著抑制荧光素酶活性(P<0.01,图3B),但在含有突变型SATB1 质粒细胞中,miR-95-5p 高表达对荧光素酶活性并无影响。Western blot 评估SATB1 表达结果如图3C 所示,与miR-NC 组细胞相比,miR-95-5p组细胞中SATB1表达水平显著下降;RT-qPCR评估SATB1 表达结果如图3D 所示,与miR-NC 组细胞相比,miR-95-5p 组细胞中SATB1 明显下降(P<0.01)。以上结果表明miR-95-5p 与SATB1 存在良好的靶向关系。
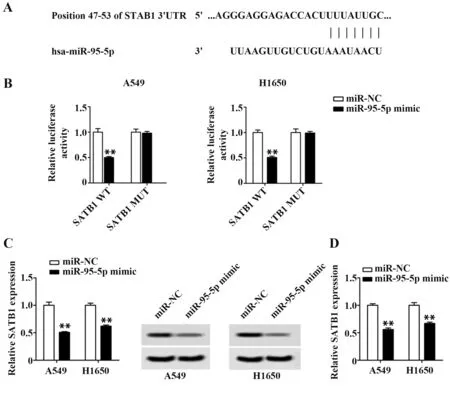
图3 miR-95-5p与SATB1靶向关系Fig.3 Targeting relationship of miR-95-5p and SATB1
2.4 SATB1对A549和H1650细胞增殖和侵袭的影响 由于SATB1 是miR-95-5p 的靶基因,因此检查了SATB1 在肺癌患者组织中的表达。结果表明,癌组织中的SATB1 表达明显高于正常组织(P<0.01,图4A)。用SATB1 过表达质粒转染A549 和H1650细胞后,SATB1 表达显著升高(P<0.01,图4B)。CCK-8 和Transwell 分析的结果表明,SATB1 表达的上调显著促进了肺癌A549 和H1650 细胞的增殖和侵袭能力(P<0.01,图4C、D)。
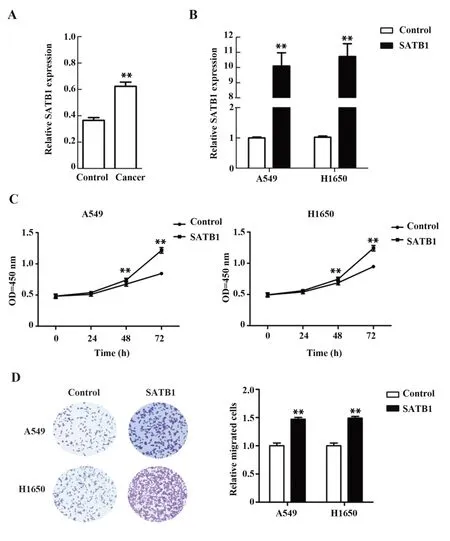
图4 SATB1可促进A549和H1650细胞增殖和侵袭Fig.4 SATB1 can promote proliferation and invasion of A549 and H1650 cells
2.5 miR-95-5p 通过抑制SATB1 表达发挥增殖和侵袭抑制作用 如图5A 所示,SATB1 在A549 和H1650 细胞中过表达后,β-catenin 表达水平显著升高。如图5B 所示,升高的miR-95-5p 抑制了βcatenin 表达,但升高的SATB1 使其部分恢复。为了探讨miR-95-5p 是否通过降低SATB1 发挥作用,开展了实验。实验结果证实,miR-95-5p 表达增加后,A549 和H1650 细胞的增殖能力和侵袭能力显著降低。然而,miR-95-5p和SATB1的表达均升高后,细胞的增殖能力和侵袭能力有所升高(图5C、D)。这表明miR-95-5p 可降低SATB1 的表达并通过其靶基因SATB1 抑制Wnt/β-catenin 信号通路的激活进而抑制A549和H1650细胞的增殖和侵袭能力。
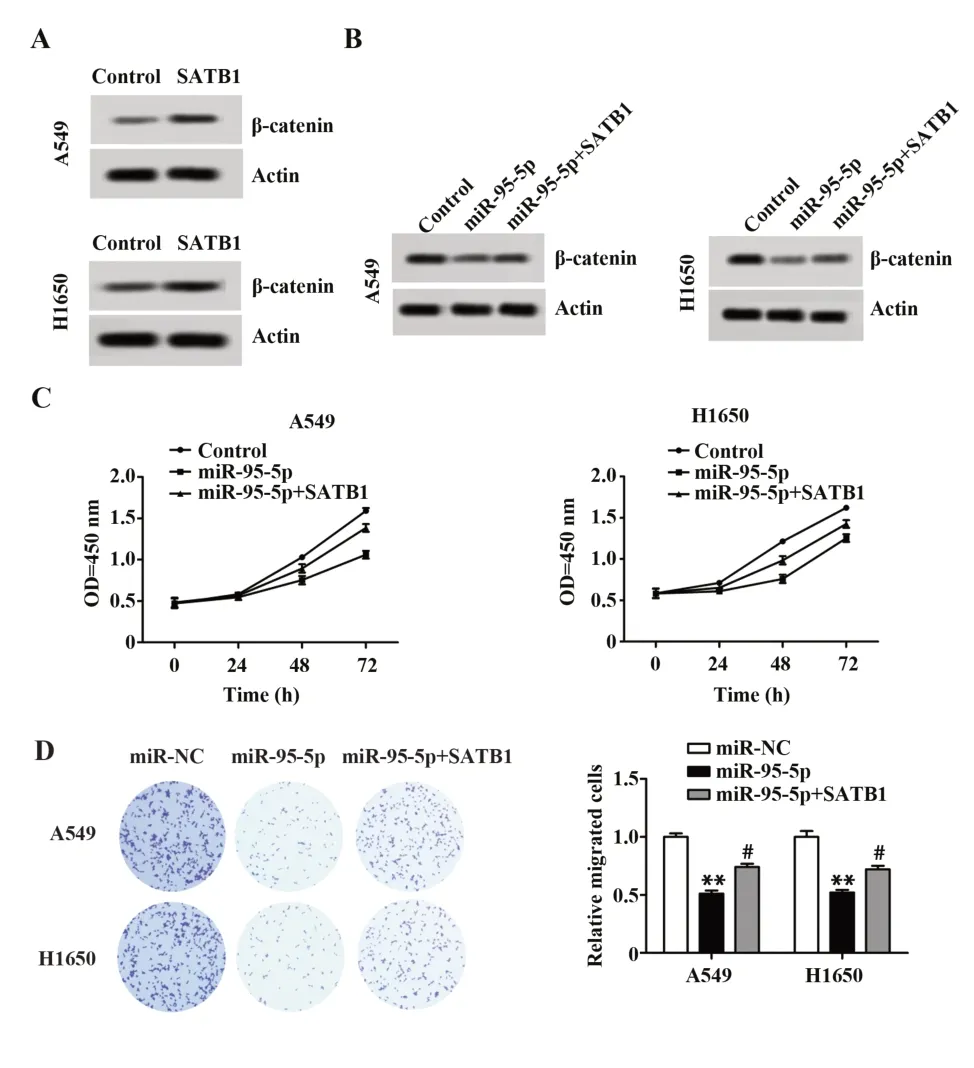
图5 miR-95-5p 通过抑制SATB1 表达发挥增殖和侵袭抑制作用Fig.5 miR-95-5p exerts proliferation and invasion inhibitory effects by inhibiting expression of SATB1
3 讨论
目前NSCLC 治疗最有前途的方法是手术切除和化疗,尽管近年来医疗水平有很大的进步,但NSCLC 治疗的耐药性仍是治疗的障碍之一[13]。因此,急需深入了解NSCLC致病机制并寻找NSCLC发病和发展的重要分子生物学标志。
miRNA 是用于癌症的先进分子诊断和靶向分子治疗的出色工具[14]。最初认识到miRNA 在肿瘤发生中的作用是研究人员发现miRNA 基因在白血病患者中被特异性删除[15]。多项研究表明miRNA与肿瘤的侵袭性和转移潜力有关,被认为是包括肺癌在内的多种癌症的诊断和预后标志物[16-17]。例如,miR-449、miR-141 等在NSCLC 中发挥抑癌作用,miR-155、miR-19b 等在NSCLC 中发挥致癌作用[1]。研究发现miR-95-5p参与败血症、软骨形成等疾病,但其在肿瘤中的报道相对较少。在本研究中,NSCLC组织和细胞SPC-A1、H460、H1650 和A549 中miR-95-5p 表达下调,推 测miR-95-5p 在NSCLC 中发挥抑癌作用。癌细胞的快速增殖能力和较强的侵袭能力是癌症发生发展的重要推动因素[18]。因此控制肿瘤细胞的增殖和侵袭情况对癌症的治疗至关重要。本研究发现,miR-95-5p 过表达明显抑制A549 和H1650 细胞增殖和侵袭,可见miR-95-5p在NSCLC中起抑癌作用。
为了进一步揭示miR-95-5p 的潜在作用机制,进行了生物信息学分析。使用TargetScan 数据库预测miR-95-5p 的靶基因,发现miR-95-5p 与SATB1 3'UTR 区存在结合位点,并通过双荧光素酶报告实验发现在含有野生型SATB1质粒细胞中,miR-95-5p高表达显著抑制荧光素酶活性,但在含有突变型SATB1质粒细胞中,miR-95-5p高表达对荧光素酶活性并无影响,结果表明SATB1 是miR-95-5p 潜在的靶标基因。SATB1 是一种核基质相关蛋白,通过染色质重塑机制起作用来调节多个基因的表达[19]。SATB1 与Wnt-β-catenin 途径相互作用,并且还与许多类型的癌症相关[20-21]。已知Wnt/β-catenin 信号传导通过调节多功能β-catenin 蛋白的能力来调节众多细胞过程,包括增殖、侵袭和分化,而β-catenin 蛋白质是Wnt/β-catenin途径中的重要信号分子[22-23]。
在本研究中,评估了SATB1 在肺癌中的表达,结果表明SATB1 在肺癌组织中高表达,并且与miR-95-5p表达呈反向。在A549和H1650细胞中,SATB1可能上调β-catenin 的表达,从而激活Wnt/β-catenin信号通路。同时,miR-191-5p 可以降低β-catenin 表达,而SATB1 的上调可以挽救这种效应。功能实验表明,上调SATB1 可以部分改善miR-95-5p 对细胞增殖和侵袭的抑制作用。综上所述,推测miR-95-5p可能会抑制SATB1表达,然后部分抑制Wnt/β-catenin信号通路的激活,从而抑制A549和H1650细胞增殖和侵袭能力。
综上所述,miR-95-5p 过表达靶向SATB1 抑制Wnt/β-catenin 信号通路的激活进而抑制NSCLC 细胞H1650 和A549 的增殖及侵袭,因此miR-95-5p 和SATB1 有望成为NSCLC 的治疗靶点。本实验仅为体外细胞实验,有待进一步研究动物体内实验及相关的分子信号通路。

