外源性胰岛素诱发胰岛素自身免疫综合征1例报道并文献复习
吕川,孙媛媛,焦悦,于轶楠,梁丽
(中国医科大学人民医院,辽宁省人民医院内分泌科,沈阳 110016)
胰岛素自身免疫综合征(insulin autoimmune syndrome,IAS)是指在未接受过胰岛素治疗的情况下反复出现严重的自发性低血糖,血中免疫活性胰岛素水平升高,胰岛素自身抗体(insulin autoantibody,IAA)阳性。糖尿病患者应用外源性胰岛素后也可发生 IAS,称为外源性胰岛素自身免疫综合征(exogenous insulin autoimmune syndrome,EIAS),是一种罕见的变态反应[1]。本文报道了我院收治的1例优泌乐50诱发的EIAS患者的临床资料和诊治过程。
1 临床资料
患者女性,72岁,2020年2月无诱因出现多尿、口干和多饮,周身乏力,于外院就诊。行100 g馒头餐葡萄糖耐量试验,空腹血糖14.4 mmol/L(参考值:3.9~6.0 mmol/L),餐 后2 h血 糖24.41 mmol/L(参 考值:3.90~7.80 mmol/L),空腹C肽4.88 mU/L(参考值:0.20~4.00 mU/L),餐后2 h C肽6.51 mU/L,血浆糖化血红蛋白(glycosylated hemoglobin,HbA1c) 11.70%(参考值:4.00%~6.00%),血清甘油三酯3.45 mmol/L(参考值:0.30~1.80 mmol/L)。血管彩色多普勒超声示双颈总动脉、左侧颈内动脉粥样硬化斑块形成,软斑块形成。计算机体层摄影血管造影检查示冠状动脉左前降支近段管腔轻中度狭窄(约40%~50%)。予二甲双胍口服0.5 g,3次/d,优泌乐50皮下注射,早16 U、晚12 U,阿托伐他汀钙片口服20 mg,1次/d,拜阿司匹林口服100 mg,1次/d。
2020年8月15日开始,患者反复出现夜间心悸、出汗和饥饿感,即时末梢血糖最低2.2 mmol/L,进食含糖食物后好转。患者自行先后停用胰岛素和口服降糖药物,病情无好转,于2020年8月31日来我科就诊。患者主诉既往病史:高血压5年,血压最高200/90 mmHg,应用苯磺酸左旋氨氯地平2.5 mg,1次/d,缬沙坦80 mg,1次/d,血压控制在125/75 mmHg左右;冠状动脉粥样硬化性心脏病5年,未治疗;2009年因右侧乳腺纤维瘤行右侧乳腺切除术;2015年12月因子宫肌瘤行子宫全切术;否认其他慢性疾病史,否认特殊用药史(如巯基类药物、青霉胺、卡托普利、氯吡格雷等),否认糖尿病、高血压、低血糖家族史。入院查体:体温 36.7℃,心率80次/min,呼吸15次/min,血压125/80 mmHg,身高1.5 m,体质量75 kg,腰围108 cm,体质量指数33.3 kg/m2。患者神清语明,甲状腺未触及,无颈部脂肪垫,皮肤无紫纹,心、肺及腹部无异常,双下肢无浮肿。辅助检查:入院第2天凌晨2点再次发作心悸、出汗,即时静脉血糖2.8 mmol/L(参考值3.9~6.1 mmol/L),胰岛素212.31 mU/L(参考值:3.00~25.00 mU/L),C肽6.80 ng/mL(参考值:0.81~3.85 ng/mL),提示患者低血糖与血清高浓度胰岛素有关。动态血糖监测示血糖波动在2.8~21.0 mmol/L,低血糖多发生在夜间(图1)。血细胞分析、凝血功能、尿及便常规、肝肾功能、血电解质、心肌酶均正常。心电图示窦性心律,心率68次/min,V2~V6导联轻度ST压低,ST-T异常。HbA1c 7.6%。糖耐量、胰岛素和C肽释放试验结果(表1)示血清空腹胰岛素浓度258.92 mU/L(参考值:3.00~25.00 mU/L),进餐1 h后血清胰岛素浓度升高至300 mU/L以上,血清空腹C肽浓度升高至8.27 ng/mL(参考值:0.81~3.85 ng/mL),进餐1 h后C肽浓度升高至10.57 ng/mL,血清C肽和胰岛素浓度升高不平行。血清IAA>400.00 RU/mL(参考值:0.00~20.00 RU/mL),抗胰岛细胞抗体(-),抗谷氨酸脱羧酶抗体(-),考虑患者为胰岛素自身抗体所致低血糖。进一步行胰腺核磁共振增强扫描示脂肪肝,除外胰腺疾病所致低血糖。风湿四项检测示C反应蛋白 7.9 mg/L(参考值:0.0~3.0 mg/L),甲状腺抗体两项、抗核抗体谱15项、抗胃壁细胞抗体均无异常,除外其他自身免疫性疾病。血浆促肾上腺皮质激素、血清皮质醇、血清游离三碘甲状腺原氨酸、游离甲状腺素、促甲状腺激素和血清生长激素均正常,除外胰岛素拮抗激素缺乏所致低血糖。血清肿瘤标志物(癌胚抗原、甲胎蛋白、糖类抗原125、糖类抗原19-9)无异常,除外恶性肿瘤所致低血糖。人类白细胞抗原(human leukocyte antigen,HLA)分型:DRB1*08:03与12:01,DQA1*01:03与01:03,DQB1*03:01与03:01。结合病史和实验室检查,诊断为EIAS、代谢综合征(肥胖症、2型糖尿病、高血压3级、脂肪肝)和冠状动脉粥样硬化性心脏病。予高纤维、高蛋白、低碳水化合物膳食,每日睡前加餐,7 d后低血糖症状消失。遂给予磷酸西格列汀口服100 mg,1次/d。患者留院观察5 d未发生低血糖,于2020年9月13日出院。
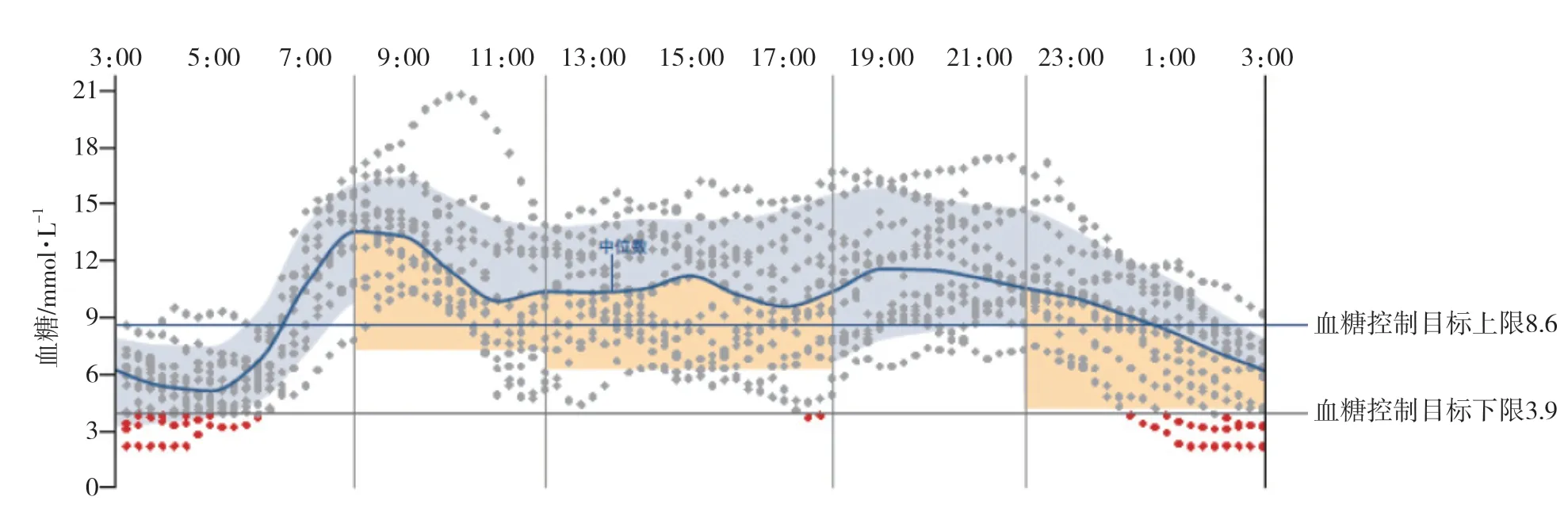
图1 入院动态血糖监测结果

表1 入院糖耐量、胰岛素和C肽释放试验结果
2020年12月9日,患者出院3个月随访。无心悸、出汗症状,体质量、腰围无变化。实验室检查示空腹胰岛素164.33 mU/L(参考值:3.00~25.00 mU/L),C肽6.60 ng/mL(参考值:0.81~3.85 ng/mL),血清IAA下降至165.04 RU/mL(参考值:0.00~20.00 RU/mL),HbA1c 7.20%(参考值:4.00%~6.00%)。动态血糖监测3 d,患者血糖>7.8 mmol/L(图2),改用利拉鲁肽注射液皮下注射0.6 mg,1次/d,治疗当天高血糖即得到控制,且血糖波动幅度显著降低(图2)。
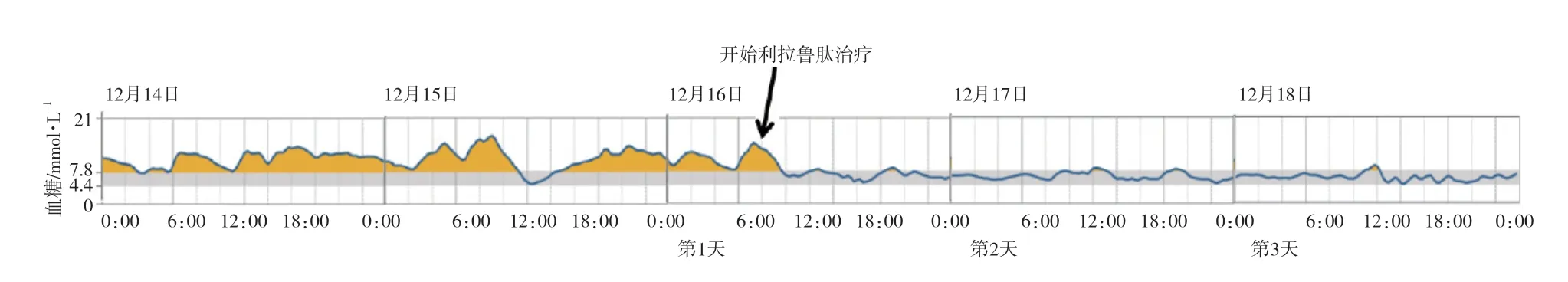
图2 利拉鲁肽注射液治疗前后动态血糖监测结果
继续随访4个月,未发生低血糖事件,腰围103 cm,体质量指数29.97 kg/m2。HbA1c 6.2%(参考值:4.0%~6.0%),延长糖耐量和胰岛素释放试验示血清胰岛素水平进一步下降(表2),血清IAA下降至34.08 RU/mL(参考值:0.00~20.00 RU/mL)。

表2 出院后3个月随访时延长糖耐量、胰岛素和C肽释放试验结果
2 讨论
IAS又称平田病,由日本学者HIRATA于1970年首次报道,是引起自发性低血糖的重要原因。IAS发病年龄分布不均,无明显性别差异[2]。IAS在日本报道较多,西方国家少见。其与伴发自身免疫性疾病或应用含巯基类药物有关,包括甲巯咪唑、α-硫辛酸、格列齐特、谷胱甘肽、卡托普利、青霉胺、质子泵抑制剂等[3]。EIAS是指外源性胰岛素作为具有免疫活性抗原,诱发机体产生IAA,血清免疫活性胰岛素浓度升高,导致反复发作的自发性低血糖。综合既往相关资料,几乎所有类型的胰岛素均可使糖尿病患者发生EIAS[1,4-5]。使用胰岛素和反复低血糖出现的时间间隔无规律,短则数天,长者可达9年[1]。由于胰岛素的低血糖不良反应,糖尿病患者发生EIAS易被漏诊或误诊。
糖尿病患者在胰岛素治疗期间反复出现低血糖,应考虑发生EIAS的可能。若血清胰岛素浓度显著升高,且呈胰岛素、C肽分离现象,IAA阳性,在排除药物、肿瘤、胰岛素拮抗激素缺乏、自身免疫性疾病等其他原因所致低血糖后可确定诊断。其中,IAS、胰岛素瘤、B型胰岛素抵抗综合征为主要鉴别疾病。经典的IAS和EIAS患者血清IAA滴度均升高,但EIAS有明确外源性胰岛素治疗史,无巯基类药物用药史。胰岛素瘤患者低血糖多于空腹时或夜间出现,胰岛素升高幅度一般不超过正常值的10倍,明显小于EIAS,且胰岛素和C肽浓度的升高基本平行,IAA为阴性[4,6]。B超、计算机体层摄影、核磁共振等影像学检查常可帮助胰岛素瘤定位诊断。B型胰岛素抵抗综合征多见于女性,表现为严重的胰岛素抵抗,高血糖治疗所需胰岛素剂量极高。低血糖常发生在空腹时,进食后症状缓解。患者表现为黑棘皮、雄激素过多症,常合并其他自身免疫性疾病。血清胰岛素受体抗体可能阳性,但胰岛素自身抗体为阴性[7]。
本例患者使用优泌乐50皮下注射治疗6个月后,反复于夜间出现心悸、出汗和饥饿感。停用所有降糖药物后,症状仍反复发作。胰岛素和C肽释放试验显示血清胰岛素浓度显著升高,血清胰岛素和C肽浓度呈分离现象,且IAA阳性。同时,患者未曾使用上述可导致IAS的药物。此外,除IAA阳性外,患者其他自身免疫性抗体如甲状腺抗体、抗核抗体谱、抗胃壁细胞抗体等均为阴性。进一步排除胰岛素瘤、肝肾疾病和其他内分泌疾病后,诊断为EIAS。研究[8]报道,使用外源性胰岛素治疗的糖尿病患者IAA阳性比例高达40.7%,但极少诱发EIAS。表明外源性胰岛素诱发EIAS可能是多种因素共同作用的结果,如胰岛素种类和纯度、种族、遗传易感性、环境因素等。日本、欧洲人群IAS与HLA Ⅱ类分子DRB1*0406、DQA1*0301和DQB1*0302等位基因有关[9]。国内IAS病例较少进行基因检测,未见EIAS病例的HLA分型报道[10]。对本例患者进行HLA分型,未发现上述研究报道的易感基因。我国EIAS患者易感基因亟需多中心临床研究进一步明确。
IAS为自限性疾病,预后良好。多数患者在停用胰岛素或更换胰岛素剂型后,通过调整饮食结构,低碳水化合物、高纤维和高蛋白饮食,并少食多餐,低血糖症状可逐渐缓解。部分低血糖难以纠正的患者需应用糖皮质激素、利妥昔单抗等免疫治疗或血浆置换[2,11-12]。有证据表明,糖苷酶抑制剂、二肽激肽酶抑制剂有利于EIAS患者血糖控制,且不增加低血糖风险[4]。本例患者停用胰岛素,调整生活方式,改用磷酸西格列汀口服,随访3个月期间无低血糖发作,血IAA、胰岛素水平明显下降,但血糖控制不达标。本例患者体型肥胖,且合并冠状动脉粥样硬化性心脏病,给予利拉鲁肽注射液降糖治疗。随访4个月,患者血糖平稳达标,未发生低血糖。本例患者的诊治经验表明,2型糖尿病患者发生EIAS时,胰高血糖素样肽1受体激动剂可有效改善患者高血糖,减少血糖波动,且不增加低血糖发生风险。
总之,外源性胰岛素诱发IAS无时间规律,低血糖易被误认为是胰岛素自身的降糖作用所致。糖尿病患者在应用胰岛素治疗过程中,若频繁发生自发性低血糖或出现血糖波动较大时,应警惕发生EIAS的可能。EIAS患者治疗方案应个体化,需综合考虑患者低血糖严重程度、血糖升高程度、合并症等因素。

