乳腺癌细胞外泌体miR-27a对巨噬细胞极化及肿瘤生长和转移的影响
袁泳锨 庾建中 王永霞
乳腺癌是造成女性癌症死亡的第二大病因,虽然乳腺癌治疗效果取得了突破,但术后和化疗后肿瘤复发和肿瘤转移一直存在[1-3]。有研究表明,乳腺癌的发展与肿瘤微环境中免疫细胞相关[4],其中巨噬细胞是肿瘤微环境中的免疫细胞之一,具有M1和M2两种类型,其中M2型巨噬细胞可诱导肿瘤的生长和转移[5]。肿瘤外泌体是肿瘤细胞分泌的一类纳米级囊泡,可调控肿瘤微环境中的血管新生、巨噬细胞极化、肿瘤相关成纤维细胞转化等过程[6-7],miRNA是肿瘤外泌体中的重要组成部分[8]。有研究表明,缺氧条件下,胰腺癌外泌体miR-301a可诱导M2型巨噬细胞极化,胃癌外泌体miR-21a可诱导M2型巨噬细胞极化而促进肿瘤的化疗耐药[9-10]。研究表明,miR-27a在乳腺癌组织和乳腺癌细胞中均为高表达,影响乳腺癌的生长和转移[11]。本研究探讨乳腺癌外泌体miR-27a对巨噬细胞极化及肿瘤转移的影响。
材料与方法
一、材料
乳腺上皮细胞MCF10A,乳腺癌细胞MDA-MB-231(购自中科院上海细胞库),人单核巨噬细胞THP1(购自中科院上海细胞库),外泌体miRNA提取试剂盒(购自QIAZEN公司),Trizol试剂(购自福麦斯生物技术有限公司),The exoRNeasy serum/Plasma Maxi Kit试剂盒(购自QIAZEN公司),miRNA cDNA Sythesis Kit(购自加拿大Abm公司),EvaGreen miRNA qPCR MasterMix(购自加拿大Abm公司),CCK8试剂盒(购自沈阳万类生物技术有限公司),TSG101抗体、CD63抗体、CD9抗体(购自武汉三鹰生物技术有限公司)。
二、方法
1.细胞培养:MCF10A和MDA-MB-231细胞培养于RPMI-1640培养基中,细胞放置于含5% CO2,37 ℃细胞培养箱中,细胞生长至汇合度达80%~90%时进行细胞传代。THP1细胞于5% CO2,37 ℃条件下培养在RPMI-1640培养基中,THP1细胞与100 ng/ml的PMA共孵育诱导其极化为M0型巨噬细胞,M0型巨噬细胞与50 ng/ml IFN-γ和1 μg/ml LPS共孵育诱导分化为M1型巨噬细胞;M0型巨噬细胞与20 ng/ml IL-4和20 ng/ml IL-13共孵育诱导其分化为M2型巨噬细胞。
2.外泌体的提取与鉴定:将细胞培养基更换为含10%无外泌体胎牛血清的RPMI-1640培养基,细胞培养48小时后,收集细胞培养上清,使用差速离心法提取细胞上清中到的外泌体,具体步骤为:取细胞上清液3 000×g,4 ℃离心15分钟去除死细胞;然后将上清液6 000×g离心40分钟,去除细胞碎片;10 000×g离心1小时,取上清;100 000×g离心1小时,收集沉淀,用400 μl无菌 PBS重悬外泌体,-80 ℃条件下保存。外泌体的鉴定:于透射电镜下观察外泌体的形态结构,拍照记录;Western blot鉴定外泌体标志蛋白CD63、TSG101、CD9。
3.实时荧光定量PCR(qRT-PCR):使用Trizol试剂盒提取各组细胞RNA,使用The exoRNeasy serum/Plasma Maxi Kit试剂盒提取外泌体中miRNA,利用核酸定量仪定量后,miRNA cDNA Sythesis Kit进行miRNA的逆转录,利用EvaGreen miRNA qPCR MasterMix试剂盒进行qRT-PCR反应,利用PrimeScriptTM试剂盒合成mRNA的cDNA,PowerUpTM SYBRTM Green Master Mix 试剂盒进行qRT-PCR,使用2-ΔΔCT法计算相对表达量,引物序列如表1。
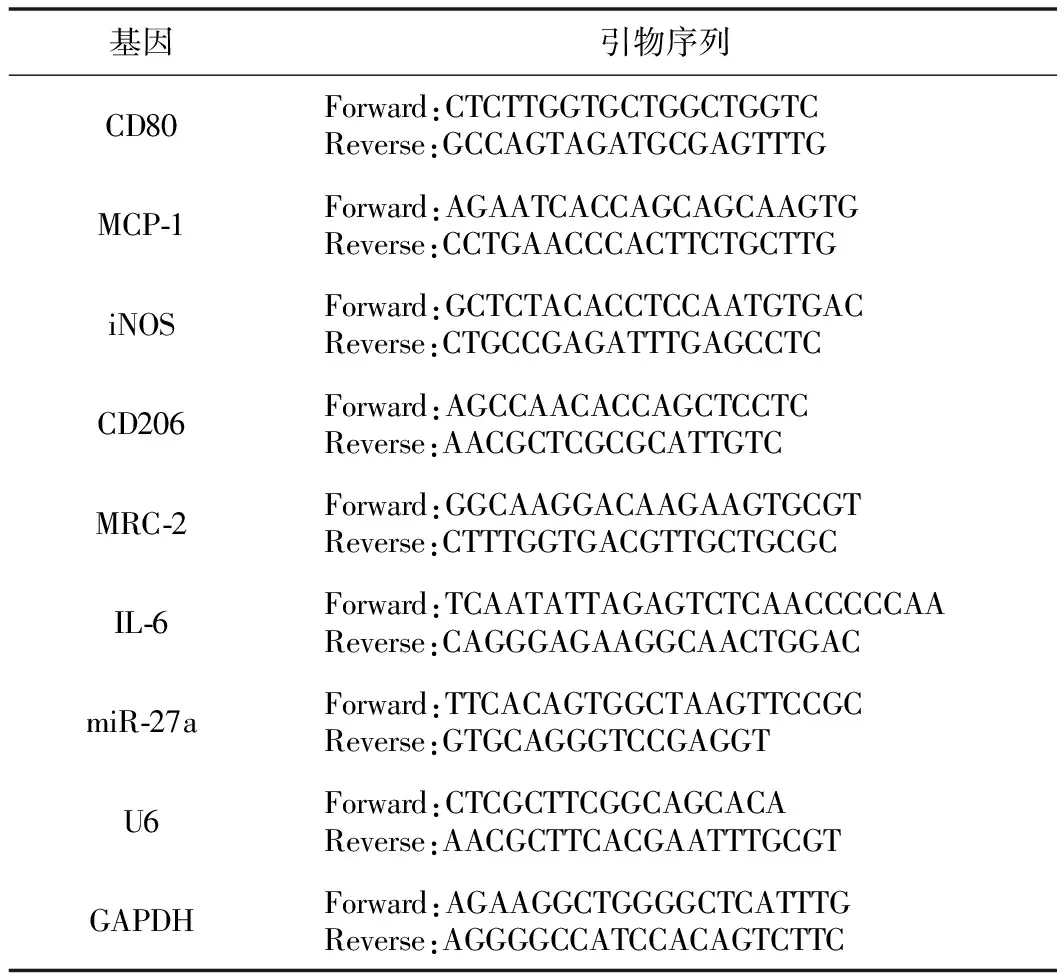
表1 各组基因引物序列
4.细胞增殖:CCK8法检测各组细胞的增殖能力,取各组细胞以每孔5×103个细胞接种于96孔板中,每孔细胞分别与10 μg/ml的各组外泌体共孵育,每组3个复孔,并设置0小时、24小时、48小时、72小时时间点对应的培养板,在细胞培养箱中培养,于对应时间点取出96孔板,每孔加入10 μl的CCK8溶液,于培养箱中孵育4小时后,使用酶标仪检测各孔450 nm处的吸光度值。
5.细胞迁移和侵袭实验:MDA-MB-231细胞用RPMI-1640细胞稀释至5×104个/ml,取200 μl细胞接种于Transwell小室中用于检测细胞迁移能力,200 μl细胞接种于铺有Matrigel胶的Transwell小室中用于检测细胞侵袭能力,每组3个复孔,小室放置于24孔板中,24孔板每孔加入600 μl含10%胎牛血清的完全培养基,并将上述24孔板转移至细胞培养箱中培养24小时,小室底部用PBS溶液清洗后用无水乙醇固定30分钟,然后小室倒扣,底部滴加结晶紫染色10分钟,清洗后晾干,于显微镜下观察拍照并计数,比较各组细胞迁移和侵袭数。
6.Western blot:使用RIPA试剂盒提取各组蛋白,BCA试剂盒蛋白定量,每组取10 μg蛋白上样,进行SDS-PAGE凝胶电泳,转膜,用5%的BSA溶液膜封闭2小时,以1∶1 000比例稀释的一抗4 ℃孵育过夜,TBST洗膜后二抗室温孵育1.5小时,再用TBST洗膜后按照ECL试剂盒说明书配置发光液,并将PVDF膜浸入发光液中反应半分钟,曝光并拍照,用Image J软件对曝光结果进行定量分析。
三、统计学分析

结果
1.miR-27a高表达于M2型巨噬细胞:使用IFN-γ和LPS共孵育诱导M0型巨噬细胞分化为M1型,IL-4和IL-13诱导M0型巨噬细胞分化为M2型,qRT-PCR检测诱导分化结果(图1)显示,诱导后M1型巨噬细胞标志蛋白CD80、MCP-1、iNOS、IL-6表达显著增加(P<0.001),IL-4 和IL-13诱导后M2型巨噬细胞标志蛋白CD206和MRC-2表达显著增加(P<0.001),说明诱导分化成功,qRT-PCR检测诱导分化后巨噬细胞miR-27a表达结果显示,相比于M0型巨噬细胞(1.00±0.00),M1型巨噬细胞中miR-27a表达(1.20±0.09)无显著变化(P>0.05),M2型巨噬细胞miR-27a表达(5.73±0.28)显著增加(P<0.001),说明miR-27a高表达的于M2型巨噬细胞。
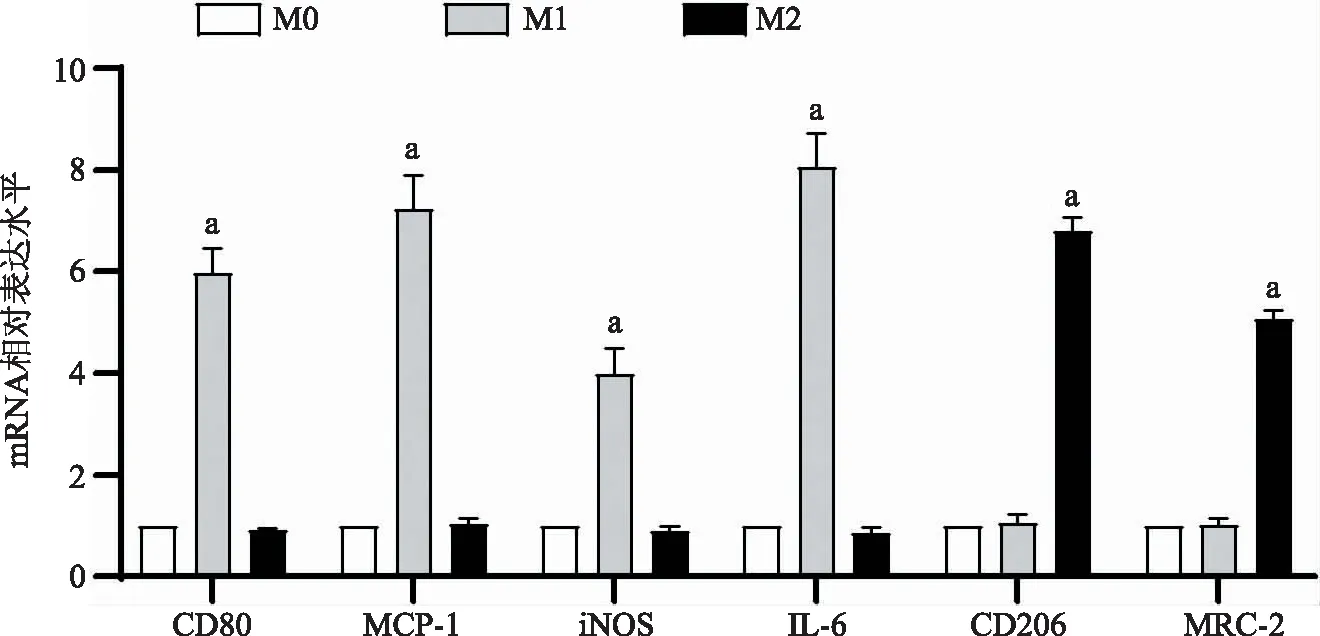
图1 qRT-PCR检测诱导后各组巨噬细胞CD80、MCP-1、iNOS、IL-6、CD206和MRC-2表达水平(相比于M0细胞,aP<0.01)
2.miR-27a可促进M2型巨噬细胞极化:在M0细胞中转染miR-27a mimic、inhibitor以及NC,然后用IL-4 和IL-13诱导,qRT-PCR检测结果显示,相比于NC组(1.00±0.00),miR-27a mimic组巨噬细胞CD206和MRC-2表达显著增加(7.48±0.65、5.96±0.72,P<0.001),miR-27a inhibitor组巨噬细胞CD206和MRC-2表达显著下调(0.23±0.05、0.16±0.06,P<0.001),说明miR-27a可显著促进M2型巨噬细胞极化。
3.miR-27a高表达于乳腺细胞外泌体:透射电镜观察外泌体形态(图2A),提取的外泌体粒径在30~100 nm之间,具有双层膜结构,形态呈“杯托”样。Western blot检测显示(图2B),所提取的外泌体表达其标志蛋白CD9、CD63、TSG101。qRT-PCR检测外泌体中miR-27a表达显示,MDA-MB-231 exo miR-27a表达(10.01±2.0)显著高于MCF10A exo(1.00±0.00)(P<0.01),说明miR-27a可高表达于乳腺癌细胞外泌体。
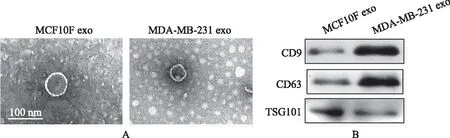
图2 透射电镜(A)和Western blot(B)鉴定外泌体结果
4.乳腺癌细胞外泌体miR-27a促进M2型巨噬细胞极化:将MCF10A exo和MDA-MB-231 exo与M0型巨噬细胞共孵育后,qRT-PCR检测结果(图3A)显示,相比于MCF10A exo组细胞,MDA-MB-231 exo组细胞M1型巨噬细胞CD80、MCP-1、iNOS、IL-6表达无显著变化,M2型巨噬细胞标志蛋白CD206和MRC-2表达显著上调(P<0.01),说明乳腺癌细胞外泌体能够促进M2型巨噬细胞极化。在MDA-MB-231细胞中转染miR-27a inhibitor和negative control(miR-NC),提取转染后细胞所分泌的外泌体,qRT-PCR检测各组细胞所分泌的外泌体,结果显示,相比于miR-NC组(1.00±0.00)外泌体,转染miR-27a inhibitor组外泌体miR-27a表达(0.08±0.04)显著下调(P<0.001)。将miR-NC exo和miR-27a inhibitor exo与M0型巨噬细胞孵育,qRT-PCR检测结果(图3B)显示,相比于miR-NC exo组细胞,miR-27a inhibitor exo组M1型巨噬细胞标志蛋白CD80、MCP-1、iNOS、IL-6表达无显著变化,M2型巨噬细胞标志蛋白CD206和MRC-2表达显著下调(P<0.001),说明乳腺癌细胞外泌体miR-27a可调控M2型巨噬细胞极化。
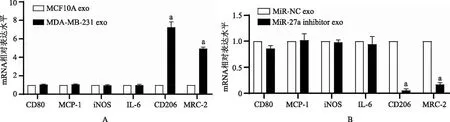
图3 qRT-PCR检测外泌体诱导后各组巨噬细胞CD80、MCP-1、iNOS、IL-6、CD206和MRC-2表达水平(相比于MCF10A exo组或miR-NC exo,aP<0.01)
5.外泌体miR-27a促进M2型巨噬细胞极化而促进乳腺癌细胞增殖:将各组外泌体与M0型巨噬细胞共孵育,诱导巨噬细胞极化后收集各组巨噬细胞培养上清(CM),将CM与MDA-MB-231细胞共孵育48小时后,CCK8法检测细胞增殖能力,结果(图4)显示,相比于MCF10A exo/CM组,MDA-MB-231 exo/CM组细胞在24小时、48小时、72小时增殖能力显著增加(P<0.05),说明乳腺癌细胞外泌体可通过诱导M2型巨噬细胞极化而促进乳腺细胞增殖,相比miR-NC exo/CM组,miR-27a inhibitor exo/CM组细胞在24小时、48小时、72小时增殖能力显著增加(P<0.01)(图4B),说明外泌体miR-27a可调控巨噬细胞极化而影响乳腺癌细胞的增殖能力。
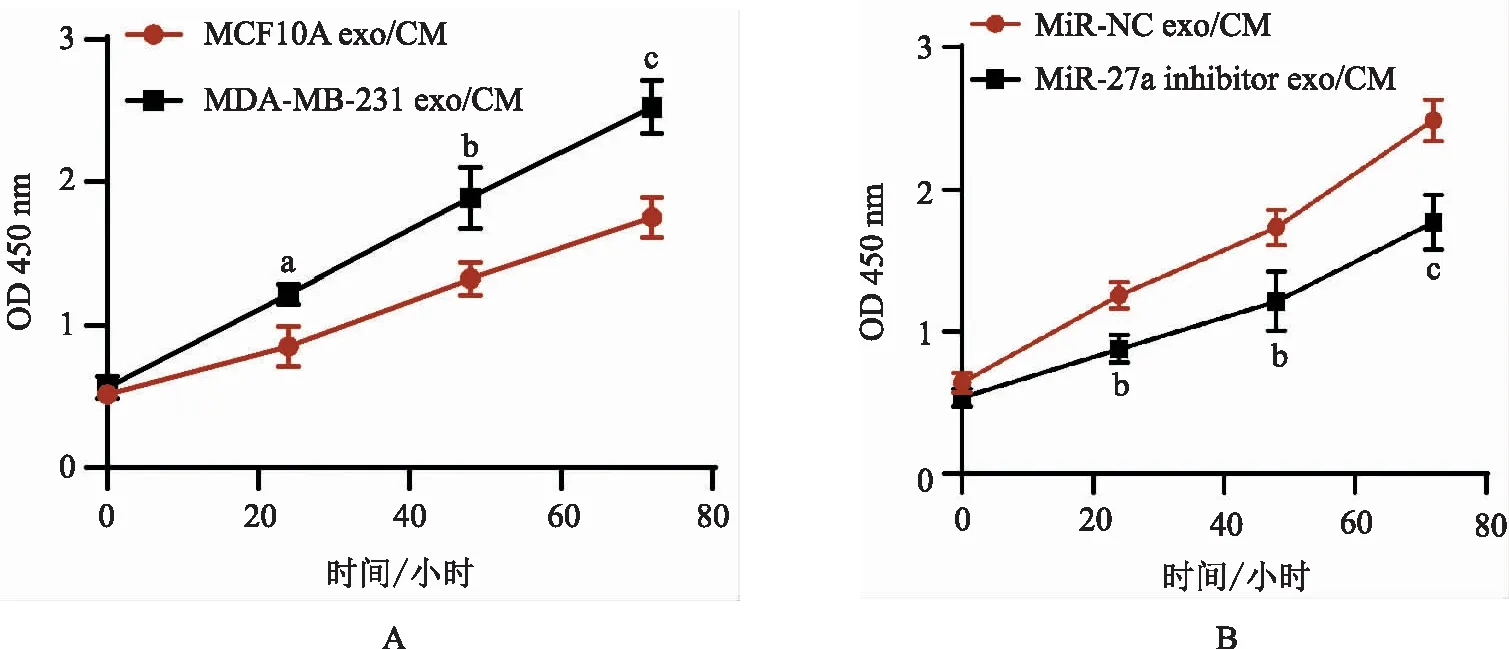
图4 CCK8法检测各组细胞增殖能力(相比于MCF10A exo/CM组或miR-NC exo/CM组,aP<0.05,bP<0.01,cP<0.001)
6.外泌体 miR-27a促进M2型巨噬细胞极化而促进乳腺癌细胞迁移和侵袭:相比于MCF10A exo/CM组(细胞迁移数:61.33±2.96,细胞侵袭:64.33±1.86),MDA-MB-231 exo/CM组MDA-MB-231细胞迁移(245.0±6.35)和侵袭数(152.30±4.33)显著增加(P<0.001);说明乳腺癌细胞外泌体能够通过诱导M2型巨噬细胞极化而促进乳腺癌细胞的迁移和侵袭能力,相比于miR-NC exo/CM组(细胞迁移数:181.0±3.22,细胞侵袭:133.00±4.36),miR-27a inhibitor exo/CM组细胞迁移数(54.00±3.46)和侵袭数(39.33±2.33)显著减少(P<0.001)(图5),说明外泌体 miR-27a促进M2型巨噬细胞极化而促进乳腺癌细胞迁移和侵袭。
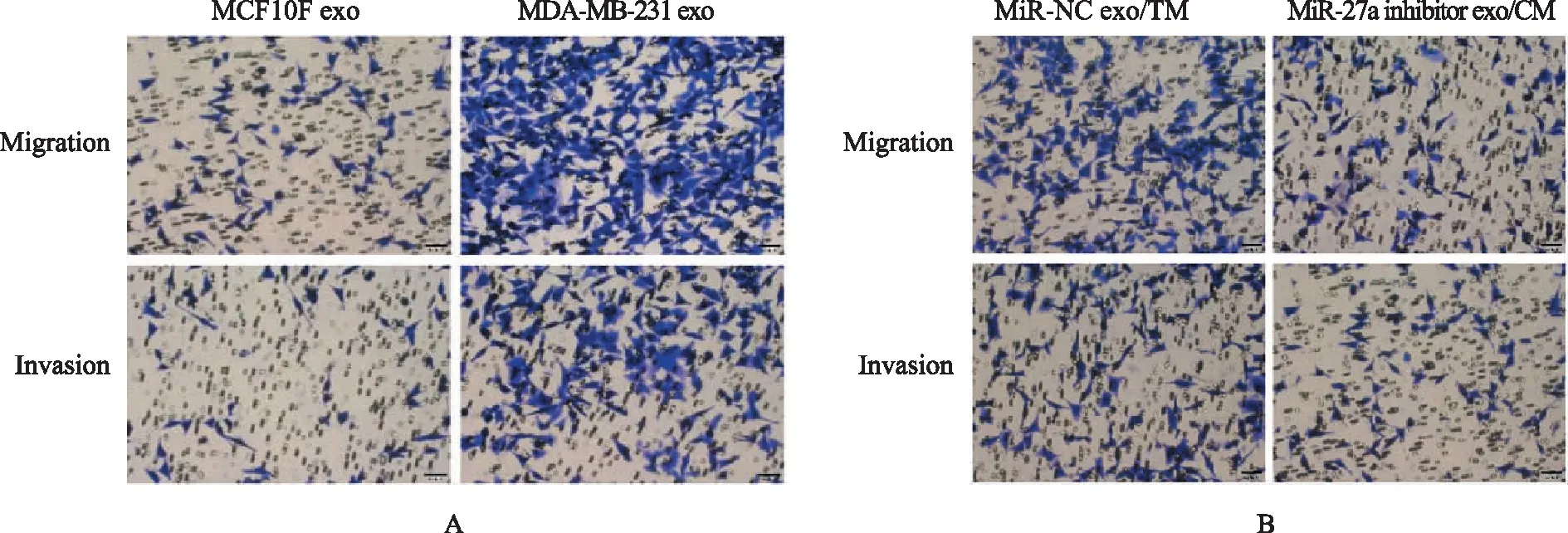
图5 Transwell小室法检测各组细胞迁移和侵袭能力(结晶紫染深色×20,相比于MCF10A exo/CM组或miR-NC exo/CM组,aP<0.01)
讨论
研究表明,乳腺癌的发展与巨噬细胞密切相关,巨噬细胞是肿瘤微环境的重要组成部分[12-13],肿瘤微环境诱导巨噬细胞分化为肿瘤相关巨噬细胞,分为经典活化巨噬细胞 M1型和替代活化巨噬细胞 M2 型,M1型巨噬细胞发挥促炎和抗肿瘤作用,M2 型巨噬细胞发挥促癌作用[14-15]。研究表明,多种肿瘤外泌体诱导M2型巨噬细胞极化而诱导肿瘤的发展,例如[16-17],卵巢癌外泌体miR-222-3p诱导肿瘤相关巨噬细胞极化,缺氧条件下,脑胶质瘤外泌体miR-1246能够诱导M2型巨噬细胞极化而促进肿瘤的发展。有研究表明,miR-27a在乳腺癌组织和细胞中均高表达,并且可调控乳腺癌的生长和转移能力。
M1型巨噬细胞可被IFN-γ和LPS激活,抑制肿瘤细胞对宿主的侵袭,IL-4 和IL-13可诱导M2型巨噬细胞帮助肿瘤细胞免疫逃逸[18]。本研究通过IFN-γ和LPS诱导M1型巨噬细胞极化,IL-4 和IL-13诱导M2型巨噬细胞极化,检测发现miR-27a在M2型巨噬细胞中高表达,在M1型巨噬细胞中显著低表达,提示巨噬细胞的M2型极化与miR-27a密切相关,并且miR-27a mimic可显著促进M0型巨噬细胞极化为M2型巨噬细胞,miR-27a inhibitor可显著抑制M2型巨噬细胞极化,说明miR-27a可促进M2型巨噬细胞极化。
研究表明,口腔鳞状细胞癌外泌体中的miR-29a-3p可诱导巨噬细胞的M2型极化而促进肿瘤的生长[19],胰腺癌外泌体miR-301a调控 PTEN/PI3Kγ信号通路而诱导M2巨噬细胞极化[9]。本研究结果表明,MDA-MB-231外泌体可促进M2型巨噬细胞标志蛋白CD206和MRC-2表达,说明MDA-MB-231外泌体可促进M2型巨噬细胞极化。qRT-PCR检测发现miR-27a高表达于MDA-MB-231细胞外泌体,抑制外泌体miR-27a表达后,乳腺癌细胞外泌体对M2型巨噬细胞的诱导显著抑制,说明外泌体miR-27a能够诱导M2型巨噬细胞极化。
研究表明,抑制IL-4 和IL-13诱导M2型巨噬细胞极化可抑制乳腺癌的放疗耐受[20],乳腺癌外泌体以及巨噬细胞的极化均可影响乳腺癌的淋巴转移[21]。本研究发现,miR-27a inhibitor exo诱导的巨噬细胞可显著抑制MDA-MB-231细胞增殖、迁移、侵袭能力,说明外泌体miR-27a可通过调控巨噬细胞极化而影响乳腺癌的生长和转移。
综上所述,乳腺癌外泌体miR-27a诱导M2型巨噬细胞的极化而促进乳腺癌的生长和转移,但是miR-27a是通过调控何种靶基因及信号通路而发挥调控作用还需进一步探究。

