火后森林土壤中捕食线虫真菌的即时恢复能力及驱动因子研究
齐宇坤, 张欣, 邓巍, 黄帅义, 佘容,2*, 杨晓燕,2,3
1. 大理大学东喜玛拉雅研究院,云南 大理 671003;
2. 中国三江并流区域生物多样性协同创新中心,云南 大理 671003;
3. 大理大学三江并流区域生物多样性保护与利用云南省创新团队,云南 大理 671003
火是陆地生态系统中十分重要的干扰因子[1]。随着全球气候变暖,野火发生频率越来越高,尤其近两年内世界各地发生的持续时间长、强度高的森林火灾,使火对全球生态系统的影响及火后恢复研究受到极大关注[2]。过去对于火干扰的研究主要针对地上植被展开[3],而近几年有学者提出仅关注地上植被或许并不利于生态系统的整体恢复,在制定恢复策略时应当对各个生物类群进行综合考虑[4-5]。微生物作为陆地生态系统的重要组成部分,承担了很多重要的生态功能,其群落特征是反应土壤生态系统应对压力和干扰的综合指标[6]。同时,微生物能够对土壤微环境进行改造,与土壤动物、昆虫以及地上植被关系密切[7-8],火后土壤微生物的恢复也直接影响植被恢复,从而影响到整个森林生态系统的稳定性,对火后生态系统的恢复具有十分重要的作用[4,9]。因此,开展火后土壤微生物群落恢复能力及驱动因子研究是很有必要的。
目前的研究已经证明火干扰可以通过直接和间接的作用明显改变土壤微生物的群落结构[10-11],但很多研究都是以年为时间单位开展的,这便忽视了火后土壤微生物的即时恢复过程,而微生物繁殖快、易扩散、适应能力强,即时恢复的研究是必要的[4,12]。另一方面,由于土壤微生物群落结构在不同土层深度存在较大差异,土壤对热量的传导性也较差,使得火干扰对不同土层微生物的影响也不同[13]。因此,要探究驱动火后土壤微生物群落恢复的机制,需要掌握火后土壤微生物群落在不同土层的即时变化情况。此外,由于土壤微生物群落的复杂性和各类群生物量的差异,即便基于现代分子生物学方法,如宏基因组学技术,也难以获得种水平上的微生物群落变化信息[14],而这严重阻碍了对土壤微生物群落环境适应机制研究。现有传统纯培养技术虽无法完整地分离所有类群,但可以通过选择一个类群小、个体大、易于分离、鉴定,生态学功能明确的微生物类群探究其群落变化问题[15]。
捕食线虫真菌(Nematode-trapping Fungi,NTF)是一类广泛分布于各种生境,可平衡不同生境中的线虫种群数量,间接调节土壤氮循环,营养类型多样的真菌,其类群小(仅3属103种)[16-22],且易于人工培养、鉴定,因而可以作为在物种水平上开展土壤微生物研究的优选类群。基于此,本文选取了云南省大理州弥渡县弥城镇谷芹村的云南松林火烧迹地作为样地,并在邻近的未过火区域选取与研究区域的海拔、坡度、坡向、原始植被等生境条件基本一致的区域作为对照样地,分层采集不同土壤样品,探究火后土壤中捕食线虫真菌的即时恢复状态及不同土层中捕食线虫真菌分布差异,分析驱动火后捕食线虫真菌恢复的主要因子。研究结果不仅能从单一类群的角度回答微生物在火后的即时恢复能力,也能为微生物的环境适应机制提供数据支持,同时为火后森林火烧迹地的恢复和管理提供理论依据。
1 研究区域
研究区域位于云南省大理州弥渡县弥城镇谷芹村(25°17'26.04'N,100°28'14.84'E),原始植被主要为云南松。2019年6月8日该区域发生森林大火,过火面积约47 hm2。本研究在火烧迹地内选取火烧强度均匀的区域设置研究样带,并在火烧迹地外1 km处设置一坡向、海拔、原始植被等均与火烧迹地基本一致的区域设置非火烧对照区域。
2 研究方法
2.1 样本采集
于2019年7月18日进行土壤样本采集。采样时,分别在选取的两块样地中布设样线,并设置6个样点,每个样点之间间隔20 m,每个样点按照0~10 cm(表层土),10~20 cm(中层土),20~30 cm(深层土)进行分层采集(见图1),火烧迹地与非火烧地分别采集样本18份,合计36份。采样时注意避免样品交叉污染,装于一次性自封袋中并标记样点、土层、采样时间等样品信息,带回实验室。将采集到的土样置于4℃冰箱保存,并在一周内处理完所有样品。

图 1 研究区域生境示例Fig. 1 The habitat of the study area
2.2 培养基的制备
玉米琼脂培养基(Corn meal agar medium,CMA),用于捕食线虫真菌的分离、培养、形态学鉴定;土豆培养基(Potato dextrose agar medium,PDA),用于富集菌丝提取DNA;燕麦培养基,用于培养诱饵线虫。配制方法均参照文献[23]进行。
2.3 诱饵线虫的培养及制备
将全齿复活线虫(Panagrellus redivivus)接入燕麦培养基,放恒温培养箱26.5℃培养一周,直到观察到线虫爬壁即可取出备用或放4℃冰箱保存。采用贝尔曼漏斗法[16]制备线虫悬浮液。
2.4 捕食线虫真菌的分离和纯化
采用诱饵平板法。每份土样取1~2 g,按五点撒样法撒至直径为90 mm的CMA平板上,每份土样设置3个平行。每个平板加入1 mL全齿复活线虫悬液以诱导捕食线虫真菌孢子的萌发,常温避光培养4~5周后,在体视显微镜下,利用无菌牙签以单孢挑离法[23]挑取捕食线虫真菌的单个分生孢子至中央留有约2 cm×2 cm观察室的直径60 mm CMA平板上,置于26℃恒温箱中培养,至菌丝铺满观察室后再在观察室中加入制备好的线虫悬液(约200条)以诱导产生捕食器官,26℃恒温培养2~4 d后观察捕食器官的类型。
2.5 捕食线虫真菌的鉴定
形态学鉴定:采用胶带法制作捕食线虫真菌临时装片[23],用奥林巴斯BX53微分干涉显微镜拍取分生孢子、孢子梗、厚垣孢子和捕食器官等的形态特征,并参照文献[16-22]进行形态学鉴定。
分子生物学鉴定:对于形态特殊,难以通过传统形态学鉴定到种的菌株,参照文献[25]提取待定菌株的基因组DNA。以ITS1、ITS4[26]为引物分别对ITS(internal transcribed spacer region of the ribosomal RNA gene,核糖体RNA上的非转录间隔区)进行PCR扩增和测序,PCR 反应体系如下(50 μL)如下:PCR Buffer(10×)5 μL, Mgcl2(25 mM·μL-1)5 μL,dNTP (10 Mm·μL-1)1 μL,Taq DNA聚合酶0.5 μL,上游引物(10 μM·μL-1)1.5 μL,下游引物(10 μM·μL-1)1.5 μL,DNA模板2 μL,无菌超纯水33.5 μL。反应条件如下:94℃预变性4 min,94℃变性45 s,54℃复性1 min,72℃延伸1.5 min,共35个循环,最后72℃补平延伸10 min。PCR产物交上海生工生物工程有限公司进行纯化并双向测序。所得序列经SeqMan软件进行核实和拼接,最后将所得序列导入到NCBI中用Blast工具进行同源性比较,并按照同源性达到98%及结合形态学鉴定结果将其确定菌株物种属性。
2.6 数据处理
(2)物种检出率(Occurrence frequency,OF)=检出某个种的土样数/总土样数×100%。
(3)所有数据采用Microsoft Excel 2016和GraphPad Prism 7.0软件进行数据整理和统计分析。
3 结果
3.1 捕食线虫真菌总检出情况
从火烧迹地和非火烧地的36份土样中共分离出88株捕食线虫真菌,其中Arthrobotrys属4种20株,Dactylellina属3种67株,Drechslerella属1种1株。而在分离到的捕食线虫真菌中,有43株捕食线虫真菌来自火烧地土壤样品,经鉴定,分别属于Dactylellina属的3个种;另外45株捕食线虫真菌则分离自非火烧地土壤样品中,分别属于3个属(Arthrobotrys、Dactylellina、Drechslerella),共8种,各物种在不同土壤样品中的检出率见表1。
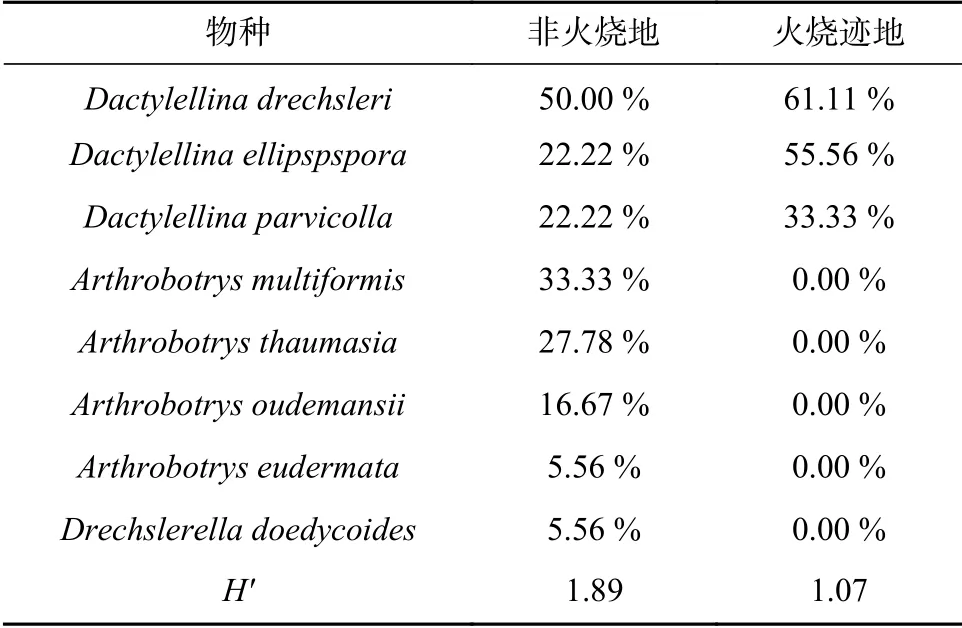
表 1 火烧迹地与非火烧地不同捕食线虫真菌的检出率Tab. 1 Detection rate of different nematode-trapping fungi species in burned and unburned areas
3.2 不同土层检出率和物种多样性的概况
火烧迹地与非火烧地中捕食线虫真菌均是在表层土中的检出率最高。随着土层深度的增加,检出率降低;且经过40 d的恢复,火烧迹地各个土层中物种的总检出率略只低于非火烧地(见图2),但火烧迹地中捕食线虫真菌物种多样性(1.07)明显低于非火烧地(1.89)。

图 2 火烧迹地与未火烧地不同土层总检出率比较Fig. 2 Comparison of the total detection rate in different layers between burned and unburned areas
3.3 火干扰下捕食线虫真菌群落结构的改变
非火烧地中除Dac.drechsleri在10~20 cm的土层中检出率较高以外,其余各物种分布规律较为一致,均表现为在表层的检出率较高,深层检出率较低,且在相同土层中各物种的检出率差异不大,体现出在非火烧地中多数物种在不同土层间的分布较为均匀,群落结构较为稳定。而火烧迹地中各物种在不同土层的分布存在明显差异,且在相同土层中各物种的检出率也存在明显差异(见图3),由此可以看出火干扰破坏了土壤中捕食线虫真菌群落的稳定性,促使捕食线虫真菌的群落结构发生改变。
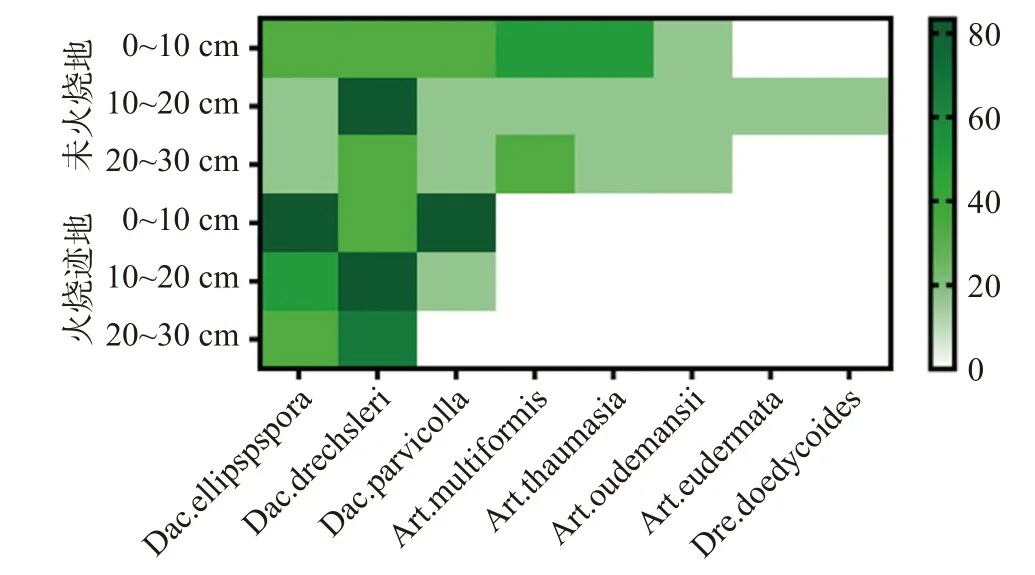
图 3 火烧迹地与非火烧地不同土层中捕食线虫真菌的分布及检出率Fig. 3 Distribution and detection rate of nematode-trapping fungi in different soil layers of burned and unburned areas
3.4 不同物种对火干扰的响应不同
通过将火烧迹地检出的3个物种与其在未火烧地中的检出率比较发现,与未火烧地相比,火烧迹地中3个物种的总检出率均有所增加,但不同物种对火干扰的响应不同,具体表现为:(1)Dac. ellipspspora在火烧迹地各个土层中的检出率均高于非火烧地,即火干扰后所有土层的检出率均增加;(2)Dac. parvicolla在20~30 cm土壤中的检出率比非火烧地略有下降,而在0~10 cm土壤中的检出率高于非火烧地;(3)Dac. drechsleri的检出率与非火烧地相比在0~10 cm和10~20 cm土壤中的检出率没有变化,但在20~30 cm土壤中有所增加(见图4)。
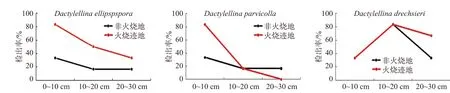
图 4 火烧迹地捕食线虫真菌在不同土层的检出率比较Fig. 4 Comparison of the detection rate of nematode-trapping fungi in different soil layers in burned areas
4 分析与讨论
4.1 火干扰后土壤捕食线虫真菌恢复迅速
此前对于火后微生物恢复研究大多数基于传统生物量测定和宏基因组方法,这些研究反映了火干扰后森林土壤微生物群落的变化趋势,但传统生物量的测定方法只能从整体讨论生物量的变化,无法整体监测生物多样性,导致信息缺失。而宏基因组检测技术容易忽略环境中的稀有物种,并且通常运用宏基因技术时样品采集密度低,这也可能导致稀有物种被忽略[14]。因此过去的研究忽略了稀有类群在火后恢复中的作用,但稀有物种对于整体的生态功能是至关重要的[27]。本研究利用传统培养法针对捕食线虫真菌这一小类群的研究发现,火干扰会明显改变捕食线虫真菌原本稳定的群落结构,降低其多样性,说明和其他真菌类群一样,火烧对捕食线虫真菌类群的多样性影响极大[28]。同时,与其他研究相比明显不同的是,本研究中捕食线虫真菌在各个土层的总检出率在火烧40 d后即可恢复到仅略低于未火烧地的水平,且捕食线虫真菌已经形成新的生态位分化,这说明捕食线虫真菌在火烧40 d后已经完成了一定程度的恢复,指示群落结构与非火烧地有明显差别。究其原因,这可能是由于火后土壤条件仅有利于部分类群的恢复,不同类群在火后的恢复机制不同所致。因此,要进一步认识火后微生物的恢复机制,未来还需要在种水平上开展更细致、广泛的研究。
有研究指出,土壤微生物群落的功能冗余使许多类群执行的功能不会因多样性的差异而改变[7]。真菌是早期凋落物的分解者,且在最初的微生物矿化过程中发挥着主导作用[7],因此,在火后生态系统中的作用也应十分重要。但有研究证明火烧后森林土壤含水量降低,有机酸变性导致土壤pH值升高,使火后土壤环境不利于真菌的恢复[29]。而本研究发现火烧40 d后捕食线虫真菌群落已经完成了一定程度的恢复;由此我们推测,捕食线虫真菌对火烧后的剧烈环境变化具有较高的适应性,而捕食线虫真菌又是在土壤生态系统中发挥着重要作用的一类真菌,与细菌、植物根系、土壤动物的关系十分密切[8,16],因此其在火后生态系统恢复过程中可能会发挥重要的调控作用,但由于本研究的局限性,稀有类群在火烧迹地的恢复和适应机制及在火烧迹地营养物质循环中发挥的作用有待进一步研究。
4.2 Dactylellina属可能是火后捕食线虫真菌群落恢复的关键类群
此前研究表明,不同的微生物类群对火干扰的敏感性及火后环境适应能力存在差异[30],使得火后土壤微生物群落结构发生显著改变。本研究结果显示,与非火烧地相比,火烧迹地捕食线虫真菌群落结构发生显著变化,仅检出了Dactylellina属捕食线虫真菌,而在大部分生境中占据优势的Arthrobotrys属在火烧地中未检出,这与其他火烧迹地捕食线虫真菌研究的结果一致[27,31]。有研究者认为,可能是Arthrobotrys属多占据土壤上层生态位[16],在火烧过程中更容易被高温杀死,除此之外,火烧还会大量清除土壤中的有机物,使得依赖分解有机物获取营养的Arthrobotrys属难以恢复;而Dactylellina属真菌更多分布于深层土壤中[16],由于土壤对热量的传导性较差,使火烧对Dactylellina属的影响减弱,同时Dactylellina属比Arthrobotrys属真菌捕食线虫的能力更强[23],因此在火后获取营养的途径更广,加上土壤上层生态位空间空缺,促使Dactylellina属能够在火烧后较短时间内实现对土壤上层空间补位,生物量迅速恢复,替代了原有其他物种的生态功能[32]。因此,Dactylellina属真菌可能更适应火后剧烈变化的环境条件,是火烧后土壤捕食线虫真菌类群即时生态恢复的关键类群,在火后恢复中扮演重要的角色,是驱动火后土壤微生物群落恢复的主要生物因素。
4.3 分布于深层土壤中的捕食线虫真菌驱动了整个土壤捕食线虫真菌群落的恢复
本研究在火烧迹地中分离出的三种捕食线虫真菌也同时存在于非火烧地中,而与非火烧地相比,各个物种的恢复节律存在明显差异。这体现了火烧引发的捕食线虫真菌在物种水平上的生态位分化,即一方面在火因子的干扰下,资源环境在不同土层上具有明显变化[13];另一方面也说明各物种在生存需求、环境适应和定植能力等方面均存在属内差异[16]。同时,Dactylellina属在火后不同土层的检出率变化表明土壤深层分布的该属真菌驱动了捕食线虫真菌群落的快速恢复。基于此,关于火后土壤生态系统恢复策略的制定有必要将环境变化,以及土壤微生物在不同土层深度中的分布差异纳入考虑。但是,目前对于火干扰后不同土层中微生物群落恢复节律及功能类群的研究还比较有限,火干扰后恢复效果的评估也缺乏相应的参照标准,相关的研究亟待加强。

