lncRNA PURPL通过调控miR-367-3p/MTA3轴抑制肾癌细胞的增殖和侵袭
杨凌博,孙建涛,鲁帅奇,武新超,李小辉
肾癌的发病率在泌尿生殖系统肿瘤中位居第2位,是常见的肾脏恶性肿瘤[1]。早期肾癌的治疗取得较大进展,然而中晚期肾癌的疗效依然较差,肾癌细胞高度增殖活性及侵袭导致中晚期肾癌患者预后不良[2-3]。目前,肾癌增殖和侵袭的机制尚不清楚。长链非编码RNA(long non-coding RNA, lncRNA)由RNA聚合酶Ⅱ转录合成,在肾癌、胃癌等恶性肿瘤的发生、发展中起决定性作用[4-5]。PURPL是新近发现的lncRNA,参与调控肝癌、胃癌、结直肠癌等肿瘤细胞的增殖和转移,其表达高低与肿瘤的大小和组织学分级相关[6-8]。PURPL在肾癌组织中的表达水平、具体作用及调控机制尚待阐明。本文旨在探讨PURPL在肾癌组织和细胞系中的表达,明确PURPL通过调控miR-367-3p/MTA3分子轴对肾癌细胞增殖和侵袭的影响,为寻找新的肾癌治疗靶点提供实验依据。
1 材料与方法
1.1 材料
1.1.1临床资料 收集2018年1月~2020年8月我院泌尿外科手术切除的67例肾癌组织,均为肾透明细胞癌。其中男性39例,女性28例;年龄26~83岁,平均63.23岁。根据2010年美国癌症联合会TNM分期标准:Ⅰ期43例,Ⅱ期23例;根据Fuhrman组织学分级:Ⅰ级23例,Ⅱ级29例,Ⅲ级9例,Ⅳ级6例。另收集距离肿瘤边缘>2 cm的癌旁组织作为对照。肿瘤组织和癌旁组织均经两名以上病理医师证实,标本均冻存于液氮,患者术前均无放、化疗及免疫治疗史。本实验经我院伦理委员会批准,患者均签署知情同意书。
1.1.2细胞与试剂 肾癌细胞系和正常肾小管上皮细胞,购于中国典型培养物保藏中心。阴性对照慢病毒、PURPL慢病毒、miR-367-3p mimic、miR-NC mimic、PURPL野生型报告基因(PURPL-WT)与突变型报告基因(PURPL-MUT),均购于上海吉玛公司。TRIzol试剂和Lipofectamine 2000,购于美国Invitrogen公司。MTT试剂盒购于南京凯基公司。qRT-PCR试剂盒和引物,购于南京建成生物研究所。胎牛血清、DMEM培养基、RPMI 1640培养基,购于美国Hyclone公司。双荧光素酶报告基因试剂盒,购于美国Promega公司。一抗(MTA3、Cyclin A、CDK2、Zeb-2、GAPDH、Snail)和辣根过氧化物酶标记二抗,购于美国BD公司。
1.2 方法
1.2.1细胞培养与转染 ACHN、786-O、A498、Caki-1、OS-RC-2细胞置于含10%胎牛血清的RPMI 1640培养基中,HK-2细胞置于含10%胎牛血清的DMEM培养基中,常规培养于37 ℃、5%CO2培养箱中培养。OS-RC-2细胞进入对数生长期后,胰酶消化并接种到6孔板,实验分组:对照组和PURPL组分别感染阴性对照慢病毒和PURPL慢病毒,感染复数(MOI)均为40;感染48 h后进行后续实验。
1.2.2qRT-PCR检测PURPL、miR-367-3p与MTA3 mRNA的表达 采用TRIzol试剂提取组织及细胞总RNA,逆转录合成cDNA。根据qRT-PCR试剂盒说明书建立反应体系,以GAPDH和U6作为内参照。qRT-PCR检测PURPL正向引物:5’-TTCTACCGCAATTCGATGGAGTCTTG-3’,反向引物:5’-GAGGCAGGAGAATGGCGTGA-3’;U6正向引物:5’-CTCGCTTCGGCAGCACA-3’,反向引物:5’-AACGCTTCACGAATTTGCGT-3’;miR-367-3p正向引物:5’-CGAGCAATTGCACTTTAGCAAT-3’,反向引物:5’-GTGCAGGGTCCGAGGT-3’;GAPDH正向引物:5’-CTGGGCTACACTGAGCACC-3’,反向引物:5’-AAGTGGTCGTTGAGGGCAATG-3’;MTA3正向引物:5’-TCCTCCAGCAACCCATACCT-3’,反向引物:5’-TCGGTCAAGTCAGCCTCAAC-3’。qRT-PCR运行参数:95 ℃ 50 s,95 ℃ 30 s,55 ℃ 30 s,72 ℃ 30 s,合计35个循环。采用2-ΔΔCt方法计算PURPL、miR-367-3p和MTA3 mRNA表达水平。
1.2.3MTT法检测OS-RC-2细胞活力 收集对数生长期的OS-RC-2细胞,调整细胞密度至每毫升1×104个细胞,取150 μL细胞悬液加入96孔板。取20 μL MTT试剂加入每孔,培养箱内培养4 h。吸去培养基后,取120 μL二甲基亚砜加入各孔,利用振荡器充分振荡。利用酶标仪在波长450 nm处测量每孔光密度(OD)值。每天检测OS-RC-2细胞活力,连续检测5天。
1.2.4Transwell实验检测OS-RC-2细胞侵袭 在Transwell小室预铺基质胶,用不含胎牛血清的培养基调整对数生长期的OS-RC-2细胞密度至每毫升1×105个细胞,取150 μL细胞悬液加入Transwell小室,取550 μL含胎牛血清的培养基加入下室。培养24 h,取出Transwell小室并用棉签擦去未穿过上室的细胞,利用甲醇进行固定,利用结晶紫染液进行染色,流水清洗并晾干,显微镜(×100)下观察、拍照、计数。
1.2.5生物信息学技术预测和双荧光素酶报告基因实验验证PURPL的潜在分子机制 利用starBase v 2.0数据库预测PURPL结合的miRNA。收集对数生长期的OS-RC-2细胞接种至96孔板,根据Lipofectamine 2000说明书进行转染,将PURPL-WT与PURPL-MUT及miR-367-3p mimic或miR-NC mimic共转染至OS-RC-2细胞中,转染48 h后,根据双荧光素酶报告基因检测试剂盒说明书检测OS-RC-2细胞的相对荧光素酶活性。
1.2.6Western blot法检测MTA3蛋白表达 收集对数生长期的OS-RC-2细胞,利用RIPA裂解液提取总蛋白。BCA法检测蛋白浓度后,在10%十二烷基硫酸钠聚丙烯酰胺凝胶电泳,转膜至硝酸纤维素膜。在5%脱脂牛奶中封闭,加入一抗(稀释比均为1 ∶1 000)在4 ℃孵育过夜。洗膜后,加入辣根过氧化物酶标记的二抗孵育3 h,配置ECL试剂,在凝胶成像系统中曝光、显影。
2 结果
2.1 肾癌和癌旁组织中PURPL的表达水平PURPL在肾癌和癌旁组织中表达分别为0.40±0.14和1.61±0.21,癌旁组织的PURPL表达是肾癌组织的4.03倍,明显高于肾癌组织(P<0.01,图1)。

图1 肾癌组织和癌旁组织中PURPL表达水平
2.2 肾癌细胞和正常肾小管上皮细胞中PURPL表达水平肾癌ACHN、786-O、A498、Caki-1、OS-RC-2细胞中PURPL的表达分别为0.53±0.08、0.66±0.06、0.41±0.03、0.77±0.05、0.13±0.03,明显低于正常肾小管上皮细胞HK-2(1.00±0.05),差异有统计学意义(P均<0.05,图2),OS-RC-2细胞中PURPL表达水平最低(P<0.01),故选择OS-RC-2细胞进行后续实验。

图2 肾癌细胞和正常肾小管上皮细胞中PURPL表达水平
2.3 对照组和PURPL组OS-RC-2细胞中PURPL的表达水平荧光显微镜显示慢病毒感染成功。qRT-PCR结果显示,PURPL组和对照组OS-RC-2细胞中PURPL表达分别为16.26±3.10和1.02±0.12,差异有统计学意义(P<0.01,图3),表明PURPL过表达成功。
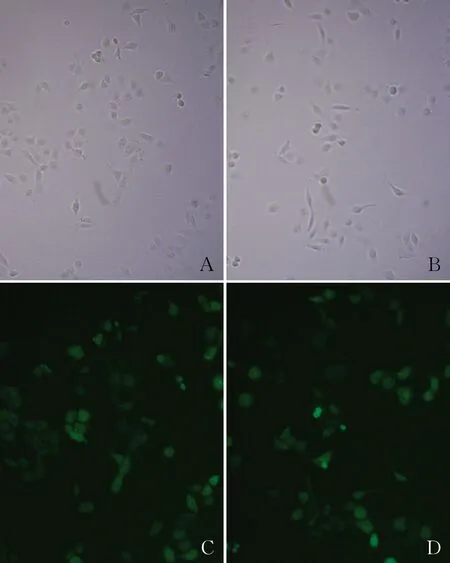
图3 OS-RC-2细胞中PURPL的表达水平:A.对照组(普通显微镜);B.PURPL组(普通显微镜);C.对照组(荧光显微镜);D.PURPL组(荧光显微镜)
2.4 过表达PURPL对OS-RC-2细胞增殖活力的影响MTT法结果显示,48 h后PURPL组OS-RC-2细胞增殖活力明显低于对照组(P<0.05,图4)。

图4 MTT检测PURPL对OS-RC-2细胞增殖活力的影响
2.5 过表达PURPL对OS-RC-2细胞侵袭的影响Transwell实验显示,对照组和PURPL组OS-RC-2细胞侵袭数分别为(71.53±6.23)个和(26.87±3.88)个;与对照组相比,过表达PURPL可明显抑制OS-RC-2细胞侵袭(P<0.01,图5)。
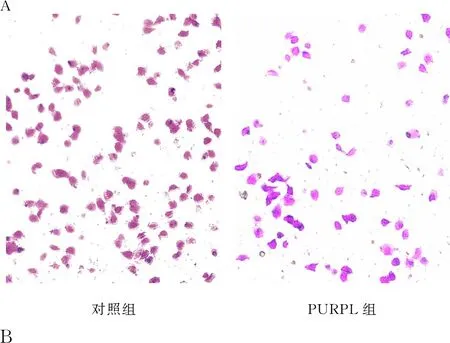
图5 Transwell实验检测PURPL对OS-RC-2细胞侵袭能力的影响:A.Transwell实验检测PURPL对肾癌细胞侵袭的影响;B.细胞侵袭数的半定量分析
2.6 生物信息学技术预测及双荧光素酶报告基因实验验证PURPL的潜在机制利用starBase v2.0数据库预测miR-367-3p可能是PURPL的靶基因(图6)。双荧光素酶报告基因实验结果显示,通过共转染miR-367-3p mimic和靶向位点无突变的PURPL-WT载体使OS-RC-2细胞中荧光素酶活性明显下降(P<0.01),而共转染miR-367-3p mimic和靶向位点突变的PURPL-MUT载体对荧光素酶活性无显著作用(P>0.05,图7),提示miR-367-3p是PURPL的靶基因。

图6 生物信息学技术预测PURPL的潜在机制

图7 双荧光素酶报告基因实验验证miR-367-3p和PURPL的靶向关系
2.7 过表达PURPL的OS-RC-2细胞中miR-367-3p和MTA3 mRNA表达变化qRT-PCR检测显示,对照组和PURPL组OS-RC-2细胞miR-367-3p的表达分别为1.04±0.16和0.23±0.08,过表达PURPL显著下调miR-367-3p的表达(P<0.01)。对照组和PURPL组OS-RC-2细胞MTA3 mRNA的表达分别为1.01 ± 0.06和5.49 ± 1.16,过表达PURPL显著上调MTA3 mRNA的表达(P<0.01)。
2.8 过表达PURPL促进MTA3蛋白表达Western blot结果显示,过表达PURPL后OS-RC-2细胞中MTA3蛋白表达明显增加,细胞增殖蛋白如Cyclin A、CDK2表达明显降低,细胞侵袭蛋白如Zeb-2、Snail表达明显降低,提示OS-RC-2细胞的增殖和侵袭能力明显降低(图8)。
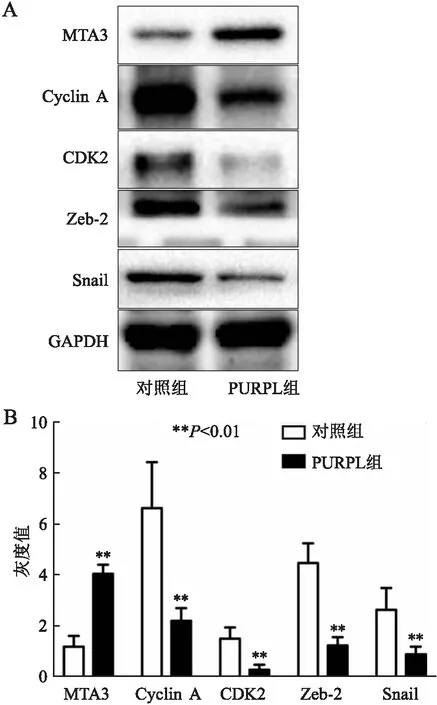
图8 Western blot法检测MTA3蛋白及细胞功能蛋白的表达:A.Western blot实验;B.蛋白表达灰度值分析
3 讨论
lncRNA参与调控染色质修饰、转录抑制及激活、核内运输等途径,影响基因的表达[9]。随着测序技术的进步,lncRNA已成为肾癌研究领域的新热点[10]。最新文献报道,lncRNA是肾癌增殖和转移过程的关键调控因子[11-12]。Cai等[13]研究表明,lncRNA PCGEM1主要位于细胞质,其在肾癌细胞中表达升高,沉默lncRNA PCGEM1可抑制肾癌的细胞增殖和迁移,miR-433-3p是lncRNA PCGEM1的靶基因。Hu等[14]研究表明,MSC-AS1在肾癌组织中显著上调,与肾癌患者的预后不良相关,降低MSC-AS1表达可通过促进miR-3924表达抑制肾癌细胞的增殖和迁移特性。lncRNA在不同肿瘤细胞中表现为不同的表达模式,因此在不同肿瘤细胞中的作用不同[15]。研究发现,PURPL能够显著调控结直肠癌细胞的增殖和转移能力[8]。目前,PURPL在肾癌中的表达、功能及调控机制尚不清楚。本组发现在肾癌组织和细胞系中PURPL的表达明显下调,上调PURPL能够抑制肾癌细胞的增殖和侵袭,提示PURPL在肾癌细胞中发挥抑癌功能。
lncRNA可特异性与相应miRNA互补结合,发挥“分子海绵”作用,抑制miRNA对其靶基因的调控作用[16-17]。本组采用starBase v2.0预测显示,PURPL与miR-367-3p存在潜在的结合位点。双荧光素酶报告基因实验验证PURPL共价靶向miR-367-3p。最近研究表明,miR-367-3p在非小细胞癌、骨肉瘤、肾透明细胞癌等多种肿瘤中高表达,显著促进肿瘤细胞生长和转移,发挥明显的癌基因功能[18-19]。miR-367-3p在肾癌组织和细胞系中表达增加,下调miR-367-3p显著抑制肾癌细胞的增殖和转移,MTA3基因是miR-367-3p在肾癌中的直接靶基因[20]。qRT-PCR和Western blot结果显示,上调PURPL可显著抑制miR-367-3p的表达,miR-367-3p表达下调可显著促进MTA3基因的表达。以上实验结果表明,PURPL可能作为miR-367-3p的“分子海绵”调节MTA3基因的表达,进而调控肾癌的发生、发展。Western blot结果显示,上调PURPL后细胞增殖蛋白如Cyclin A、CDK2表达显著减少,细胞侵袭蛋白如Zeb-2、Snail表达显著减少,提示OS-RC-2细胞增殖和侵袭能力明显降低。PURPL在体内对肾癌细胞增殖和侵袭的影响尚不明确,本课题组下一步将通过动物实验对PURPL在体内的作用进行验证。
综上所述,lncRNA PURPL在肾癌组织和细胞系中表达下调,PURPL通过下调miR-367-3p促使MTA3表达上调,从而抑制肾癌OS-RC-2细胞的增殖和侵袭。PURPL/miR-367-3p/MTA3轴有望成为肾癌治疗的标志物和有效靶点。

