煤热解废水成分分析及生物毒性评价
盖恒军,庞欣然,丰丙萧,王振东,肖 盟
(青岛科技大学 化工学院,山东 青岛 266042)
0 引 言
煤热解废水污染负荷高且生物毒性强,是最难处理的工业废水之一[1]。对于该类废水,需先利用“酚氨回收”预处理工艺分离大部分污染物,尽可能降低废水的生物毒性,然后进行生化处理[2-4]。当前工业现状生化处理运行效果时常不理想[5-6],生化出水化学需氧量(COD)浓度高于300 mg/L,远高于排放或回用标准,且在生化进水酚质量浓度、COD等常规指标未明显升高时,生化过程还常出现微生物的生长抑制及大量死亡等问题,导致出水水质恶化。生化装置的不稳定运行与进水中急性毒性物质的变化密切相关[7]。因此,除了关注COD、总酚等常规指标,还需评估煤热解废水生化进水的生物毒性,并尽可能提高预处理段的生物毒性消减率。
目前用于废水毒性评价的生物有藻类、鱼类和发光细菌等,其中发光细菌法灵敏度高、操作简单,可在短时间内测定毒性变化,且测得的毒性大小与废水的可生化性具有良好的相关性[8],已被广泛用于有机污染物的毒性评估[9]。利用发光细菌法对各种污染物的生物毒性进行分析,可以识别出对生化过程影响较大的关键有毒污染物(简称“关键污染物”),再根据关键污染物的物性特点对预处理工艺进行优化,最大限度去除该有毒物质。
首先需进行煤热解废水的成分分析明确关键污染物,但该废水组成复杂,使用色谱分析常出现色谱峰重叠、面积差异大等问题,因此,亟需寻找一种有效的预处理方法以实现该类废水成分的系统性分析。理论上,将废水中的污染物分类富集后再进行分析可以解决上述问题。根据煤热解废水中主要污染物的特点,基于酸碱配位的络合萃取方式可从废水中分离出酚类、脂肪酸等质量浓度很高的酸性有机物,再利用树脂对某些有机化合物的特异性吸附将剩余有机物进一步分离[10]。该方法可分别对分离富集的污染物进行分析,为此类废水研究提供参考。
目前,预处理装置多采用液液萃取工艺来脱除酚类等有机污染物,以实现生物毒性的消减。因酚类污染物在煤化工废水中质量浓度最高,因而萃取剂的选择都以酚类污染物作为目标物。工业上常用的萃取剂有异丙醚(DIPE)、甲基异丁基甲酮(MIBK)、醋酸丁酯、三辛胺和磷酸三丁酯等。其中含氧的酯类、醚类、酮类等可与酚羟基形成氢键,属Lewis 碱的中性磷氧类和胺类可与酚类发生络合和离子缔合反应,因而理论上上述萃取剂均具有较好的脱酚效果,但由于部分酚类化合物在苯环上有取代基,影响了与萃取剂分子间的相互作用力,导致萃取效率降低。此外,对于酚类化合物以外的关键污染物,萃取剂的脱除效果还有待验证,相关强化措施还需进一步探索,以期为预处理工艺的优化提供借鉴。
1 材料与方法
1.1 仪器与试剂
废水样品取自新疆淖毛湖的某煤热解厂,已去除酸性气体和氨;生化出水样品取自好氧处理后的二沉池出水。废水样品用硫酸调pH至2.0,经滤膜过滤,于4 ℃下保存。
明亮发光杆菌T3小种冻干粉购自浙江清华长三角研究院,其菌种复苏方法参照国家标准GB/T 15441—1995《水质急性毒性的测定 发光细菌法》。
所用试剂均购自国药集团化学试剂有限公司,为市售分析纯。所有试验无特殊说明均使用去离子水。
LumiFox发光细菌生物毒性检测仪由深圳市朗石科学仪器有限公司提供。Water Oasis HLB固相萃取小柱(3 mL/60 mg)(SPE)购自沃特世科技有限公司。吸附填料选用二乙烯基苯-N-乙烯基吡咯烷酮共聚物。
1.2 试验方法
煤热解废水中污染物种类繁多,建立简单高效的关键污染物识别方法尤为重要。笔者分3步进行关键污染物的筛选:① 分析废水污染物组成;② 根据污染物浓度和毒性初步确定候选污染物;③ 依据候选污染物毒性贡献程度,确定10~20种关键污染物。
1.2.1废水污染物组成分析
1)生化出水组成分析。该分析可以快速发现部分残留的难降解污染物。分析时,先调生化出水pH至7.0,用水系滤膜(孔径0.45 μm)过滤水样,再用经甲醇活化的Water Oasis HLB固相萃取小柱进行固相萃取,甲醇进行洗脱,收集洗脱液并浓缩后进行GC-MS(气相色谱-质谱联用仪)分析。
2)原始热解废水组成分析。先采用三辛胺对酸化水样进行萃取,分离出酚类、脂肪酸等质量浓度较高的酸性组分,然后用XAD-8大孔树脂将萃余液中的有机物进一步分离,获得疏水酸性(HOA)、疏水中性(HON)、疏水碱性(HOB)和亲水性(HIS)物质[11-13],采用内标法分别对以上5类物质进行GC-MS分析,最后通过物料平衡计算可得原始热解废水的组成[14]。具体的分离步骤如下:① 取200 mL三辛胺萃后废水样品,调pH至7.0,以10 mL/min的流速通过树脂柱,用80 mL (0.01 mol/L)盐酸溶液和60 mL高纯水依次反淋洗树脂,再用高纯水补充液量至200 mL,得到疏水碱性物质;② 另取200 mL三辛胺萃后废水样品,以10 mL/min流速通过树脂柱,用80 mL (0.01 mol/L)NaOH溶液和60 mL高纯水依次反淋洗树脂,再用高纯水补充溶液量至200 mL,得到疏水酸性物质;③ 将前2步吸附后的萃余液混合,用高纯水补充溶液量至400 mL,即得亲水性物质;④ 前2步的树脂柱用200 mL甲醇反复洗脱,洗脱液体积用甲醇补充至200 mL,得到疏水中性物质。
1.2.2关键污染物的筛选
该类废水中关键污染物的筛选原则如下:
1)脂肪酸毒性较低,易生物降解,不考虑列为关键污染物。
2)污染物对废水生物毒性的影响不仅取决于污染物毒性的强弱,还与其浓度有关。因此,只考虑色谱峰面积排在前40位的非脂肪酸类污染物。
3)生化出水中仍可检出的污染物需依据其质量浓度进行筛选并评价其毒性。
基于上述3个原则,根据关键污染物的筛选步骤进行筛选,具体步骤如图1所示。
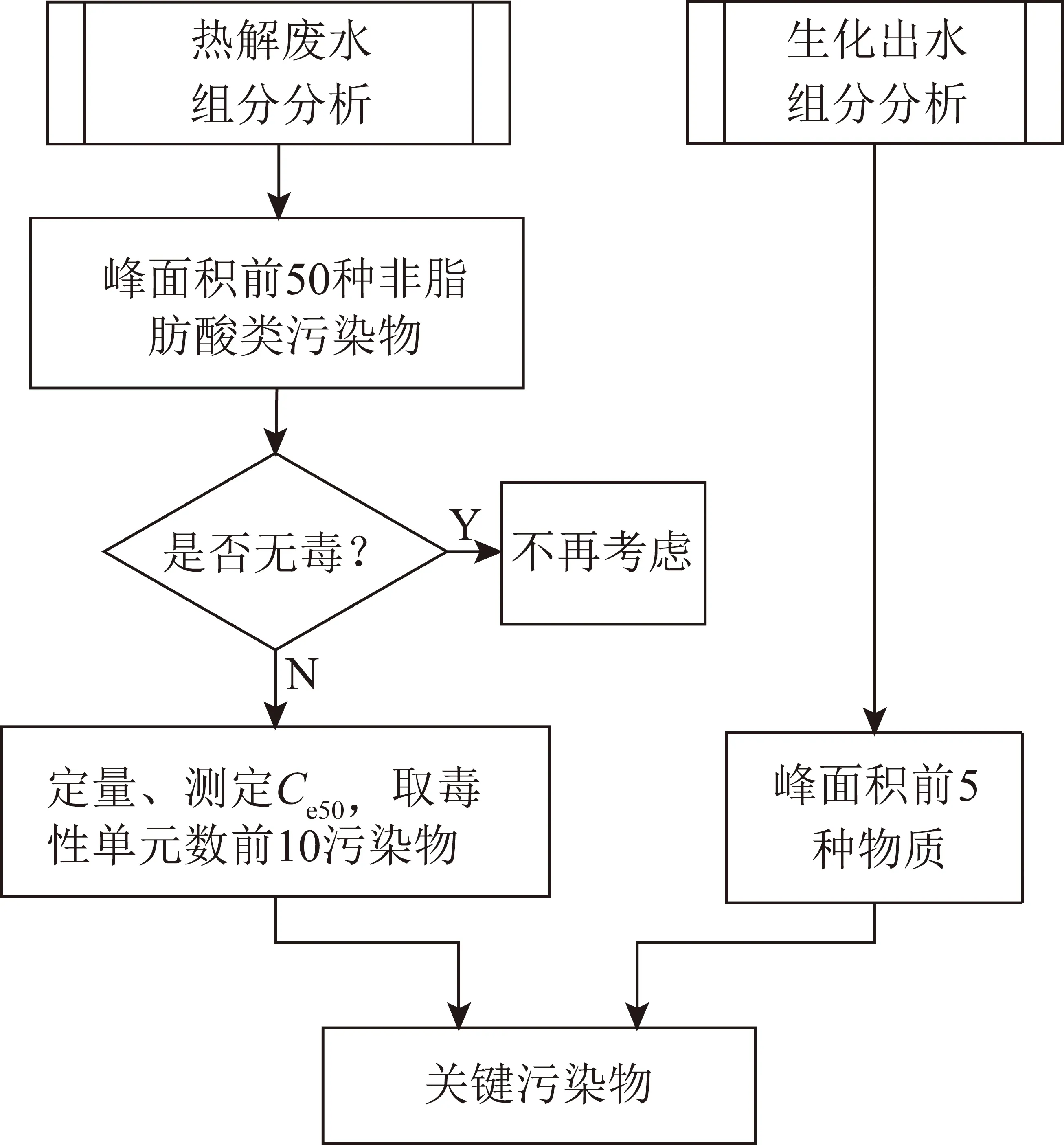
图1 关键污染物筛选步骤Fig.1 Key pollutants identification steps
1.2.3液液萃取模拟试验
目前,主要采用液液萃取对该类废水进行预处理,选用工业中常用的4种萃取剂(异丙醚、MIBK、醋酸丁酯、三辛胺)来研究不同萃取体系对毒性及关键污染物的消减情况。
萃取剂先用同体积的蒸馏水洗涤3次,去除可溶性杂质。将萃取剂与废水按1∶2(体积比)进行仿三级逆流萃取试验,将萃余液置于蒸馏釜中蒸馏掉5%,去除水中的萃取剂,再用蒸馏水补足,然后进行COD、总酚及废水的生物毒性分析。
1.3 分析方法
GC-MS分析条件:HP-INNOWAX石英毛细管柱(30 m×0.25 mm×0.25 μm);载气为氦气;流速为1 mL/min;入口温度250 ℃;电子能量70 eV;离子源温度250 ℃;加热程序为:初始温度在40 ℃保持2 min,然后以10 ℃/min速度升至250 ℃,并在250 ℃保持10 min;样品量为1 μL;分流比为20∶1。
生物毒性测定:生物毒性测定参照GB/T 15441—1995《水质 急性毒性的测定 发光细菌法》。其中,可溶于水的化合物溶解于3% NaCl溶液中,不可溶于水的先用二甲亚砜溶解,再用3% NaCl溶液配成测试液。受试化合物或水样的毒性水以发光细菌半数有效浓度(Ce50)表示,即发光细菌的发光强度被抑制一半时对应的质量浓度(mg/L)。对不同浓度的待测化合物溶液及其相应平均相对发光度进行指数拟合,求得待测化合物相对发光度为50%时对应的溶液浓度即为Ce50。
2 结果与讨论
2.1 废水组成分析和毒性测定
生化出水成分分析结果见表1,表1中经过生化处理后并未完全降解的污染物下一步筛选时应予以重点考虑。

表1 好氧处理后出水中主要有机物质量浓度
根据第1.2节对原始热解废水的分析,按照图1的步骤,根据物质的相对质量浓度大小列出峰面积前40位的非脂肪酸有机物,筛选出约30种的候选关键污染物,结果见表2。

表2 废水样品中候选关键污染物质量浓度
污染物的生物毒性与其自身的毒性强度及浓度有关。Ce50值只能反映污染物自身的毒性强弱。Ce50越低,其抑制发光细菌生长的能力越强,即生物毒性越大。因此,综合污染物浓度,污染物对毒性的贡献可由毒性单位数(UT)来表示:
UT=CCe50,
式中,C为污染物质量浓度,mg/L。
测定候选污染物的Ce50值,按UT自大到小排序后,保留前10余种有机污染物作为关键污染物。此外,在生化出水中残留较多且对废水的毒性贡献显著的部分污染物也列入关键污染物,主要以杂环类化合物为主。各关键污染物Ce50值和UT见表3(表3中y为测试化合物溶液的平均相对发光度,x为测试化合物溶液的质量浓度)。

表3 识别出的关键污染物的毒性指标

续表
由表3可知,该类废水中酚类是对毒性贡献最大的一类污染物,酚类化合物在废水中质量浓度相对较高,且本身为原生致毒物,进入生物体内可与细胞原浆中的蛋白质接触,发生反应形成不溶性蛋白质使细胞失去活力。不同酚类化合物间毒性强弱差异较大,苯酚的毒性最低,但苯环上存在取代基时通常会增加化合物的毒性,如甲基本身是疏水性基团,且其具有的给电子能力抑制了氢根的解离,进一步增加了脂溶性[15],因而甲基酚毒性远高于苯酚,也因相似原因,3-乙基酚的毒性更强于甲基酚;在检测到的酚类化合物中,萘酚的毒性最大,可归因于萘酚更高的脂溶性和更低的水溶性。而与萘相比,萘酚上羟基的引入增强了与生物受体碱性基团的结合能力而使其毒性显著增强[16]。同种取代基数量越多,化合物的毒性也就越强,如三甲基酚的毒性强于甲基酚和二甲基酚。此外,取代基的取代位置也会影响毒性,如邻甲酚的毒性大于间甲酚。除酚类外,多环及杂环化合物进入细胞经代谢活动后会生成有毒的中间产物,这些中间产物都会对细胞的蛋白质、脂质、DNA产生不可逆的损伤[17]。根据试验结果,吡啶类、萘类和喹啉类对废水的生物毒性影响很大,也应予以重视。
由于热解废水组成极其复杂,各关键污染物之间存在较为复杂的联合作用,具体的毒性机理还需要更全面及深入的探究。
2.2 预处理工艺对热解废水生物毒性及废水中关键污染物浓度的影响
预处理后废水的生物毒性、COD和总酚消减情况如图2所示,关键污染物组成变化情况见表4。

图2 几种萃取体系UT、COD及总酚消减率对比Fig.2 COD, total phenol and UT reduction rateof different extraction systems
由图2与表4可知,常用的4种萃取剂对废水毒性消减率自大到小依次为醋酸丁酯(96.6%)、MIBK(95.1%)、异丙醚(92.4%)和三辛胺(79.5%)。三辛胺萃取后废水的总酚消减率最高,但对COD、毒性以及非酚类关键污染物的消减能力却最低,这是由于三辛胺是络合型萃取剂,与其他3种物理型萃取剂相比,三辛胺会与酚类间依靠化学键相结合,具有较高的酚类萃取率和选择性,但对非酚类污染物萃取率相对较低,因而三辛胺不适合用于热解废水等复杂含酚废水体系的萃取处理。醋酸丁酯与MIBK可以较广谱地脱除各类关键污染物,对COD和生物毒性的消减率较高,适用于热解废水的萃取处理。
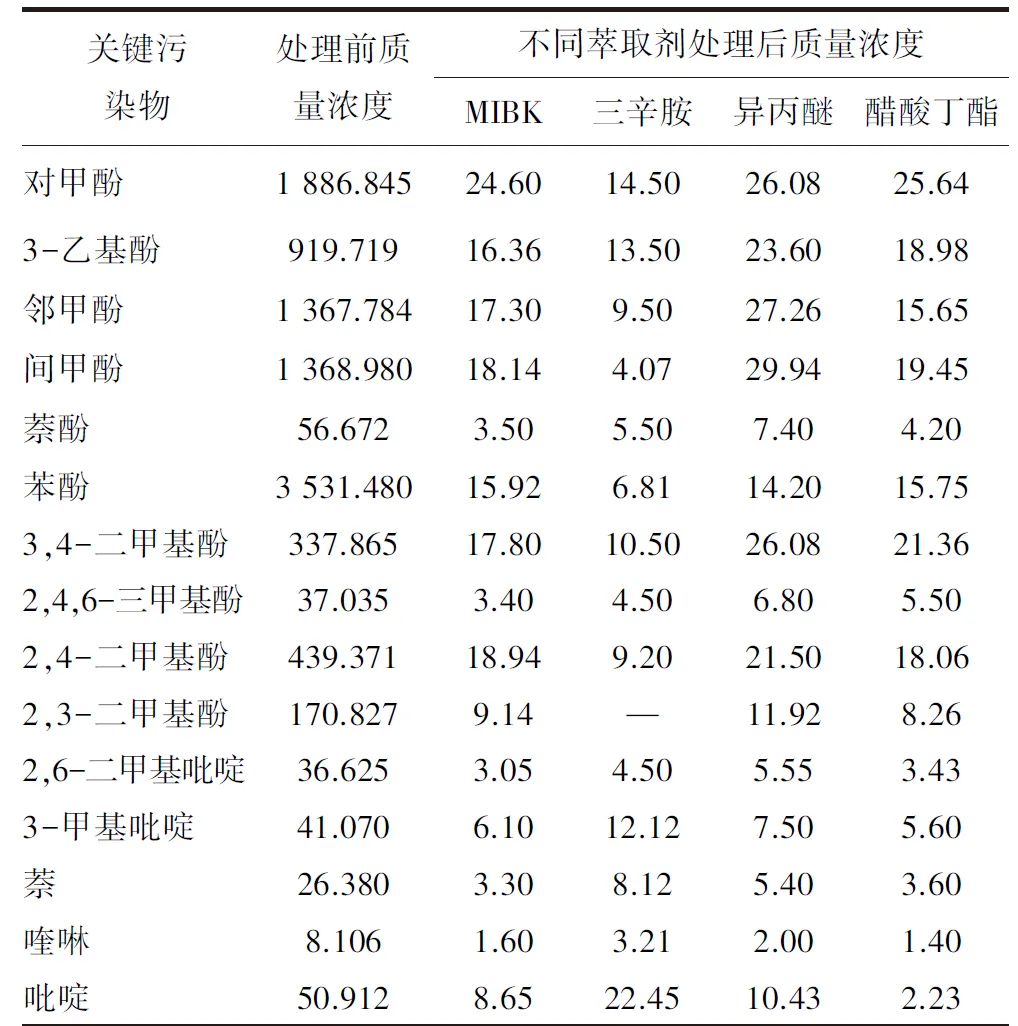
表4 不同萃取体系处理后关键污染物质量浓度
3 结 论
1)对复杂废水中的成分分类富集并进行成分分析,通过毒性评价指标(UT值)研究各种污染物对毒性的贡献,确定该类废水中的关键污染物。在COD等传统评价指标基础上,根据关键污染物的减少量和毒性评价指标对预处理工艺进行评价,可为进一步降低煤热解废水的环境风险提供工艺控制策略。
2)对热解废水进行组分分析时,采用三辛胺萃取结合大孔树脂分级吸附的方法将污染物分类富集,可以克服色谱峰重叠、面积差异大等问题。
3)采用毒性评价指标对污染物毒性进行量化的基础上识别出了热解废水中的10多种关键污染物。酚类对热解废水的生物毒性贡献最大,又以对甲酚的贡献最高;对于关键污染物自身毒性,萘酚的毒性最强,然后是三甲基酚和3-乙基酚,酚类苯环上的取代基种类、位置和数量都对毒性有明显影响;杂环类化合物在生化出水中残留较多,对废水的毒性也有显著贡献。
4)4种萃取剂对废水毒性消减率自大到小依次为醋酸丁酯(96.6%)、MIBK(95.1%)、异丙醚(92.4%)、三辛胺(79.5%);三辛胺萃取后废水的总酚消减率最高,但对COD、毒性以及非酚类关键污染物的消减能力最低,不适于热解废水的处理;醋酸丁酯与MIBK可以较广谱地脱除各类关键污染物,对COD和生物毒性的消减率较高,适用于热解废水的萃取处理。

