原发性肝癌患者外周血CD4+T、CD8+T、Tc17、Th17和Treg淋巴细胞的变化及其意义*
刘慧敏,刘晓利,王欣惠,杨志云,江宇泳
原发性肝癌(primary liver cancer,PLC)是临床常见的恶性肿瘤之一,具有早期诊断困难、恶性程度高、发展快、易转移、复发率高等特点。大部分PLC由肝炎病毒感染发展形成,每年死于PLC的患者超过40万[1],显著高于西方发达国家。当前,治疗PLC的方法主要有手术切除、局部栓塞或消融和肝移植等[2, 3]。近些年,免疫治疗肝癌成为研究的热点[4]。Th17细胞和调节性T细胞(regulatory T cell,Treg)是CD4+T细胞亚群的一种,是肿瘤微环境的重要组成部分,在一定条件下这两种细胞相互转化以维持人体自身免疫功能的稳定,在抗肿瘤免疫过程中也发挥着重要的作用。越来越多的证据表明Th17/Treg细胞比值失衡促进了炎症和肿瘤进展,以调节Th17/Treg细胞比值平衡为靶点的免疫疗法为肝癌的治疗提供了新的策略[5-7]。本研究采用流式细胞技术检测了PLC患者外周血CD4+T、CD8+T及Tc17、Th17和Treg淋巴细胞,以了解它们的变化规律。
1 资料与方法
1.1 临床资料 2018年6月~2019年12月首都医科大学附属北京地坛医院诊治的PLC患者83例,男性46例,女性37例;年龄27~75岁,平均年龄为(45.1±7.3)岁。诊断参考《原发性肝癌诊疗规范(2017年版)》[8],采用巴塞罗那临床肝癌分期(BCLC 2010)[9],其中A期25例,B期23例,C期18例,D期17例。排除转移性肝癌及合并其他恶性肿瘤、有严重的心、肾疾病、失代偿期肝硬化、妊娠或哺乳期妇女。另选择同期35例健康体检者作为对照,男性23例,女12例;年龄25~73岁,平均年龄为(42.2±6.8)岁。本研究方案和研究内容已得到北京地坛医院医学伦理委员会的批准(批准号:京地伦科字[2018]第(028)-02号),患者签署知情同意书。
1.2 外周血CD4+和CD8T+淋巴细胞检测 取新鲜抗凝全血100 μL,加入流式管,加入抗CD3-FITC(Invitrogen,批号11-0037-42)、抗CD4-PE(Invitrogen,批号15-0041-82)、抗CD8-APC(Invitrogen,批号MHCD0805)鼠抗人单克隆抗体,充分混匀,4℃避光孵育45 min。加入红细胞裂解液2 ml, 避光孵育10 min,加入预冷流式缓冲液2 mL,洗涤,1500 r/m 离心5 min,弃上清,重复一次。加预冷2%多聚甲醛-PBS 300μL重悬,4℃避光保存,上机检测,分析外周血T细胞各亚群的比例。先根据前向散射角(FCS)和侧向散射角(SSC)确定淋巴细胞群,然后以CD3+设门,分析CD3+CD4+和CD3+CD8+T淋巴细胞亚群的百分率。
1.3 外周血Th17 细胞检测 采用密度梯度离心法分离肝癌患者外周血单个核细胞(PBMC),然后加入RPMI 1640培养基10 mL润洗,经室温1500 r/m离心[离心半径(r)=11.5 cm]10 min,去除淋巴细胞分离液;再次润洗PBMC;加入含10%FBS的1640培养基重悬细胞,计数,调整单细胞悬液为2×106/mL,取500 μL,均分入流式管、待用。调整每管细胞数为1×106个。于24孔细胞培养板,每孔加入1×106个细胞,加入含10%胎牛血清的1640培养基,至总体积为400μL,再加入PMA细胞刺激剂(终浓度为2μL/mL),37℃ CO2孵箱,刺激培养5 h。收集细胞,加入胞外抗CD4和抗CD8,室温避光孵育30 min,然后以PBS清洗细胞碎片和未结合抗体,加入A液100 μL固定,室温闭光15 min;加入PBS 2 mL,1200 r/m离心5 min,弃上清,加入B液50 μL,破膜,随后加入胞内抗IL-17A-FITC (Ebioscience,批号11-7179-42),上机检测。
1.4 外周血Treg细胞检测 采用密度梯度离心法分离外周血PBMCs,加入RPMI 1640培养基10 mL,经室温1500 r/m离心10 min,去除淋巴细胞分离液,润洗PBMC;加入RPMI1640培养基10 mL重悬细胞,取一部分用于表面染色。具体染色方案为:鼠抗人CD45RA(AF700)、抗CD3(BV786)、抗CD4(APC/FireTM750)、抗CD8(BV510)和抗CD25(PE-CF594),室温下避光30 min,然后上高端分析型流式细胞仪(BD LSRFortessa)检测。

2 结果
2.1 两组外周血CD4+、CD8+T淋巴细胞及CD4+/CD8+细胞比值比较 PLC患者外周血CD4+T淋巴细胞百分比和CD4+/CD8+细胞比值显著低于健康人(P<0.05,表1和图1)。
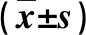
表1 两组外周血CD4+、CD8+T细胞及CD4+/CD8+细胞比值比较
与健康人比,P<0.05
2.2 两组外周血Th17、Treg细胞及Th17/Treg细胞比值比较 见表2、图2。
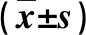
表2 两组外周血Th17、Treg细胞及Treg/Th17比值比较
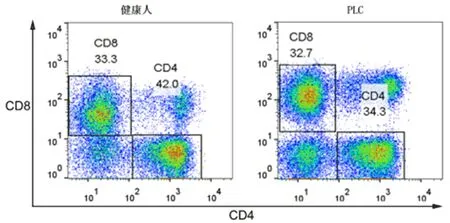
图1 两组外周血CD4+和CD8+T淋巴细胞百分比变化

图2 两组外周血Th17、Tc17和Treg细胞百分比变化
3 讨论
随着肿瘤免疫学研究的深入,提出了“肿瘤微环境”的概念。各种类型的细胞、周围基质、细胞因子、血管和淋巴管、肿瘤细胞及相关物理因素等共同构成了复杂的肿瘤内环境网络。肿瘤微环境与肿瘤的发生、发展和转移密切相关。研究报道,免疫细胞的失衡和慢性炎症反应是PLC形成的重要因素。CD4+T细胞主要可分化为Th1、Th2、Treg和Th17细胞4个亚群。在不同的免疫应答阶段,因局部微环境中细胞因子和炎性介质的不同而分化为不同的T细胞亚群,发挥不同的生物学功能。既往研究表明,肝癌的肿瘤微环境中存在大量的免疫细胞和炎性因子,肝癌组织免疫细胞亚群数量和表型与肝癌的发生发展及患者的预后密切相关[10, 11]。因此,研究肝癌肿瘤微环境免疫细胞的失衡能更准确地反映宿主的免疫功能状态,从而指导临床治疗。
CD4+T细胞和CD8+T细胞在抗肿瘤免疫反应过程中发挥不同的作用,其组成和功能等特征在一定程度上反映了机体抗肿瘤反应的性质和水平。本研究结果发现,PLC患者外周血CD4+T细胞水平显著降低,存在CD4+T与CD8+T比例的失衡。T淋巴细胞比例失衡改变了肿瘤的免疫微环境,从而有利于肿瘤细胞增殖、侵袭和转移。CD8+T 细胞中亦存在一群可分泌IL-17的细胞,并被命名为CD8+IL-17+细胞(Tc17)。Tc17细胞是一组与经典的CD8+T细胞不同的新亚型,其主要通过释放炎性细胞因子,如IL-17、IL-22和TNF-α等,从而诱发严重的免疫相关性疾病[12]。既往对Tcl7百分比和功能研究较少,但Tcl7在肝癌局部肿瘤微环境中同样发挥重要作用[13]。研究显示,Tc17细胞主要通过释放IL-17和TNF-α等细胞因子介导强大的促炎作用,促进肿瘤血管的生成,从而在肿瘤微环境中发挥重要作用[14]。本研究结果显示,PLC患者外周血Tc17(CD8+IL-17)细胞百分比显著升高,提示Tc17(CD8+IL-17)参与了肿瘤微环境的改变,与肝癌的发生密切相关。
Th17细胞是一种高分泌白介素-17(interleukin-17,IL-17)的CD4+T细胞亚群,由初始CD4+T细胞在TGF-β和IL-6联合作用下分化而来。Th17细胞作为重要的促炎反应细胞,可通过激活树突状细胞和T淋巴辅助细胞,诱导并激活多种细胞因子,维持慢性炎性反应状态,形成导致癌变的微环境[15]。此外,Th17细胞可分泌IL-17、TNF-α、IL-21等细胞因子,其中IL-17是一种重要的促炎细胞因子,可诱导其他趋化因子、促炎细胞因子和金属蛋白酶的表达,进一步加重炎性细胞浸润和组织损伤[16]。研究报道,Th17(CD4+IL-17)在肝癌和癌旁组织显著增多,参与了肿瘤的血管浸润,其分泌的IL-17可通过NFκB途径诱导金属蛋白酶(MMP)2和MMP9的表达,促进肿瘤侵袭和转移[17]。此外,另有研究显示高表达IL-17的肝癌细胞侵袭能力、转移能力更强,恶性程度也更高[18]。本研究中,肝癌患者外周血Th17(CD4+IL-17)细胞百分比显著升高,并且与肿瘤的分期密切相关,提示Th17(CD4+IL-17)参与了肝癌的发生发展,高水平的Th17(CD4+IL-17)预示更晚期的恶性肿瘤。
Treg细胞是初始CD4+T细胞在TGF-β独立诱导下分化而来,是一类具有免疫抑制效应功能的细胞,能调控机体免疫应答的强度,减轻免疫损伤,通过抑制抗肿瘤免疫应答介导免疫逃逸,从而促进肿瘤的进展[19]。研究显示,恶性肿瘤患者外周血Treg数量显著增加,一方面肿瘤组织中大量累积的Treg细胞通过激活CD69细胞和人类白细胞DR抗原抑制T细胞增殖及IFN-γ分泌;另一方面进一步破坏CD8+T细胞使之失去有效的抗肿瘤能力,促进肿瘤的恶性进展[20]。Treg细胞还可下调自然杀伤细胞表面活性受体D2并分泌抗炎因子TGF-β和IL-10,从而抑制NK细胞的抗肿瘤功能,介导肿瘤细胞的免疫逃逸[21]。本研究结果显示,PLC患者外周血CD4+CD25+CD45RA+Treg细胞比例显著高于健康人,且与肿瘤分期密切相关,提示在PLC的发病过程中存在Treg细胞增殖。
综上所述,PLC患者外周血淋巴细胞亚群存在免疫失衡,CD4+T、CD8+T、Tc17、Th17、Treg细胞比例失衡与患者肿瘤分期密切相关。从免疫学角度开展针对调节T淋巴细胞失衡的免疫治疗可能是抗肿瘤的有效策略。

