非酒精性单纯性脂肪肝与非酒精性脂肪性肝炎患者血清脂质组学比较*
王 琳,林雪松,丁 楠
非酒精性脂肪性肝病(nonalcoholic fatty liver disease,NAFLD)是一种常见的慢性肝病,我国NAFLD患病率大约为6%~38%[1]。NAFLD包括非酒精性单纯性脂肪肝(nonalcoholic fatty liver,NAFL)、非酒精性脂肪性肝炎(non-alcoholic steatohep atitis,NASH)、非酒精性脂肪性肝病相关肝硬化和肝细胞癌(HCC)。NASH为NAFL发展至肝硬化的必经阶段。若不能及时干预治疗,NASH将逐渐进展成为肝纤维化、肝硬化和HCC[2]。通常,NAFL为良性病变,发展较为缓慢,但有20%左右NASH患者在10年内可能会进展为肝硬化,其中8%患者可能死亡。此外,NASH也是导致肝移植或HCC发生的第二常见病因[3]。因此,早期明确NAFLD临床类型具有重要的意义。肝脏穿刺活检是诊断NAFLD的“金标准”,但存在创伤性、术后可能出现并发症等缺点,难以在患者病情动态监测过程中广泛应用[4]。脂质组学是一种对组织、细胞或者血液脂质进行研究的科学,能对阐明NAFLD发生、发展机制和寻找疾病诊断标志物提供有力的支持[5]。本研究分析比较了不同临床类型的NAFLD患者血清脂质组学的变化差异,现报道如下。
1 资料与方法
1.1 一般资料 2015年5月~2020年5月我院诊治的NAFLD患者199例,男性124例,女性75例;年龄为30~59岁,平均年龄为(47.8±9.0)岁。符合中华医学会肝病学分会脂肪肝和酒精性肝病学组以及中国医师协会脂肪肝专家委员会发布的非酒精性脂肪性肝病防治指南 (2018年版)的标准诊断[6]。其中NAFL患者107例,男性65例,女性42例;平均年龄为(47.0±8.8)岁;NASH患者92例,男性59例,女性33例;平均年龄为(48.7±9.5)岁。排除标准:(1)合并终末期肝病;(2)先天性肝脏疾病;(3)自身免疫性肝病、药物性肝损伤和酒精性肝病;(4)各种恶性肿瘤。本研究依据《赫尔辛基准则》开展,并通过我院医学伦理委员会审核,患者签署知情同意书。
1.2 临床资料的收集 收集患者基本资料、血常规、肝肾功能、血糖、血脂等实验室指标和Fibrotouch检测的肝脏硬度检测(LSM)和受控衰减参数(CAP)结果。
1.3 血清脂质组学分析 空腹采集静脉血,采用超高液相色谱(美国Waters公司,Waters ACQUITY UPLC I-Class液相系统)和Waters Xevo G2-S Q-TOF高分辨飞行时间质谱系统进行血清脂质组学分析。色谱条件:C18 CSH 色谱分析柱,柱温55℃,流动相A:乙腈和水比例为3:2;流动相B:异丙醇和乙腈比例为9:1;流动相A/B含有甲酸铵(10 mmol/L),线性梯度洗脱,流速为400μL/min,进样量为1μL。质谱条件:ESI离子源,全信息串联质谱(MSe)扫描模式。ESI选择正负离子扫描模式,参数如下:碰撞电压2500 v,锥孔电压40 v,离子源温度120℃,脱溶剂气温度500℃,脱溶剂气流量为900 L/h,锥孔气流量为50 L/h,采集质量数范围为m/z 100~2000,其中ESI+模式下m/z为556.2771,ESI-模式下m/z为554.2615,注入流率为10 μL/min。
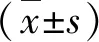
2 结果
2.1 两组一般资料比较 NASH患者血清ALT、AST、GGT、ALP、TG和LSM水平显著高于NAFL患者(P<0.05),两组WHR、BMI、TC、HDL、LDL、FBG和CAP比较,差异均无统计学意义(P>0.05,表1)。

表1 两组基线资料【】比较
2.2 脂质组学分析 基于UPLC-MS/MS方法对199例血清进行非靶向检测,共检测到2208个可定量的峰,去掉假阳性和噪音,最后检测到脂质596个,建立OPLSDA模型,模型参数R2=0.73,Q2=0.46,提示建立的OPLSDA模型稳定合理。同时,根据NAFL组和NASH组每个样本对应的积分建立OPLSDA散点得分图,样本坐标位于置信区间内且分散开来,表明NAFL组和NASH组患者血清脂质分布存在差异性(资料未列出)。
2.3 两组脂质组学比较 根据OPLSDA模型计算变量权重值VIP。当VIP>1,说明血清样品中存在明显浓度变化的脂类代谢物,最终发现223个物质VIP>1,其中共有59个脂类物质在NAFL组和NASH组差异存在统计学意义(P<0.05)。与NAFL组比,NASH组有3种FFA、2种DAG、16种TAG、2种PC、1种PS、2种LPE、2种CE、4种SM、3种Cer水平升高(P<0.05),3种FFA、1种TAG、3种PC、5种PI、5种PlsCho、7种PlsEtn水平降低(P<0.05,表2~4)。
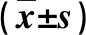
表2 两组差异脂质代谢产物比较
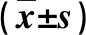
表3 两组差异脂质代谢产物比较
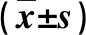
表4 两组差异脂质代谢产物比较
3 讨论
研究显示[7-10],胰岛素抵抗、炎症、氧化应激、脂毒性和胆汁酸毒性均与NASH发展存在联系。脂质代谢紊乱是NAFLD患者的一项重要特征,并与NAFLD从脂肪变性到NASH进展有关[11]。脂质组学作为一种广泛用于分析脂质代谢的分析技术,有助于寻找NAFLD相关生物标志物[12]。本研究发现,NASH组有3种FFA、2种DAG、16种TAG、2种PC、1种PS、2种LPE、2种CE、4种SM和3种Cer水平升高,而有3种FFA、1种TAG、3种PC、5种PI水平、5种PlsCho和7种PlsEtn降低,提示NAFL和NASH患者发生变化的脂质成分主要为甘油磷脂、TG和鞘脂。
甘油磷脂为生物膜的重要组成部分,在人体内以PC和LPE最为丰富[13]。一旦体内PC合成受阻,就会抑制极低密度脂蛋白胆固醇的分泌、释放,致使肝组织TG无法与其结合转运出肝脏,进而导致肝组织TG堆积,最终推动NAFLD的发生和发展[14]。文献[15]研究显示,PE浓度在健康对照、NAFL和NASH患者中逐渐升高,NAFL存在脂质代谢紊乱,而NASH更为明显。本研究中,有2种PC、2种LPE和1种PS水平升高,3种PC、5种PI水平降低。其原因可能与磷脂酰乙醇胺N-甲基转移酶功能出现障碍,进而抑制LPE转化为PC,导致LPE不断积累,增加LPE转化为PC有关。NAFLD患者TG所含饱和或者单不饱和脂肪酸相对含量与肝脏脂肪沉积程度呈正相关[16]。在本研究中,NASH患者TG水平高于NAFL,相比于NAFL,NASH患者有16种TAG、2种DAG、3种FFA水平升高,而有1种TAG和3种FFA水平降低,提示NASH患者脂质代谢紊乱更加严重。NASH患者DAG转移酶活性升高,导致TG在肝脏内积累。因此,DAG和TAG与NASH脂质水平变化密切相关,可能是推动NAFL向NASH进展的重要脂质信号分子。鞘脂不仅是细胞膜的组成成分,也可参与细胞内信号通路以及细胞增殖和凋亡的调节[17]。本研究中,与NAFL患者比,NASH患者有4种SM和3种Cer水平升高。报道[18]也指出,NASH患者Cer和神经酰胺相关种类水平显著高于NAFL患者。毒性脂质经β氧化后可产生大量的活性氧物质,进而损伤线粒体功能。同时,毒性脂质还会诱发内质网应激,刺激炎性细胞因子释放,造成肝功能损伤[19]。内源性抗氧化剂在预防或者延迟脂质氧化过程中发挥着重要的作用[20]。本研究中,NASH患者PlsCho和PlsEtn水平明显低于NAFL患者,提示氧化应激增强在NASH进展过程中起着重要的作用。总之,本研究表明NAFL和NASH患者血清脂质代谢发生了明显的变化,进而促使脂毒性的发生,导致NAFL进展为NASH。

