信息化监测模式对某三级甲等医院药品不良反应报告质量的影响
王 快,黎 丽,潘碚彬,方 健,危丽琴,罗崇彬
(1.广东省广州市花都区人民医院,广东 广州 510800; 2.中山大学附属第八医院,广东 深圳 518033;3.广东医科大学药学院,广东 东莞 523822)
医疗机构、药品生产企业和经营企业是报告药品不良反应(ADR)的主体[1]。为了减少ADR 对用药人群的危害,及时、有效地控制用药风险,我院积极开展ADR 报告与监测工作,但ADR 报告常存在信息填写错误、过程描述过于简单等问题,且新的或严重的ADR 上报率低,导致ADR 监测员不能快速、准确地识别药品安全信息。ADR 报表填写的真实性、规范性、完整性是ADR 信息可靠和有效的重要保证,是药品风险分析与评价的基础[2],尤其在当前开展对“4+7”药品[3-4]、国家谈判药品[5-6]进行招标采购的形势下,高质量的ADR 报告可作为此类重点关注药品风险预警的可靠数据支持[7]。为优化ADR 报告与监测的工作流程,提高ADR 报告的质量,给临床用药风险预警及时提供可靠的资料,我院于2016 年实施ADR 信息化监测模式。本研究中分析了开展信息化监测模式前后ADR 原始报表的真实性、规范性及完整性,探讨信息化建设对三级甲等医院ADR报告质量的影响。现报道如下。
1 资料与方法
1.1 资料来源
收集我院开展信息化监测前(2011年至2015年,监测前)的ADR 纸质报告1 150 份,开展信息化监测后(2016年至2020年,监测后)的ADR原始电子报告1 227份。
1.2 质量评估标准与方法
根据《药品不良反应报告和监测管理办法》(卫生部令第81 号)、国家药品不良反应监测中心发布的《药品不良反应病例报告质量评估指导意见(试行)》制订ADR报告质量的真实性、规范性和完整性评估项目。
真实性:通过ADR 原始报告表的信息追查患者的住院病程记录、护理记录、医嘱、门诊病历记录、处方、检验检查、体温单等医疗记录,有相关记录的ADR 报告判断为真实报告。
规范性:评估内容包括ADR 报告类型、报告时限、ADR 名称、药品通用名称、剂型、生产厂家、生产批号、用法用量、用药原因、原患疾病、关联性评价和ADR 分析,统计分类主要为规范填写、未填写、填写错误、填写不完整、填写为“不详”等。
完整性:评估内容主要为ADR 过程描述及其处理情况和患者信息等其他项目,包括原患疾病描述、用药情况、ADR 发生时间、干预时间、ADR 终结时间、出现ADR 的症状及体征、辅助检查、病情动态变化、干预措施、转归等,统计分类主要为填写、未填写、填写不完整。
根据《三级医院评审标准(2020 年版)》(国卫医发〔2020〕26 号)和《三级综合医院评审标准实施细则(2011年版)》(卫办医管发〔2011〕148号)三级甲等综合医院评审条款要求,患者发生的ADR 应被如实记入病历中。我院ADR 报告和监测管理制度规定,住院患者的病程记录和门诊患者的门诊病历均应记录患者发生的ADR,病案首页应记录发生过敏反应的药物。因此,病历是否记录患者发生的ADR,病案首页是否记录患者发生过敏反应的药物,同样作为本次ADR 报告质量评估的项目之一,统计分类为是、否。
1.3 统计学处理
采用Excel 2019 软件整理数据,采用SPSS 24.0 统计学软件分析。若存在1 个或1 个以上小于5 的期望计数,采用Fisher's 精确检验(双侧),否则采用Pearsonχ2检验(双侧);纸质报告表与电子报告表的组间数据比较中,其中一个类型作为一个变量,其余类型的合计值作为另外一个变量,如批准文号规范填写的ADR 报告例数与不规范填写的(包括未填写、填写不完整、填写错误、不详)ADR 报告例数的前后数据比较。计数资料以率(%)表示,行χ2检验。P<0.05 为差异有统计学意义。采用品管圈质量管理工具柏拉图进行根因分析。
2 结果
2.1 真实性评估
根据真实性评估标准与方法,监测前后的ADR 原始报告表均可溯源,在医院电子病历系统中均可查询到相关信息记录,未发现虚假报告。
2.2 规范性评估
报告类型:目前,我院ADR 报告类型长期以已知的一般ADR报告为主,监测前后分别为67.91%(781/1 150)和61.78%(758/ 1 227);新的或严重的ADR 报告比例偏低,无死亡病例。新的或严重的ADR 报告比例由32.09%(369/1 150)升至监测后的38.22%(469/1 227),监测前后差异有统计学意义(P=0.002)。
报告时限:已知的一般ADR 报告超时上报率由监测前的5.63%(44/781)降至监测后的3.43%(26/758),差异有统计学意义(P=0.038);但新的或严重ADR 超时上报率由监测前的25.75%(95/ 369)升至监测后的29.64%(139/469),差异无统计学意义(P=0.212)。
药品信息:开展信息化监测后,ADR 报告表中的药品信息规范填写比例均大幅上升。详见表1。
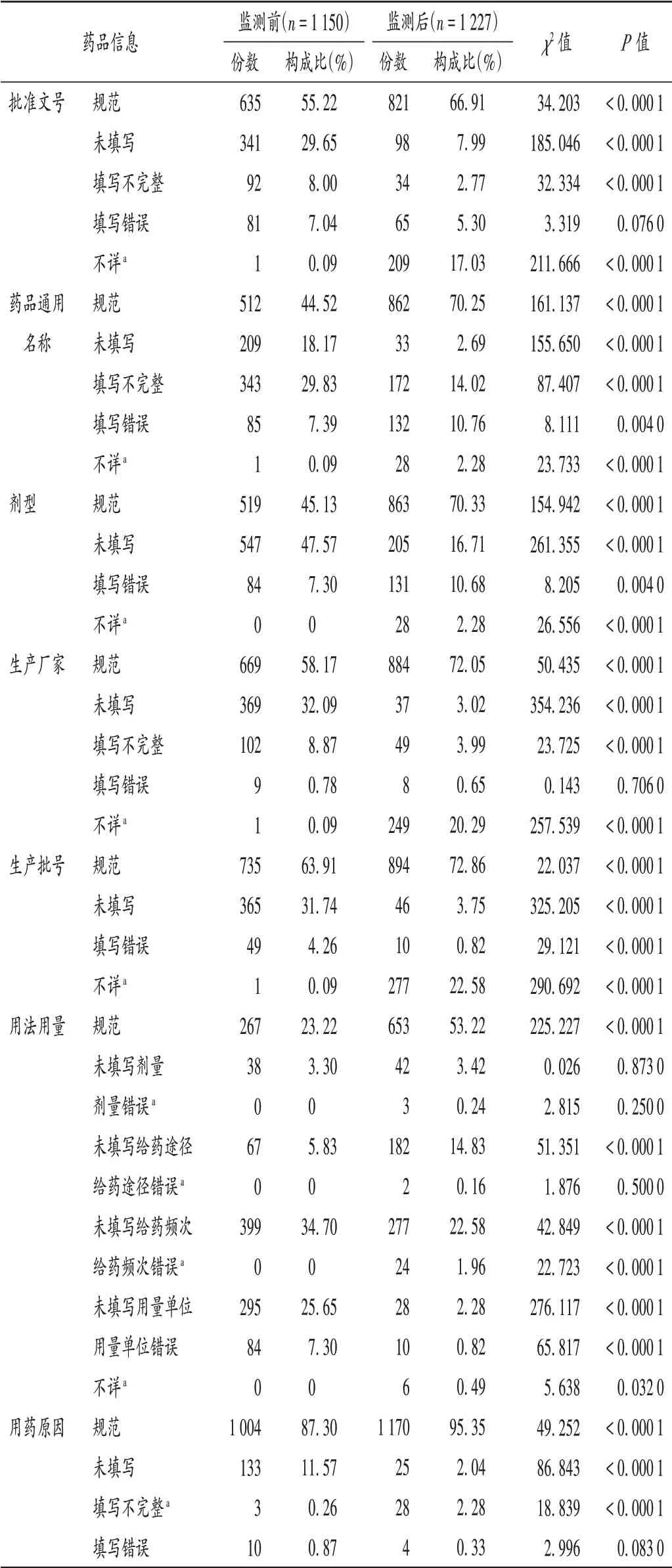
表1 药品信息填报的规范性评价Tab.1 Normative evaluation of drug information filling
其他规范性评估项目:与监测前相比,监测后的ADR 报告类型、ADR 名称、原患疾病、ADR 分析及关联性评价的规范填写比例均明显提高(P<0.05),但ADR报告类型、ADR 分析和关联性评价填写错误的构成比也明显提高(P<0.05)。详见表2。
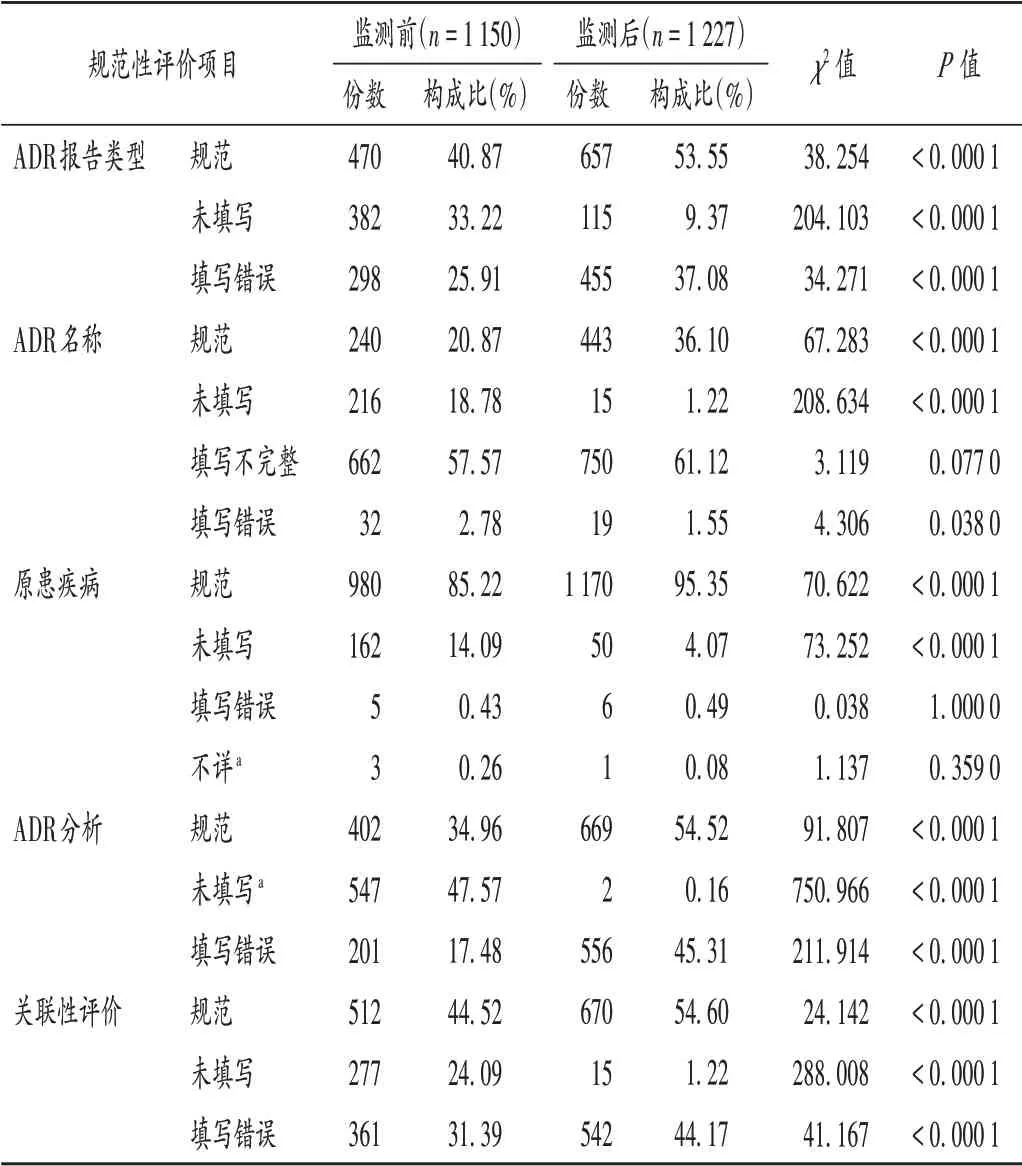
表2 其他信息填报项目的规范性评价Tab.2 Normative evaluation of filling items of the other information
2.3 完整性评估
监测后,患者信息完整填写率为93.24%(1 144/1 227),显著高于监测前的61.57%(708/ 1 150),差异有统计学意义(P<0.01);但原患疾病完整填写率较低,且改善不明显。与监测前比较,ADR/ 药品不良事件(ADE)过程描述中,监测后的ADR 干预措施和干预时间填写的完整性均明显提高(P<0.05);但原患疾病描述、病情动态变化、ADR 终结时间、转归等描述的完整性并未明显改善(P>0.05)。详见表3。
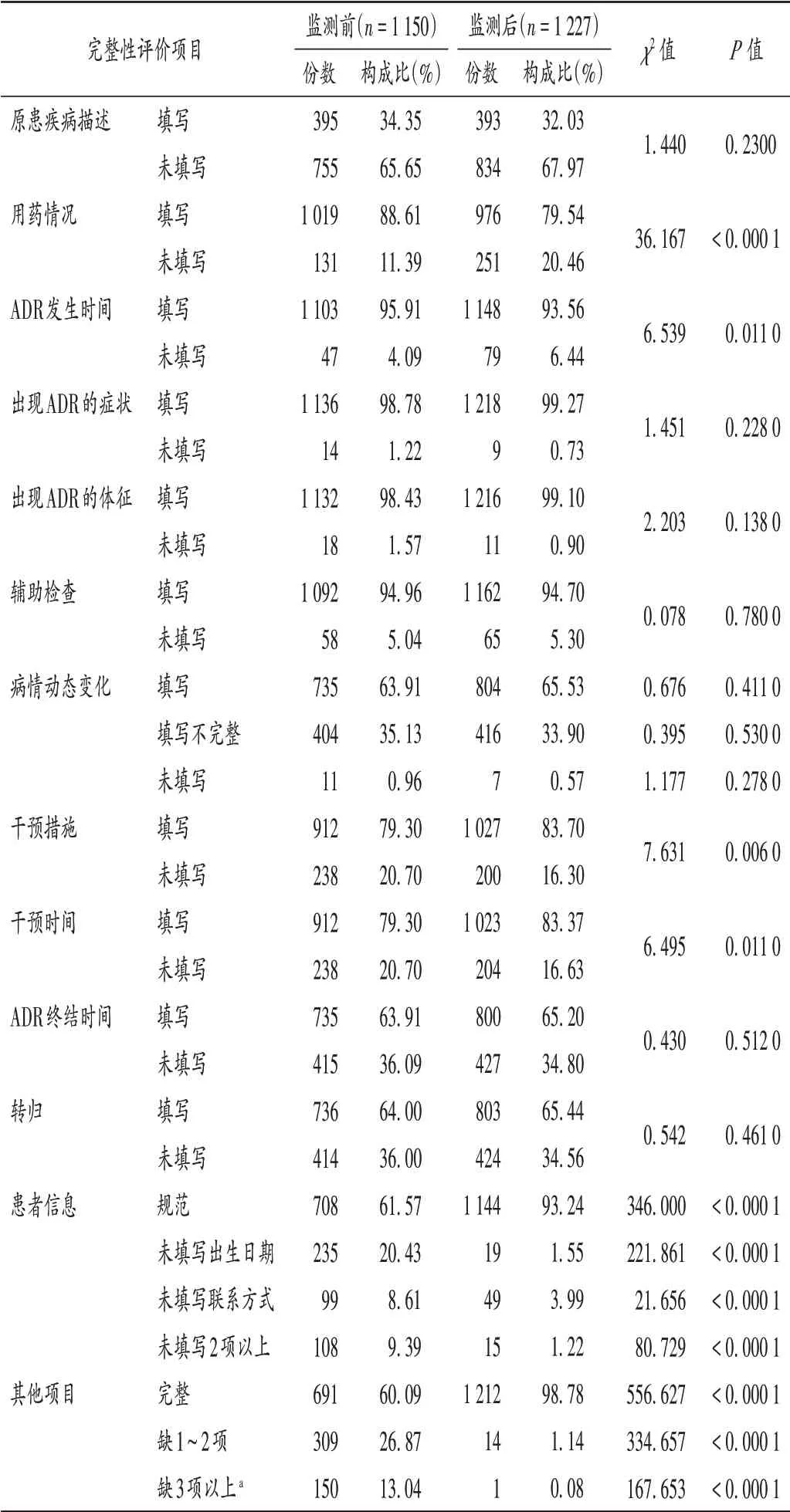
表3 ADR报告表填写完整性评价Tab.3 Evaluation of the completeness of ADR reports
2.4 病历记录ADR 和病案首页记录过敏反应药物的评估
监测后,ADR被记录在住院患者病程记录或护理记录、门诊患者的病例记录的比例为91.93%(1 128/1 227),明显高于监测前的55.83%(642/ 1 150);住院患者病案首页记录过敏反应药物的比例为80.07%(434/ 542),明显高于监测前的53.39%(362/ 678),差异有统计学意义(χ2=406.96,94.565,P<0.000 1)。
2.5 ADR 报告表规范性和完整性填写较差的根因分析
监测后,我院ADR 报告表中ADR 报告类型、ADR名称、原患疾病、ADR 分析及关联性评价填写的规范性虽有改善,但占比仍较低;ADR 报告表完整性评价项目中只有ADR 干预措施和干预时间填写的完整性较前改善,其他项目无明显改善,甚至还较前降低。
通过统计非规范性填写的项目,并采用质量管理工具绘制影响我院ADR 电子报告表填写规范性的主要原因分析柏拉图[8],根据80/ 20 法则[9],发现ADR 名称、用法用量、ADR 报告类型、ADR 分析、关联性评价、批准文号、药品通用名称、剂型未规范填写的累计百分比为84.10%,为当前ADR 报告规范性评价项目中需要重点改善的项目。另外,考虑生产厂家与生产批号未规范填写的数量也较多,且与药品通用名称、剂型等有一定关联性,故生产厂家与生产批号也被纳入改善的重点(见图1)。按同样的方法分析发现,原患疾病描述、ADR 终结时间、转归、病情动态变化、用药情况、干预时间、干预措施未规范填写的累计百分比为84.73%,为当前影响ADR电子报告表完整性的主要原因(见图2),是需要重点改善的项目。
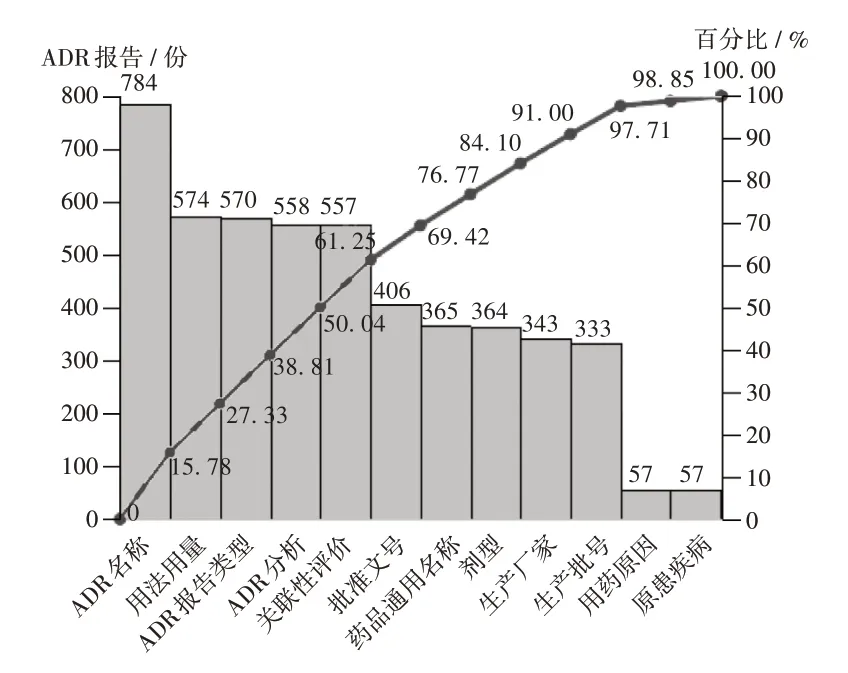
图1 影响ADR电子报告表填写规范性的主要原因分析Fig.1 Main reasons affecting the standardization filling of ADRelectronic reports
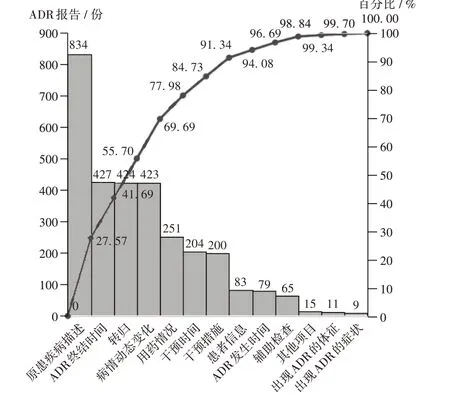
图2 影响ADR电子报告表填写完整性的主要原因分析Fig.2 Main reasons affecting the completeness filling of ADR electronic reports
针对上述需改善的重点项目,ADR 监测员深入临床调查原因,并与医院ADR 报告与监测小组成员开展头脑风暴,认为影响我院信息系统填写ADR 报告规范性和完整性的原因主要有:1)药物信息填写不规范,如漏填或错填药品通用名称、批准文号、用法用量、剂型等,主要由上报人理解错误、上报不认真或药物信息丢失等引起。如批准文号填写为生产批号,药品通用名称填写为商品名称,或大部分药物信息均填写“不详”等;2)错填ADR 类型、ADR 分析、关联性评价,主要与上报人缺乏判断ADR 的专业知识有关;3)未完整填写ADR过程描述及其处理情况,主要与上报人不熟悉ADR 相关知识、缺乏统一培训、态度不严谨有关;4)未严格落实医院奖惩制度。
3 讨论
3.1 信息化监测模式的建立优化了工作流程
ADR 上报与监测工作中存在的效率低、监测信息接收不完整等问题,对安全用药的隐患极大,我院药学部联合网络中心紧跟国内医疗机构信息化建设步伐,联合第三方信息公司成功上线ADR 上报系统。开展信息化建设前,临床上报ADR 需填写纸质报告表,并将其送至药学部ADR 监测专员处,再由ADR 监测员调查、分析后上报至国家ADR 监测网,耗时较长,超时上报的现象时有发生,上报人与ADR监测员交流不便,且ADR纸质报告表填写字迹潦草,难以辨认,ADR 报告表整体质量较差。针对存在的问题,我院于2016年开始通过信息系统直接上报ADR,杜绝了纸质版ADR 报告表填写字迹潦草、难以辨认的弊端。另外,通过ADR 上报系统,监测员可第一时间接收到ADR 的上报信息,对于报告表缺项、填写错误、填写不完整、病历未记录ADR、病案首页未填写过敏反应药物等问题,可直接在ADR 上报系统与上报者沟通交流,为ADR 报告的上报节约了大量时间,也可让ADR 监测员有针对性地深入临床着重调查新的或严重ADR,加强ADR专业知识培训,大大减轻了ADR 报告与监测工作的负担。同时,提高了医务工作者对新的或严重ADR的认识,ADR报告与监测意识,以及新的或严重ADR 上报率,加强了用药风险监测。ADR 上报系统具有与国家药品不良反应上报系统一键上传的接口,可大大提升监测员的工作效率。
3.2 持续改进措施
加强信息化建设:针对需要重点改善的ADR 报告表中规范性和完整性填写项目,全面升级ADR 上报系统,通过与医院信息系统、药库系统对接,患者基本信息可直接被导入ADR 上报系统,且可在ADR 上报系统中查询近1,3,6,12 个月的药品出库信息,上报者在核对相关信息无误后,可直接导入药品的批准文号、生产厂家、生产批号、商品名称等信息。针对ADR 过程描述及其处理情况填写不完整的问题,ADR 上报系统直接嵌入模板,提示医师完整描述原患疾病、用药情况、ADR 发生时间、出现的症状和体征、辅助检查、病情动态变化、干预措施、干预时间、ADR 终结时间、转归。同时,ADR 上报系统填写的过程描述及其处理情况可直接导入病历系统,而病历系统记录的ADR 可直接导入ADR 上报系统,避免重复书写。另外,ADR 上报系统直接与国家ADR 监测网对接,大大提高了ADR 上报与监测工作的效率。我院ADR 上报系统还建立了修改功能和预警功能模块,监测员对ADR 进行调查分析后,可对ADR 报告表中填写不完整或填写错误的项目进行修改,并保留修改痕迹,以供上报者参考。无法提交存在未填写项目的ADR 报告表,并提示上报者完善相关项目。预警功能主要针对病历出现ADR 记录或医嘱开具抗过敏药物等ADR 相关信息时,可定时向临床工作者发送ADR上报提示,督促临床医务人员及时上报ADR,避免漏报、瞒报、超时上报等。通过信息化建设,尽早实现主动监测ADR[10-11]。
贯彻落实相关规章制度:通过数据分析发现,我院ADR 总体超时上报的比率虽有下降,但改善不明显,尤其是新的或严重ADR 超时上报。通过分层统计发现,ADR 发生后的24 h 内或72 h 内上报的比率较前明显下降。为进一步降低ADR 超时上报比率,我院《药品不良反应报告和监测管理制度》规定一般的ADR 应由医护人员在72 h内填写《药品不良反应/事件报告表》上报,ADR 监测员应在ADR 发现之日起30 日内上报至国家ADR 监测网;新的或严重ADR 由医护人员在24 h 内上报,ADR 监测员应在ADR 发现之日起15日内上报至国家ADR监测网;由于ADR导致死亡的严重事件应立即上报。同时,贯彻落实奖惩制度,对于真实发生的、规范完整填写的ADR报告,我院每例奖励上报者30元;对于发现ADR但未上报者,每例扣罚100元。通过信息化建设与具体机制相结合,共同促进我院医疗质量与安全。
加强ADR专项培训:针对我院医务工作者对ADR上报与监测工作认识的不足,ADR上报积极性不佳,上报时报表内容填写不规范、不完整等问题,ADR上报与监测工作小组制订并落实院内ADR 专项培训计划,包括每年一次的新晋人员、进修生、实习生的ADR 专题培训,每年2次的院内全员培训及各科室不定期的相关培训等,要求培训组织部门做好相关培训记录,且不定期进行督导检查,切实加强了医务工作者对ADR的深入认识。
3.3 小结
病历记录是防止伪造虚假ADR 报告,检验其真实性的指标[12]。病案首页记录患者过敏性药物能让医护人员快速了解患者的过敏史,尤其是在紧急抢救时可避免使用过敏性药物,预防ADR 发生,进而保障用药安全。ADR 报告的真实性、规范性、完整性是报表质量的基础,直接影响ADR 的监测水平[13-14]。提高ADR 报告与监测水平是我国三级甲等综合医院评审标准的核心指标,是药事管理持续改进的重要内容,更是提高医疗质量安全的关键环节[15]。通过开展ADR 信息化监测,我院ADR 报告质量明显提高,但个别ADR 评价项目仍需进一步改善。

