低温胁迫对不同品系暗纹东方鲀肠道微生物群落结构的影响
汪倩,翟万营,韩爽,朱新鹏,涂翰卿,陈良标*
(1.上海海洋大学 水产种质资源发掘与利用教育部重点实验室,上海 201306;2.上海海洋大学 海洋生物科学国际联合研究中心,上海 201306;3.江苏中洋集团股份有限公司,江苏 海安 226600)
鱼类是水生变温动物,温度变化对其生理和行为有着深远的影响[1-2]。低温会导致细胞的结构、功能、脂质代谢,以及蛋白质的折叠、组装和稳定性发生改变[3]。当温度低于鱼类最适生存温度时,鱼类新陈代谢速度减慢,导致其捕食、躲避敌害等能力降低;而温度急剧下降(如寒潮)或出现极端低温时,可能导致鱼类行为紊乱、侧翻或昏迷[4-5]。近年来,寒潮给中国水产养殖业造成巨大经济损失,其过境后,最低气温可能会下降到4 ℃以下,引起水温水质的剧烈变化,导致中国南方鱼类养殖大面积死亡现象的发生[6-7]。同时,极端低温不仅会导致鱼类出现严重冻伤、冻死现象,还会诱发鱼类感染水霉、寄生虫并暴发鱼类流行病[8-9]。研究发现,牙鲆Paralichthysolivaceus在低温条件下更易感染病毒性出血败血症病毒,死亡率显著升高[10]。此外,温度变化还会改变鱼类的栖息和产卵区域,对食物网和渔业产量造成严重影响[11-12]。
低温也会影响鱼类肠道微生物群落结构。Hagi等[13]研究发现,鱼类肠道内乳酸菌的丰度与水温紧密相关,在夏季(水温大于20 ℃),乳酸乳球菌Lactococcuslactis丰度较大,而在冬季(4~10 ℃),棉子糖乳球菌Lactococcusraffinolactis占优势。温度的剧烈变化会加剧鱼类肠道微生物群落中病原菌和非病原菌间的竞争,破坏肠道微生物菌群的平衡[14]。当温度从26 ℃急剧下降到18 ℃时,罗非鱼Oreochromsmossambcus肠道内弧菌Vibriospp.的丰度显著增加,黄杆菌Flavobacterium的丰度则显著降低,肠道微生物可以通过促进能量需求的调节,提高宿主对低温的适应[15-16]。鱼类作为变温动物,其体温通常受水温影响,一些鱼类相对更能耐受寒冷的环境,但目前尚不清楚其肠道微生物是否也会受到低温胁迫的影响。
河鲀是中国重要的淡水养殖鱼类,在2018年,中国淡水养殖的河鲀已达到1.271 万t,其中暗纹东方鲀Takifugufasciatus养殖量较大[17-18]。中国暗纹东方鲀养殖主要分布于南方,大部分集中在广东、江苏、安徽等地[19]。目前,中国河鲀养殖过程中,工厂化养殖能维持河鲀冬季生长,但成本高、发病率高,而成本低、效益好的土地养殖和网箱养殖却无法维持河鲀越冬,因此,培育良好耐寒特性的河鲀品种成为中国河鲀养殖的关键因素[19]。
本研究中,以江苏中洋集团南通和广州养殖基地采集的暗纹东方鲀为研究对象,比较了两个品系在不同程度低温胁迫下肠道微生物群落组成的差异,以探究低温胁迫对不同品系暗纹东方鲀肠道微生物的影响,以期为解析这些肠道微生物对宿主适应耐寒(低温)机制提供科学依据。
1 材料与方法
1.1 材料
试验用耐寒型和野生型暗纹东方鲀分别取自江苏中洋集团南通龙洋水产有限公司养殖基地和中洋渔业发展(广东)有限公司养殖基地,耐寒型暗纹东方鲀是由江苏中洋集团培育的具有稳定遗传耐寒性状的品系“中洋1号”(“Zhongyang No.1”)暗纹东方鲀(以下简称“中洋1号”),该品系在水温7 ℃时也能稳定存活,最低耐受温度可以低至5 ℃,养殖水温为24 ℃;广州养殖基地所饲养的为不耐寒的野生型暗纹东方鲀(以下简称“野生型鲀”),养殖水温为26 ℃。
1.2 方法
1.2.1 试验设计 分别从两个养殖基地各取20尾体质量为300 g左右的暗纹东方鲀,将从养殖基地取回的暗纹东方鲀放在24 ℃培养箱(恒温恒湿箱 HWS-1000,宁波江南仪器厂 )中适应5 d,从每个品系中各取3尾以上暗纹东方鲀进行解剖,提取肠道内容物;从第6天开始,以0.5 ℃/h的速度降温,直至降至4 ℃,其中,分别在17、10 ℃下各维持6 h,并分别在17、10、4 ℃时,提取肠道微生物样品,其中,野生型鲀温度试验组分别记为WT_24、WT_17、WT_10和WT_4,“中洋1号”温度试验组分别记为ZY_24、ZY_17、ZY_10和ZY_4。具体试验设计如图1所示。
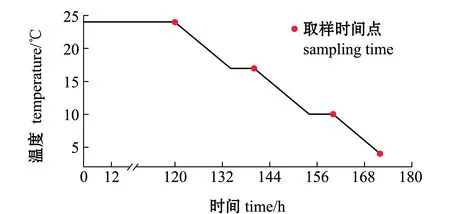
图1 低温处理示意图及取样时间点Fig.1 Schematic diagram of cold treatment and the sampling time
1.2.2 肠道微生物的提取 使用FastDNA SPIN Kit for Feces(MP Biomedical)试剂盒,按照说明书对暗纹东方鲀肠道内容物的微生物群落进行细菌总DNA提取。设计16S rDNA引物进行PCR扩增,其上、下游引物序列分别为338F(5′ACTCCTACGGGAGGCAGCA 3′)和806R (5′GGACTACHVGGGTWTCTAAT 3′),其由生工生物工程(上海)股份有限公司合成。PCR反应体系(共20 μL):模板DNA 2 μL,上、下游引物各1 μL,2×Taq PCR Mix 10 μL,ddH2O 6 μL。PCR扩增程序:95 ℃下预变性5 min;95 ℃下变性30 s,55 ℃下退火30 s,72 ℃下延伸30 s,共进行29个循环;最后在72 ℃下再稳定延伸10 min。将提取的DNA送上海美吉生物医药科技有限公司进行高通量测序。
1.3 数据统计和生物信息学分析
在97%的相似水平下,使用Uparse 7.1软件对所有序列进行OTU聚类,并进行生物信息学分析。每个采样时间点选3个重复性一致的样品,对所有测序数据过滤后进行抽平归一化处理,统计相对应的OTUs,绘制稀释曲线(rarefaction curve)。为比较不同品系及不同温度处理的暗纹东方鲀肠道微生物差异,根据其共有和独有的OTUs分别绘制Venn图。
使用Mothur 1.30.1计算不同温度处理的两个品系暗纹东方鲀肠道微生物Alpha多样性指数(Chao1、Shannon和Simpson),并通过t-test比较两个品系在不同温度下的微生物群落丰富度和多样性差异,计算结果以平均值±标准差表示。
采用RDP Classifier贝叶斯算法对OTU代表序列进行分类学分析,分别在门和属水平上比较两个品系的暗纹东方鲀肠道微生物差异,在属水平上比较不同温度处理的暗纹东方鲀肠道微生物丰度变化。在属水平上,通过主成分分析(PCA)和非度量多维尺度分析(NMDS)比较两个品系暗纹东方鲀肠道菌群的组成差异。
基于蛋白质直系同源簇(COG)数据库对两个品系的暗纹东方鲀肠道微生物进行PICRUSt1功能预测。所有的生物信息学分析都通过上海美吉生物云(cloud.majorbio.com)在线平台进行分析。
2 结果与分析
2.1 稀释曲线
对测序数据进行抽平分析,“中洋1号”和野生型鲀肠道微生物的稀释曲线趋于平缓,说明测序数据量满足后续生物信息学分析(图2)。

图2 野生型(WT)和“中洋1号”(ZY)暗纹东方鲀肠道微生物样品测序稀释曲线Fig.2 Rarefaction curves of gut microbiome sequencing of wild-type(WT)and “Zhongyang No.1”(ZY)obscure puffer Takifugu fasciatus
2.2 微生物物种多样性
从整体上看,野生型鲀肠道微生物OTUs数目多于“中洋1号”(分别为322和311)。不同温度处理的野生型和“中洋1号”暗纹东方鲀肠道微生物共有28个OTUs,随温度降低,野生型鲀肠道微生物OTUs数目逐渐增多,而“中洋1号”肠道微生物OTUs数目则呈先增加后减少的趋势(图3)。在24、10、4 ℃下,野生型鲀肠道微生物OTUs数目(分别为139、163、170)多于“中洋1号”(分别为125、150、122),而在17 ℃时,“中洋1号”肠道微生物OTUs数目(170)则多于野生型鲀(157)。

图3 野生型鲀和“中洋1号”肠道微生物群落组成Venn图(OTU水平)Fig.3 Venn diagram of gut microbiome community of wild-type and “Zhongyang No.1”obscure puffer Takifugu fasciatus (OTU level)
2.3 Alpha多样性
对不同程度低温应激处理的“中洋1号”和野生型鲀肠道微生物进行Alpha多样性分析,结果显示,覆盖率(coverage)均超过99.9%,其中,Chao1、Simpson和Shannon指数在每个温度下均表现出相同的变化趋势(表1)。Chao1指数显示:在每个温度下,野生型鲀的Chao1指数均高于“中洋1号”,但无显著性差异(P>0.05);随着温度降低,两个品系的肠道微生物Chao1指数变化不大,但温度从24 ℃降至17 ℃时,野生型鲀的微生物丰富度略有升高,而在“中洋1号”中,温度从17 ℃降至4 ℃过程中,肠道微生物丰富度呈降低趋势(表1)。
Simpson和Shannon指数显示:在每个处理温度下野生型鲀Simpson指数均低于“中洋1号”,而Shannon指数则相反;随着温度降低,“中洋1号”肠道微生物的Simpson和Shannon指数总体上均无显著性变化(P>0.05),而在17 ℃时,与24 ℃相比,野生型鲀肠道微生物的Simpson指数显著性降低(P<0.05),Shannon指数显著性升高(P<0.05)(表1)。
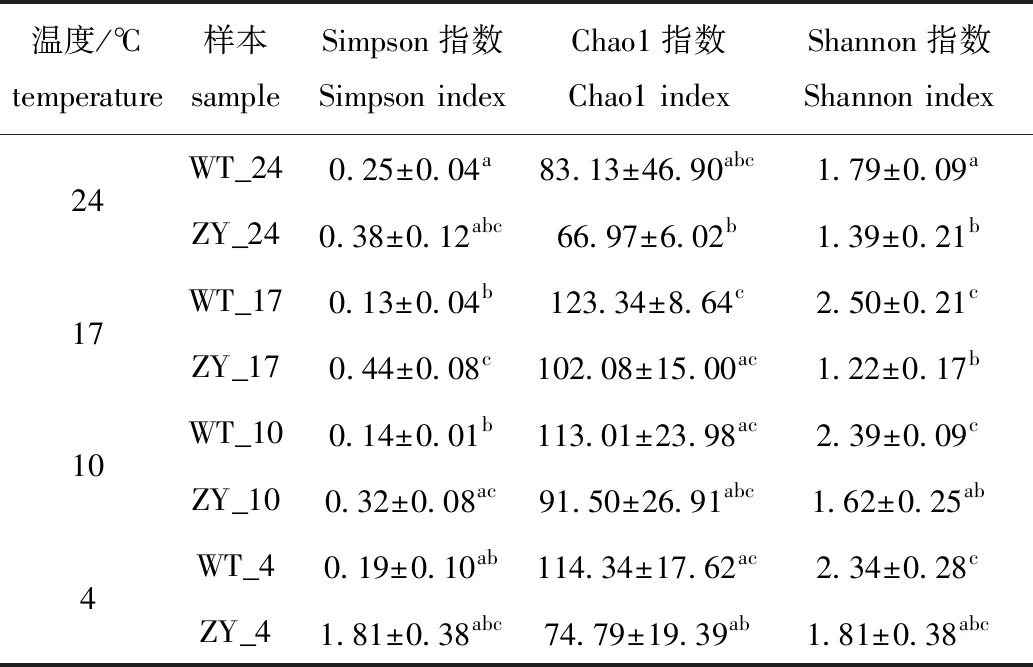
表1 野生型和“中洋1号”暗纹东方鲀肠道微生物的Alpha多样性指数Tab.1 Alpha diversity index of gut microbiome of wild-type and “Zhongyang No.1”obscure puffer Takifugu fasciatus
2.4 微生物群落组成分析
总体上看,两个品系的暗纹东方鲀肠道微生物群落中主要细菌组成相似,但不同细菌间丰度差异较大。从图4可见:在门水平上,暗纹东方鲀肠道微生物主要优势细菌门包括变形菌门Proteobacteria、Campilobacterota、拟杆菌门Bacteroidota和螺旋体门Spirochaetota,“中洋1号”肠道微生物中变形菌门丰度显著低于野生型鲀;在属水平上,野生型鲀肠道中主要为希瓦氏菌属Shewanella(28.14%)、弓形杆菌norank_f_Arcobacteraceae(13.95%)、伊丽莎白金菌属Elizabethkingia(12.71%)、螺旋体属Brevinema(10.06%)、假单胞菌属Pseudomonas(7.65%)、气单孢菌属Aeromonas(5.10%)和弧菌属Vibrio(3.98%),而在“中洋1号”肠道微生物中,主要为弓形杆菌(43.33%)、希瓦氏菌属(10.56%)、螺旋体属(14.09%)、伊丽莎白金菌属(11.40%)和气单胞菌属(4.77%),“中洋1号”肠道微生物中与暗纹东方鲀毒素相关的细菌(如嗜水气单胞菌Aeromonashydrophila、霍乱弧菌Vibriocholera)等丰度显著低于野生型鲀。
不同程度的低温胁迫对两个品系暗纹东方鲀肠道微生物具有重要影响。从图5可见:在不同温度下,野生型鲀肠道微生物群落中希瓦氏菌属丰度均始终大于“中洋1号”,而弓形杆菌丰度均小于“中洋1号”;在24 ℃和17 ℃时,野生型鲀肠道内伊丽莎白金菌属丰度大于“中洋1号”,当温度降低至4 ℃时,其丰度则小于“中洋1号”;在24、17、10 ℃时,“中洋1号”肠道内螺旋体属丰度均大于野生型鲀,但当温度降低至4 ℃时,其丰度则小于野生型鲀。

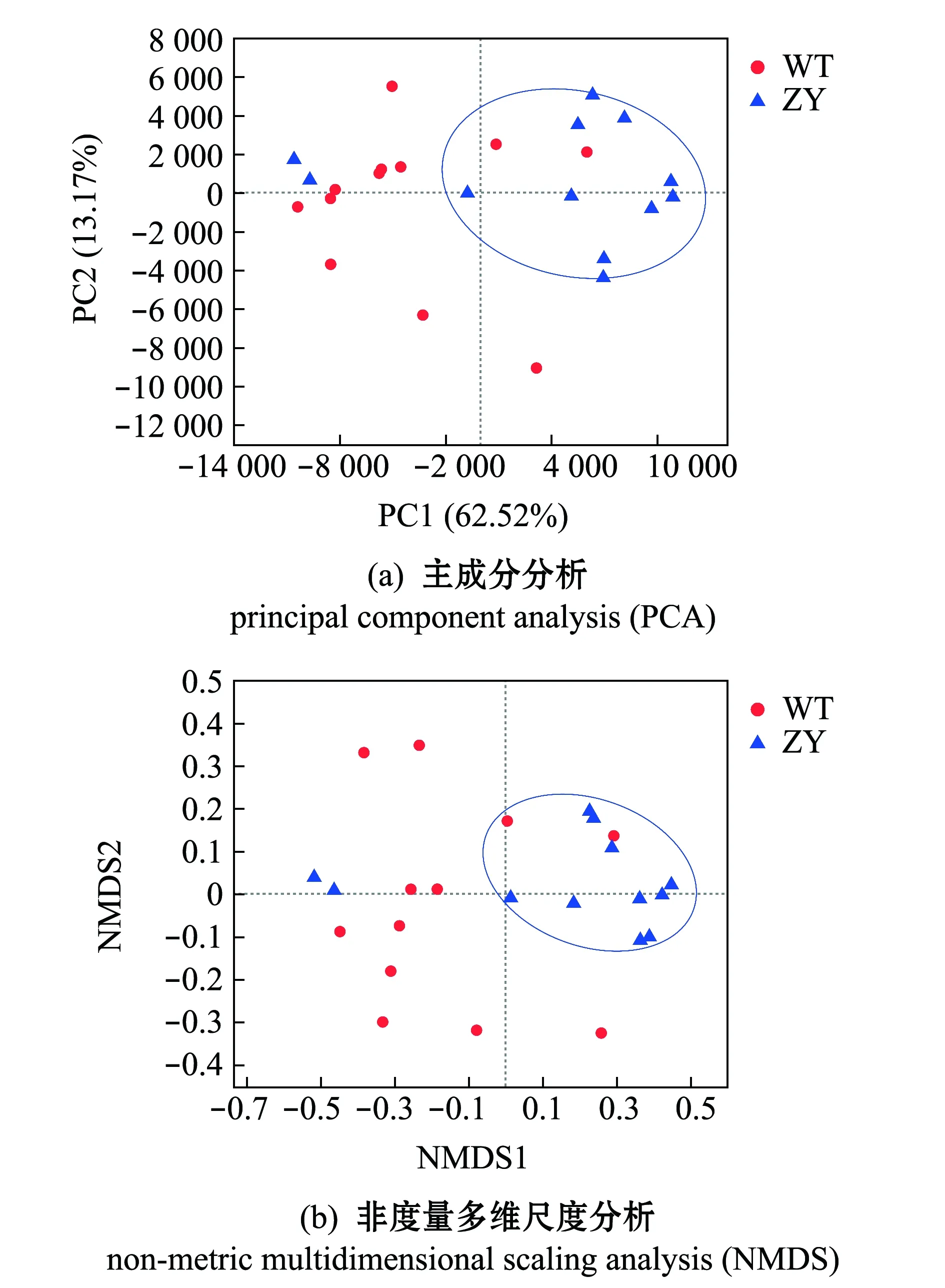
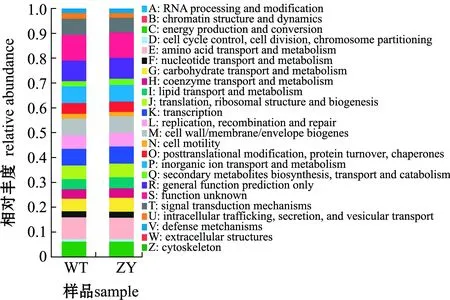
不同处理间的差异0.01 图5 野生型和“中洋1号”暗纹东方鲀肠道微生物属水平群落组成Fig.5 Community composition of gut microbiome of wild-type and “Zhongyang No.1”obscure puffer Takifugu fasciatus on genus level 对两个品系暗纹东方鲀肠道微生物进行主成分分析(PCA),结果显示,主成分PC1、PC2方差贡献率分别为62.52%、13.17%,“中洋1号”肠道微生物样品间距离较近,呈明显聚类,而野生型鲀肠道微生物呈无规律分布(图6(a))。同时,采用非度量多维尺度分析(NMDS)对PCA分析结果进行验证,也显示相似的结果,“中洋1号”肠道微生物聚为一簇,野生型鲀肠道微生物呈无规律分布(图6(b))。 图6 基于属水平的主成分分析和非度量多维尺度分析Fig.6 Principal component analysis and non-metric multidimensional scaling analysis on genus level 基于肠道微生物测序结果和COG数据库对两个品系的肠道微生物进行PICRUSt1功能预测。结果显示:在两个品系的暗纹东方鲀中,具有氨基酸转运与代谢(amino acid transport and metabolism)、转录(transcription)、无机离子转运与代谢(inorganic ion transport and metabolism)等功能占比较高;此外,与野生型鲀相比,“中洋1号”肠道中,具有碳水化合物运输与代谢(carbohydrate transport and metabolism)、脂质转运与代谢(lipid transport and metabolism)等12个功能丰度增加(图7)。 宿主对肠道微生物组成有显著性影响,不同种鱼的肠道微生物群落组成和结构不同,而在同一种鱼中,肠道微生物也会随着摄食条件、环境条件(温度、pH、环境污染等)的改变而发生变化[20]。此外,即使在相同环境中,同一种鱼的肠道微生物也有可能因为营养状态、发育阶段的不同而有所差异[21-22]。本研究中,野生型鲀肠道微生物OTUs显著高于“中洋1号”,这可能与其养殖环境水温较高、肠道微生物更丰富有关[23]。Erwin等[23]研究发现,在海绵中,其微生物群落呈现明显的季节性变化,在夏季水温较高时,微生物多样性增加,而在秋、冬季,微生物多样性则降低。本研究中,在24、17、10 ℃时,“中洋1号”肠道微生物群落的Shannon指数均低于野生型,其Chao1指数也较低。本研究结果与Erwin等[23]的研究结果一致。 图例中不同字母代表不同COG功能。Different letters in the legend represent different COG functions.图7 野生型和“中洋1号”暗纹东方鲀肠道微生物功能预测Fig.7 Functional prediction of gut microbiome of wild-type and “Zhongyang No.1”obscure puffer Takifugu fasciatus 鱼类肠道微生物群落结构也会受到温度的影响。本研究中,PCA和NMDS分析结果表明,在较低温度环境中生长的“中洋1号”肠道微生物样品差异较小,而野生型鲀肠道微生物群落结构组成差异较大,低温可能是导致微生物群落结构更为相似的主要原因[23-24]。Zarkasi等[24]研究发现,温度升高导致大西洋鲑Salmosalar肠道微生物群落差异变大,多样性更为丰富。Kokou等[25]研究表明,在低温条件下,耐寒罗非鱼与不耐寒罗非鱼肠道微生物群落组成趋于一致。而Al-Harbi等[26]也发现,在夏、秋、冬3个季节中,杂交罗非鱼Oreochromisniloticus×O.aureus肠道内微生物组成在不同季节差别较大。这些结果表明,低温对鱼的肠道微生物可能具有较强的选择性,对微生物群落可能存在潜在的限制,从而降低其多样性[27]。 本研究表明,两个品系的暗纹东方鲀肠道微生物群落中的细菌组成相似,但其丰度不同。与野生型鲀相比,“中洋1号”肠道微生物中希瓦氏菌属、伊丽莎白金菌属、假单胞菌属、气单孢菌属和弧菌属丰度降低,而一些在低温下生长的细菌,如弓形杆菌丰度升高,这可能是在相对低温环境下长期驯化形成的[28-30],Van Driessche等[31]研究表明,弓形杆菌在4 ℃时也能保持较长时间的活性,其在鱼类肠道中可能对促进“中洋1号”的低温耐受能力有一定贡献。Kokou等[25]研究发现,在耐寒型罗非鱼中,弧菌目Vibrionales和交替单胞菌目Alteromonadales等变形菌门细菌在低温胁迫下丰度会升高。这可能与耐寒型罗非鱼在低温下其生理功能变化及种间差异有关[32]。鱼类受到低温胁迫时,肠道微生物作为鱼类特殊的功能性器官,其微生物组成的这些变化可能有助于鱼类适应低温。 此外,河鲀作为一种特殊的鱼类,其体内含有河鲀毒素,这与其肠道微生物的组成有一定关系[33-34]。在人工驯化和养殖期间,可以通过人为控制水源和饲料控制河鲀体内产河鲀毒素的细菌(如嗜水气单胞菌、霍乱弧菌等)产生[35-36]。温度变化会影响河豚毒素相关微生物的生长,从而影响河鲀毒素在河鲀体内的积累、代谢等过程。Ji等[37]研究发现,河鲀体内的河鲀毒素会随水温变化,在水温较高时(5—7月),其体内河鲀毒素含量较高,而随着水温降低,河豚毒素含量也随之降低。同时,产河鲀毒素细菌(如溶藻弧菌Vibrioalginolyticus)在低温时生长受限,河鲀毒素含量较低[38-39]。本研究中“中洋1号”在长期的低温驯化下,其肠道内微生物群落中与河鲀毒素相关的细菌(如希瓦氏菌属、弧菌属等)丰度可能会有所降低。 肠道微生物变化是一个长期与宿主和环境相互作用的过程,本研究中由于低温胁迫时间短,肠道微生物群落组成可能不会发生大规模变化,后续将研究长期低温胁迫对鱼类肠道微生物的影响。 本研究结果有助于加深对鱼类在低温条件下肠道微生物结构及功能变化的理解,对培育具有强劲耐寒能力的养殖品种及促进水产养殖业发展具有重要意义。 在本研究中,通过比较快速降温后野生型(不耐寒)和长期低温适应(耐寒,“中洋1号”)的两个品系的暗纹东方鲀肠道微生物群落组成变化,得出如下结论。 1)经过长期低温驯化,“中洋1号”肠道微生物多样性显著低于野生型暗纹东方鲀。随着温度降低,“中洋1号”肠道微生物的多样性也呈现下降的趋势,这表明,低温对降低鱼类肠道微生物群落多样性组成有重要影响。 2)两个品系的暗纹东方鲀肠道微生物组成相似,但丰度不同,肠道内微生物的丰度会随着温度变化而改变。 3)“中洋1号”肠道中具有碳水化合物运输与代谢、脂质转运与代谢等功能的比例高于野生型鲀,这可能会有助于暗纹东方鲀对低温的适应。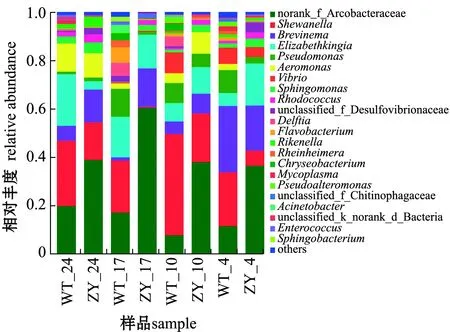
2.5 肠道微生物功能预测
3 讨论
3.1 两个品系暗纹东方鲀肠道微生物的多样性
3.2 两个品系暗纹东方鲀肠道微生物丰度及功能
4 结论

