基于GC-MS和UPLC-Q-Exactive MS技术的荆防颗粒化学成分研究
梁红宝,姜宇珺,袁晓梅,姚景春,邱荣英,杨 敏,张贵民,李 峰*
基于GC-MS和UPLC-Q-Exactive MS技术的荆防颗粒化学成分研究
梁红宝1, 2, 3,姜宇珺2, 3,袁晓梅3,姚景春2, 3,邱荣英2,杨 敏1,张贵民2, 3,李 峰1*
1. 山东中医药大学,山东 济南 250355 2. 山东新时代药业有限公司,山东 临沂 276006 3. 鲁南制药集团股份有限公司 中药制药共性技术国家重点实验室,山东 临沂 276006
对荆防颗粒化学成分进行系统分析,并分析其裂解规律。采用GC-MS技术对荆防颗粒中挥发性化学成分和UPLC-Q-Exactive MS技术在正、负离子模式下对荆防颗粒中非挥发性化学成分进行定性分析。通过GC-MS数据库匹配,共鉴别出了24个化合物,包括萜类19个、醛类2个、酯类2个、芳香醚类1个。通过质谱信息并结合对照品、相关文献、数据库检索,液质联用共鉴别出了85个化合物,包括香豆素类25个、木脂素类6个、黄酮苷15个、黄酮类15个、有机酸类9个、糖苷类5个、三萜类4个和其他类化合物6个。建立了荆防颗粒的GC-MS和UPLC-Q-Exactive MS的分离鉴定方法,为阐释该复方的功效物质基础提供了依据。
荆防颗粒;GC-MS;UPLC-Q Exactive MS;裂解规律;萜类;香豆素;木脂素
荆防颗粒是根据荆防败毒散方剂,采用现代制药工艺提取加工浓缩制成的中成药制剂。荆防败毒散出自明代张时彻的《摄生众妙方》,由人参败毒散加减而成,去温补人参而无助邪化毒之弊,加荆芥、防风助力疏散透利,其治疗范围从伤寒、瘟疫之类,扩展到“伤寒外感、多种疫病、痘疹疮疡”等更广泛的疾病。且徐春甫《古今医统大全》中也有记载:“瘟疫通治剂,荆防败毒散,治天行时疫,发散瘟邪。”清代沈金鳌的《杂病源流犀烛》中也提及“温病初症,未知端的,先以荆防败毒散治之。”本方由荆芥、防风、柴胡、川芎、羌活、独活、前胡、茯苓、桔梗、枳壳、甘草共11味中药组成。主治发汗解表、散风祛湿,可用于风寒感冒、头痛身痛、鼻塞清涕,临床效果较为显著。荆防颗粒作为抗疫名方荆防败毒散的成方制剂,2020年已被国内多省份指定为新冠肺炎预防推荐用药,新疆、云南、四川等地的《新冠病毒感染的中医药防治方案》中都推荐了荆防颗粒作为新冠病毒感染轻症的指导用药。
荆防颗粒化学成分的现代研究包括,刘雯等[1]采用HPLC同时测定了荆防颗粒中6种成分,为荆防颗粒的质量控制提供方法;李云静等[2]采用HPLC波长切换联合梯度洗脱法同时测定荆防败毒丸中10个成分的含量;冯雪等[3]采用LC-ESI/MS方法同时测定荆防败毒口服液中4个有效成分含量。但未见关于荆防颗粒组方中全成分鉴定的相关报道,本文利用GC-MS和UPLC-Q-Exactive MS技术对荆防颗粒中化学成分进行定性分析,并分析其裂解规律。
1 材料与仪器
Thermo scientific trace 1310 ISQ/LT气相色谱-质谱联用仪(赛默飞世尔科技公司,美国),UPLC-Q-Exactive MS四级杆-静电场轨道阱高分辨质谱(赛默飞世尔科技公司,美国),Thermo TR-V1色谱柱(30 m×0.25 mm,1.4 μm,赛默飞世尔科技公司,美国),Waters ACQUITY UPLC HSS C18色谱柱(100 mm×2.1 mm,1.8 μm,沃特世科技有限公司,美国),万分之一天平和十万分之一天平(梅特勒-托利多仪器(上海)有限公司),GTSONIC-P13型超声波清洗器(江苏苏州江东精密仪器有限公司),挥发油提取装置,电子调温电热套(河南豫华仪器有限公司)。对照品新绿原酸(批号DST180130-015,质量分数≥98%)购自成都德斯特生物技术有限公司;对照品新橙皮苷(批号111857-201804,质量分数≥98%)、柚皮苷(批号110722-201714,质量分数≥93%)、紫花前胡苷(批号111821-201604,质量分数≥98%)、绿原酸(批号110753-201716,质量分数≥98%)、升麻素苷(批号111522-201712,质量分数≥96%)、甘草苷(批号110610-201908,质量分数≥95%)和阿魏酸(批号110773-201614,质量分数≥98%)购自中国食品药品检定研究院。荆防颗粒(批号0012101001、0012101005、0012104007、0012010007、0012012009)由山东新时代药业提供;水为纯净水,乙腈、甲醇、甲酸为质谱纯,其他试剂均为分析纯。
2 方法
2.1 GC-MS条件
2.1.1 色谱条件 Thermo TR-V1色谱柱(0.25 mm×30 m,1.4 μm),以高纯氦气为载气,初始温度为80 ℃,保持5 min,以5 ℃/min速率升温至220 ℃,保持20 min。进样口温度为200 ℃,分流比10∶1,体积流量1.0 mL/min,进样量为0.1 μL。
2.1.2 质谱条件 电离方式为EI,电子能量为70 eV,传输线和离子源温度均为230 ℃,扫描质量范围为/30~500。
2.2 UPLC-Q-Exactive MS条件
2.2.1 色谱条件 Waters ACQUITY UPLC HSSC18色谱柱(100 mm×2.1 mm,1.8 μm),流动相为0.1%甲酸水溶液(A)-乙腈(B),梯度洗脱(0~2 min,5% B;2~25 min,5%~40% B;25~35 min,40%~70% B),体积流量为0.3 mL/min,柱温为30 ℃,进样量为0.3 μL。
2.2.2 质谱条件 电喷雾离子源(HESI-Ⅱ),正、负离子模式切换检测;鞘气为氮气,体积流量为10.5 L/min;辅助气为氮气,体积流量为3.0 L/min;毛细管温度为350 ℃,喷雾电压为3.5 kV。
2.3 对照品溶液的制备
分别精密称取各对照品适量,加甲醇配制成含新橙皮苷1.055 mg/mL、柚皮苷0.125 mg/mL、绿原酸0.135 mg/mL、紫花前胡苷0.125 mg/mL、新绿原酸0.132 mg/mL、升麻素苷0.122 mg/mL、甘草苷0.136 mg/mL、阿魏酸0.122 mg/mL的混合对照品溶液,置于4 ℃冰箱内,备用。
2.4 供试品溶液的制备
2.4.1 气质供试品的提取及制备 分别取5批次样品各2袋,照《中国药典》2020年版挥发油测定法(通则2204甲法)提取挥发油,称取本品100 g,置圆底烧瓶中,加10倍量水,加热回流提取至挥发油提取器中油量不再增加,用无水硫酸钠干燥,精密量取荆防颗粒挥发油100 μL,即得供试品溶液,备用。
2.4.2 液质供试品溶液的制备 分别取5批次样品各2袋,除去包装,混匀,然后取样品适量,研细,精密称定10.0 g,置锥形瓶中,加入甲醇25 mL,密塞,称定质量后,超声30 min,放冷,并用甲醇补足减失的质量,摇匀,静置,0.22 μm微孔滤膜滤过,取续滤液,即得液质供试品溶液,避光,置于冰箱中4 ℃,备用。
2.5 数据处理及成分分析
经计算机数据处理,各色谱峰经气质工作站NIST 14质谱数据库系统和标准图库检索,并参照相关文献进一步确认挥发油的化学成分,按色谱峰面积归一化法计算各成分的相对百分含量。通过液质质谱所得数据中的精确相对分子质量,在可能的元素组成范围内推断其分子式。并参照相关文献以及TCMSP数据库并结合对照品、特征性多级质谱裂解碎片及相对丰度等信息,分析各化合物裂解规律,进一步确认化学成分。
3 结果
3.1 总离子流色谱图的建立
荆防颗粒气质总离子流图和在正、负离子模式下荆防颗粒液质的总离子流图,如图1、2所示。初步观察发现仪器较稳定且总离子流图清晰,可以用来进行数据分析,且其结果有较高的可靠性。

1~24号峰对应的化合物见表1
3.2 化合物的分析与鉴定
通过所得数据中的精确相对分子质量,并在可能的元素组成范围内推断其分子式。本实验从荆防颗粒中共鉴定出110个化合物,其中通过气质联用技术,从荆防颗粒挥发油中共鉴定出24个化合物,包括萜类19个、醛类2个、酯类2个、芳香醚类1个,具体化合物信息见表1。通过液质联用技术,从荆防颗粒中共鉴定出85个化合物,包括香豆素类25个、木脂素类6个、黄酮苷15个、黄酮类15个、有机酸类9个、糖苷类5个、三萜类4个和其他类化合物6个。其中正离子裂解信息及鉴定结果见表2,负离子裂解信息及鉴定结果见表3。
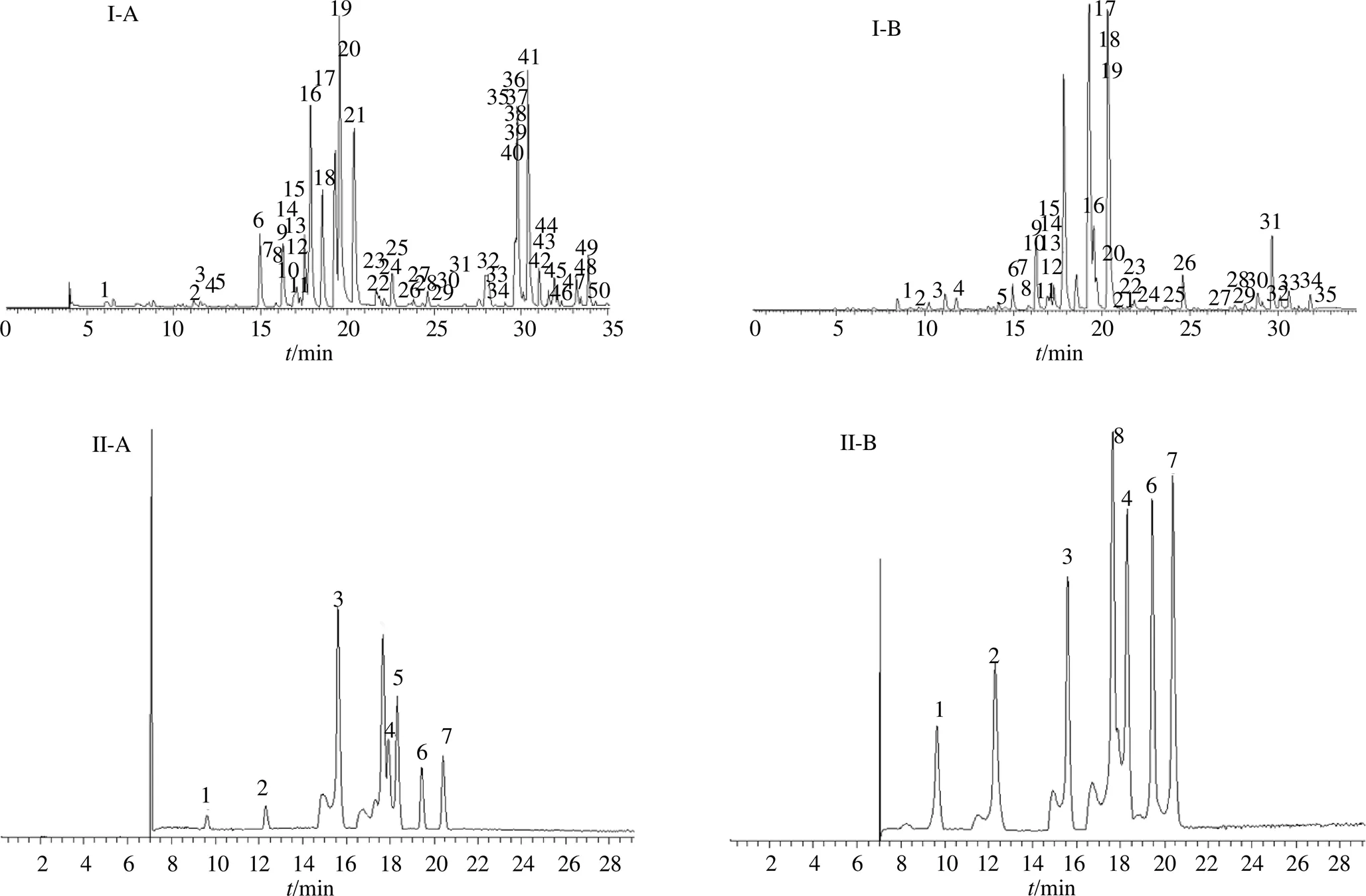
图I-A中1~50号峰对应的化合物见表2;图I-B中1~35号峰对应的化合物见表3;图II中1-新绿原酸 2-绿原酸 3-升麻素苷 4-阿魏酸 5-紫花前胡苷 6-柚皮苷 7-新橙皮苷 8-甘草苷
3.3 化合物的裂解规律分析
3.3.1 黄酮及黄酮苷类 该类化合物在荆防颗粒中数量较多,主要来自甘草和枳壳。其中黄酮苷类化合物居多,黄酮苷多见丢失1个糖基以及环的断裂产生的碎片。该类化合物在质谱裂解过程中容易发生脱糖基、脱水、环的裂解,以及CO、CO2、CHO等一些中性分子丢失[35]。以负离子模式下化合物11、15和19为例,在[M-H]−的准分子离子峰分别为/549.161 38(C26H30O13)、593.151 55(C27H30O15)和609.182 37(C28H34O15)。化合物11失去1个芹糖基和1个葡萄糖基后,发生RDA裂解,得到/255 [M-H-Api-Glc]−和119 [M-H-Api-Glc-C8H8O2]−碎片。化合物15失去2个鼠李糖基后,再失去1个羟基,最后发生RDA裂解,得到/285 [M-H-2Rha]−、271 [M-H-2Rha-OH]−和119 [M-H-2Rha-OH-C8H8O3]−碎片。化合物19失去1个鼠李糖基和1个葡萄糖基,得到/447 [M-H-Rha]−和285 [M-H-Rha-Glc]−碎片。因此,化合物11、15和19被初步确定为芹糖甘草苷、山柰酚-3--芸香糖苷和新橙皮苷。化合物19通过对照品比对,确定是新橙皮苷。裂解途径如图3。
3.3.2 香豆素类 该类化合物在荆防颗粒中数量也相对较多,主要来自前胡和独活。由于香豆素类分子中一般具有多个和芳环连接的氧原子、羟基,故其质谱裂解规律一般连续失去CO、OH、H2O、CH3或OCH3的碎片离子峰。以正离子模式下化合物38为例,在[M+H]+的准分子离子峰为/217.049 59 (C12H8O4),首先失去1个甲基,得到/202 [M+H-CH3]+碎片,再连续失去2个羰基得到/174 [M+H-CH3-CO]+和145 [M+H-CH3-CO-CO]+碎片;或在准分子离子峰基础上连续失去3个羰基,得到/189 [M+H-CO]+、161 [M+H-CO-CO]+和133.100 78 [M+H-CO-CO-CO]+碎片;或在准分子离子峰基础上首先失去1个甲氧基,得到/185 [M+H-CH3OH]+的碎片,再连续失去2个羰基,得到/158 [M+H-CH3OH-CO]+和129 [M+H-CH3OH-CO-CO]+碎片。因此,化合物38被初步确定为花椒毒素。裂解途径见图4。
表1 荆防颗粒挥发油中鉴定的挥发油成分及其相对质量分数
Table 1 Volatile composition and their relative mass percentage of Jingfang Granules
序号tR/min相对分子质量分子式化合物名称相对百分含量/%分类 18.074100.16C6H12O正己醛[4-8]0.182醛类 211.747136.23C10H162-侧柏烯0.495萜类 312.145136.23C10H163-蒈烯[9-10]16.081萜类 412.860136.23C10H16莰烯[8-10]0.388萜类 513.707136.23C10H16β-水芹烯[9]2.308萜类 613.917136.23C10H16β-蒎烯[8-9,11-12]8.928萜类 713.999136.23C10H16诺品烯0.959萜类 814.764136.23C10H16α-侧柏烯[10]0.415萜类 915.210136.23C10H164-蒈烯[10]0.550萜类 1015.393128.21C8H16O正辛醛[4,7,9,10] 0.160醛类 1115.662136.23C10H16D-柠檬烯[8] 31.192萜类 1215.720134.22C10H14邻伞花烃[10]6.595萜类 1316.067136.23C10H16β-罗勒烯[8,10]1.058萜类 1416.621136.23C10H16γ-松油烯[8,9] 13.735萜类 1518.679154.25C10H18O芳樟醇[8] 0.179萜类 1621.033154.25C10H18O左旋薄荷酮[12]7.502萜类 1721.505154.25C10H18O4-萜烯醇[8,10]1.000萜类 1822.097154.25C10H18Oα-松油醇[10] 0.245萜类 1922.638164.24C11H16O麝香草酚甲醚0.710芳香醚类 2023.784152.23C10H16O胡薄荷酮[11-12] 2.837萜类 2124.617196.29C12H20O2乙酸龙脑酯[10]0.567酯类 2228.311204.35C15H24β-石竹烯[8,12] 0.241萜类 2329.947204.35C15H24紫穗槐烯0.675萜类 2439.225190.22C12H14O2反式藁本内酯[10]0.592酯类
表2 正离子模式下荆防颗粒的化学成分分析
Table 2 Identification of compounds in Jingfang Granules under positive ion mode
序号tR/min相对分子质量误差(×10−6)化合物名称分子式碎片离子(m/z)药材归属分类实测值理论值 15.21235.169 27235.169 81−2.29艾里莫芬内酯C15H22O2235.169 27d木脂素类 211.34193.049 68193.050 09−2.68东莨菪内酯[13] C10H8O4193.049 68, 177.054 86b、c、d、k木脂素类 311.77257.080 66257.081 39−2.84八仙花酸C15H12O4257.080 66, 239.070 36, 211.075 55, 163.039 05f有机酸类 412.49421.165 37421.165 12−0.59甘草宁H[14]C25H24O6421.165 37k黄酮类 513.42209.117 20209.128 335.40洋川芎内酯J[14]C12H18O4209.117 20, 163.111 76, 153.054 28, 116.966 53, 91.054 73j木脂素类 615.08341.138 43341.138 90−1.38甘草香豆酮C20H20O5341.138 43, 323.127 66, 308.105 19, 271.095 95, 165.054 75k香豆素类 715.56469.170 35469.170 99−1.36升麻素苷* [15] C22H28O11469.170 35, 219.065 41b糖苷类 816.47187.039 05187.039 522.51异补骨脂素[16]C11H6O3187.039 05, 159.044 16c、d、g香豆素类 916.71303.049 90303.050 48−1.91槲皮素C15H10O7303.049 90, 257.080 72a、g、h、k黄酮类 1016.88433.112 27433.113 47−2.77芹菜苷元-7-葡萄糖苷C21H20O10433.112 27, 273.060 21j糖苷类 1116.98273.075 71273.076 30−2.16柚皮素C15H12O5273.075 71, 255.065 16e黄酮类 1217.11257.080 66257.081 39−2.84松属素C15H12O4257.080 66, 148.047 55j黄酮类 1317.61307.118 63307.118 161.53升麻素[17]C16H18O6307.118 63b香豆素类 1417.65287.055 57287.054 932.23木犀草素[18]C15H10O6287.055 57, 153.018 20a、i黄酮类 1517.71247.096 36247.097 04−2.75异紫花前胡内酯[19]C14H14O4247.096 36, 229.085 78, 189.054 93, 175.038 93c、b、d、g木脂素类 1618.02195.066 27195.065 732.77阿魏酸* [16,20-22]C10H10O4195.066 27, 125.023 51c、d、g、j有机酸类 1718.09409.147 83409.149 86−4.96紫花前胡苷*[9-10,13,16,23] C20H24O9409.147 83, 227.073 35, 179.054 51c、d、g糖苷类 1818.39265.097 20265.097 70−1.86川芎哚[14]C16H12N2O2265.097 20, 247.085 63, 219.091 32, 206.083 98j生物碱类 1919.98317.065 52317.066 131.92异鼠李素C16H12O7317.065 52, 285.040 50k黄酮类 2020.22191.033 49191.034 44−4.97萘醌C10H6O4191.033 49b萘醌类 2120.70207.101 59207.102 12−4.953-丁烯基-4-羟基苯酞[14] C12H14O3207.101 59, 189.091 02, 147.080 52, 133.101 38, 105.070 27j苯酞类 2221.80301.107 52301.107 60−3.50珊瑚菜素[13]C17H16O5301.107 52, 233.043 85, 187.040 36b、c、g香豆素类 2322.10241.092 75241.091 953.32川芎内酯S[20-22]C12H16O5241.092 75, 185.096 63, 171.080 49j木脂素类 2422.57247.096 53247.097 04−2.06日本前胡醇C14H14O4247.096 53, 229.085 98, 201.091 17, 175.038 99g香豆素类 2522.58221.189 91221.190 53−2.80β-异侧柏萜醇C15H24O221.189 91d三萜类 2624.02287.090 85287.091 95−3.83甘草查耳酮B[23-24] C16H14O5287.090 85, 195.091 83k黄酮类 2724.47285.075 59285.076 30−2.49金合欢素C16H12O5285.075 59, 253.049 67i黄酮类 2824.64247.096 51247.097 04−2.14狭蓬芹内酯C14H14O4247.096 51, 229.085 97g香豆素类 2925.19285.075 74285.076 30−1.96山槐素C16H12O5285.075 74k酚酸类 3026.08485.325 84485.326 70−1.77茯苓新酸BC30H44O5485.325 84, 467.315 55, 421.310 12, 403.298 46f有机酸类 3126.60289.107 27289.107 601.14当归酮C16H16O5289.107 27, 207.028 99d香豆素类
续表2
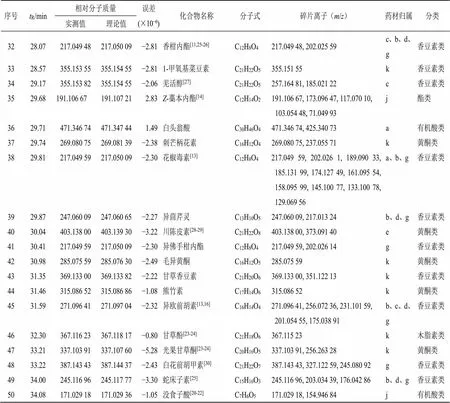
序号tR/min相对分子质量误差(×10−6)化合物名称分子式碎片离子(m/z)药材归属分类 实测值理论值 3228.07217.049 48217.050 09−2.81香柑内酯[11,25-26] C12H8O4217.049 48, 202.025 59c、b、d、g香豆素类 3328.57355.153 55355.154 55−2.811-甲氧基菜豆素C21H22O5355.151 55k香豆素类 3429.17355.153 82355.154 55−2.06羌活醇[27] C21H22O5257.164 81, 185.021 22c香豆素类 3529.68191.106 67191.107 212.83Z-藁本内酯[14]C12H14O2191.106 67, 173.096 47, 117.070 10, 103.054 48, 71.049 93j酯类 3629.71471.346 74471.347 441.49白头翁酸C30H46O4471.346 74, 425.340 73a有机酸类 3729.74269.080 75269.081 39−2.38刺芒柄花素C16H12O4269.080 75, 237.055 71k黄酮类 3829.81217.049 59217.050 09−2.30花椒毒素[13]C12H8O4217.049 59, 202.026 1, 189.090 33, 185.131 99, 174.127 49, 161.095 54, 158.095 99, 145.100 77, 133.100 78, 129.069 56a、b、g香豆素类 3929.87247.060 09247.060 65−2.27异茴芹灵C13H10O5247.060 09, 217.013 24b、d、g香豆素类 4030.04403.138 00403.139 30−3.22川陈皮素[28-29] C21H22O8403.138 00, 373.091 40e黄酮类 4130.41217.049 59217.050 09−2.30异佛手柑内酯C12H8O4217.049 59, 202.026 14g香豆素类 4230.98285.075 59285.076 30−2.49毛异黄酮C16H12O5285.075 59k黄酮类 4331.35369.133 00369.133 82−2.22甘草香豆素C21H20O6369.133 00, 351.122 13k香豆素类 4431.46315.086 52315.086 86−1.08熊竹素C17H14O6315.086 52k黄酮类 4531.59271.096 41271.097 04−2.32异欧前胡素[13,16]C16H14O4271.096 41, 256.072 36, 231.101 59, 201.054 55, 175.038 91b、c、d、g香豆素类 4632.30367.116 23367.118 17−0.80甘草酚[23-24] C21H18O6367.115 23k木脂素类 4733.21337.103 91337.107 60−5.28光果甘草酮[23-24] C20H16O5337.103 91, 256.263 28k黄酮类 4833.22387.143 43387.144 37−2.43白花前胡甲素[30]C21H22O7387.143 43, 327.122 59, 245.080 92g香豆素类 4934.00245.116 96245.117 77−3.30蛇床子素[25] C15H16O3245.116 96, 203.034 39, 176.042 86b、d、g香豆素类 5034.08171.029 18171.029 36−1.05没食子酸[20-22]C7H6O5171.029 18, 154.946 84j有机酸类
*对照品比对后确定的化合物;a-荆芥;b-防风;c-羌活;d-独活;e-枳壳;f-茯苓;g-前胡;h-柴胡;i-桔梗;j-川芎;k-甘草(表3同)
*Compounds identified by comparison with the reference substance a-Briq. b-(Turcz.) Schischk. c-Ting ex H. T. Chang d-Maxim.f.Shan et Yuan e-L. f-(Schw.) Wolf g-Dunn h-DC. i-(Jacq.) A.DC. j-Hort. k-Fisch. (same as table 3)
此外,香豆素类成分经常具有异戊烯氧基,以正离子模式下化合物45为例,在[M+H]+的准分子离子峰为/271.096 41(C16H14O4),首先失去1支链,得到/256 [M+H-CH3]+和201 [M+H-CH3-C4H7]+碎片;或失去1个甲基后,呋喃环断裂再苯环上的碳氧键断裂,得到/231 [M+H-CH3-C2H2]+和175 [M+H-CH3-C2H2-C3H4O]+碎片。因此,化合物45被初步确定为异欧前胡素。裂解途径见图5。
表3 负离子模式下荆防颗粒的化学成分分析
Table 3 Identification of compounds in Jingfang Granules under negative ion mode
序号tR/min相对分子质量误差(×10−6)化合物名称分子式碎片离子(m/z)药材归属分类实测值理论值 19.13129.092 26129.091 595.19庚酸C7H14O2129.092 26, 85.028 27c/h有机酸类 29.63353.088 10353.087 262.37新绿原酸* [31] C16H18O9353.088 10, 191.055 50, 135.044 10c有机酸类 310.91333.100 60333.099 732.61白当归素C17H18O7333.100 60, 304.558 17, 202.135 25b香豆素类 412.34353.087 16353.087 26−0.28绿原酸* [16,31]C16H18O9353.087 16, 191.055 47, 179.034 24, 135.044 10c有机酸类 514.93513.321 80513.321 620.57茯苓酸D C31H46O6513.321 80, 388.876 53, 315.087 74, 287.092 53f有机酸类 615.03341.124 21341.123 651.64白花前胡苷C16H22O8341.124 21g糖苷类 715.40439.182 50439.187 63−1.17甘草新酚T C25H26O7439.182 50k黄酮类 815.75141.127 87141.127 94−0.49反式-2-壬烯-1-醇C9H18O141.127 87, 113.096 28, 84.020 52j醇类 916.32469.333 70469.331 794.07β-甘草次酸[32]C30H46O4469.333 70, 423.128 66, 243.065 58, 179.055 48, 161.044 89, 131.033 78k三萜类 1016.49577.156 62577.155 741.52佛莱心苷 C27H30O14577.156 62k黄酮苷类 1116.99549.161 38549.160 821.02芹糖甘草苷[23-24] C26H30O13549.161 38, 255.066 28, 119.048 93k黄酮苷类 1217.68417.119 14417.118 561.39甘草苷* [23-24] C21H22O9417.119 54, 255.066 31k黄酮苷类 1317.60463.087 86463.087 760.16金丝桃苷 C21H20O12463.087 86, 285.041 20, 301.034 45h黄酮苷类 1417.62447.093 84447.092 742.46紫云英苷[27] C21H20O11447.093 84, 285.040 74c/k黄酮苷类 1517.67593.151 55593.150 651.52山柰酚-3-O-芸香糖苷C27H30O15593.151 55, 285.040 41, 271.061 43, 119.018 69k黄酮苷类 1619.47579.171 75579.171 380.64柚皮苷* [28]C27H32O14579.171 75, 271.061 49e/k黄酮苷类 1720.06425.161 39425.160 033.20白花前胡乙素[30,33]C24H26O7425.161 39g香豆素类 1820.06461.109 31461.108 39−2.00橙皮素-5-O-葡萄糖苷C22H22O11461.109 31, 283.025 12a黄酮苷类 1920.40609.182 37609.181 950.69新橙皮苷* [28-29]C28H34O15609.182 37,447.135 07,285.049 26e黄酮苷类 2020.83464.086 35464.087 762.19异懈皮苷C21H20O12464.086 35, 285.040 71, 301.071 44a/h/k黄酮苷类 2121.34549.161 50549.160 821.24异甘草苷元-4′-芹糖基葡萄糖苷[23-24] C26H30O13549.161 50, 255.066 33k黄酮苷类 2221.48579.169 19579.171 383.78甘草素-7,4′-二葡萄糖苷[14]C27H32O14579.169 19, 119.049 13k黄酮苷类 2321.81445.077 94455.077 091.87黄芩苷C21H18O11445.077 94, 269.045 59h黄酮苷类 2422.49417.119 54417.118 562.35新甘草苷[23-24] C21H22O9417.119 54, 255.066 31k黄酮苷类 2524.51583.182 43583.181 561.496′-阿魏酰基紫花前胡苷C30H32O12583.182 43, 207.065 32c糖苷类 2624.56285.075 62285.076 30−2.39氧化前胡素[30,33] C16H14O5285.075 62g香豆素类 2727.34577.155 50577.155 74−0.42异佛莱心苷C27H30O14577.155 50k黄酮苷类 2827.55297.040 53297.039 924.41异车轴草酚C16H10O6297.040 53, 282.017 40k香豆素类 2928.57301.033 78301.034 82−3.45橙皮素 C16H14O6301.033 78, 286.048 46e黄酮类 3029.32503.338 23503.337 271.91远志酸C29H44O6489.136 47, 309.073 12i三萜类 3129.76821.396 91821.395 961.16甘草酸[14,32]C42H62O16821.396 91, 645.361 33, 469.185 91, 303.090 58, 304.915 01, 134.863 63k三萜类 3230.06375.145 69375.144 383.49当归醇D[34]C20H24O7375.145 69, 357.174 47, 277.217 22, 183.138 40, 175.079 04d香豆素类 3331.50229.086 69229.086 470.967-(异戊烯基氧基)香豆素C14H14O3229.086 69, 174.031 51c香豆素类 3432.11381.134 52381.133 82−1.84格里西轮[14]C22H22O6381.134 52, 323.056 34k香豆素类 3532.83335.092 77335.091 95−2.45光果甘草香豆灵[14]C20H16O5335.092 77, 291.103 06k香豆素类
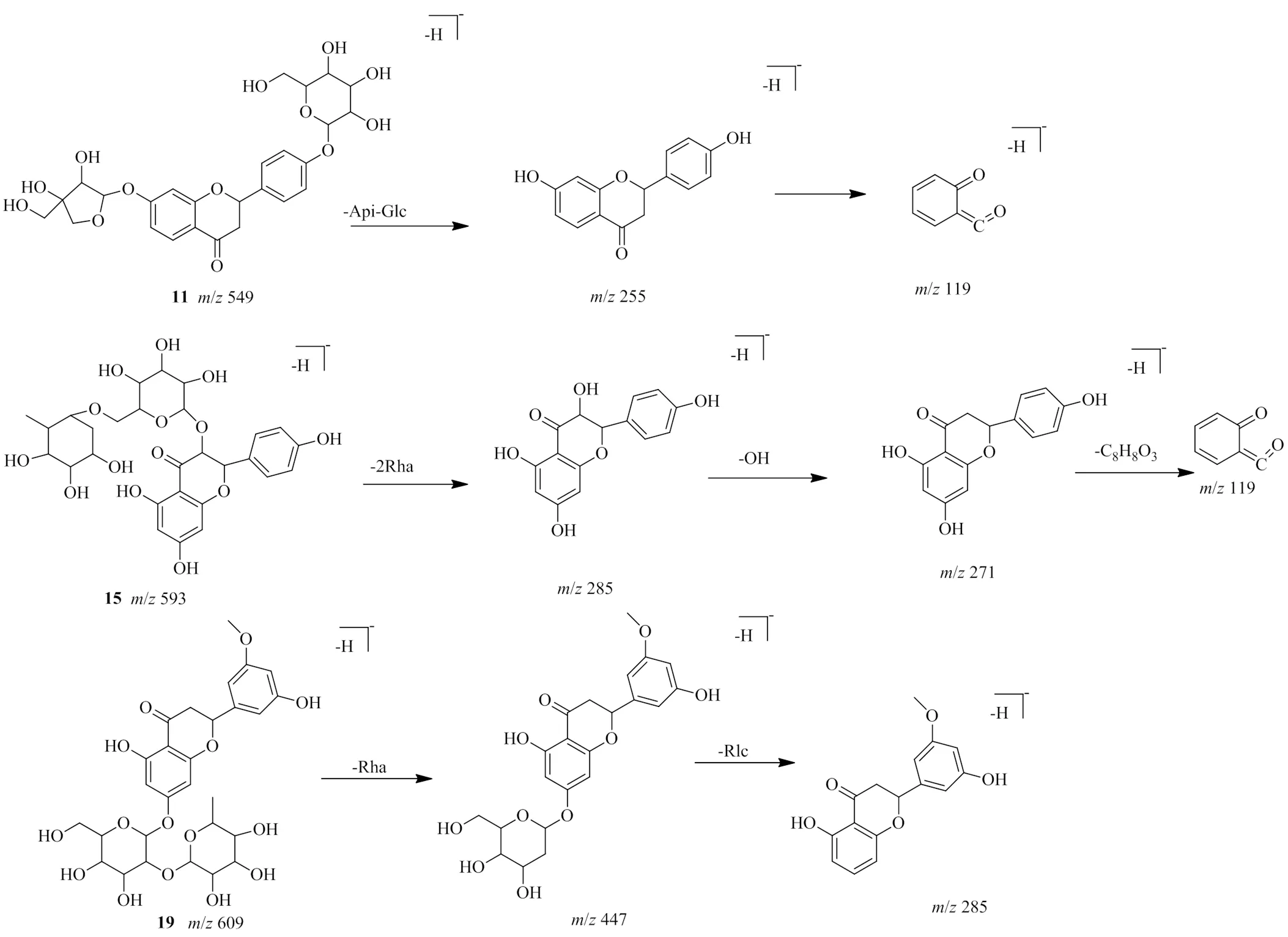
图3 芹糖甘草苷 (11)、山柰酚-3-O-芸香糖苷(15)和新橙皮苷(19) 的裂解途径
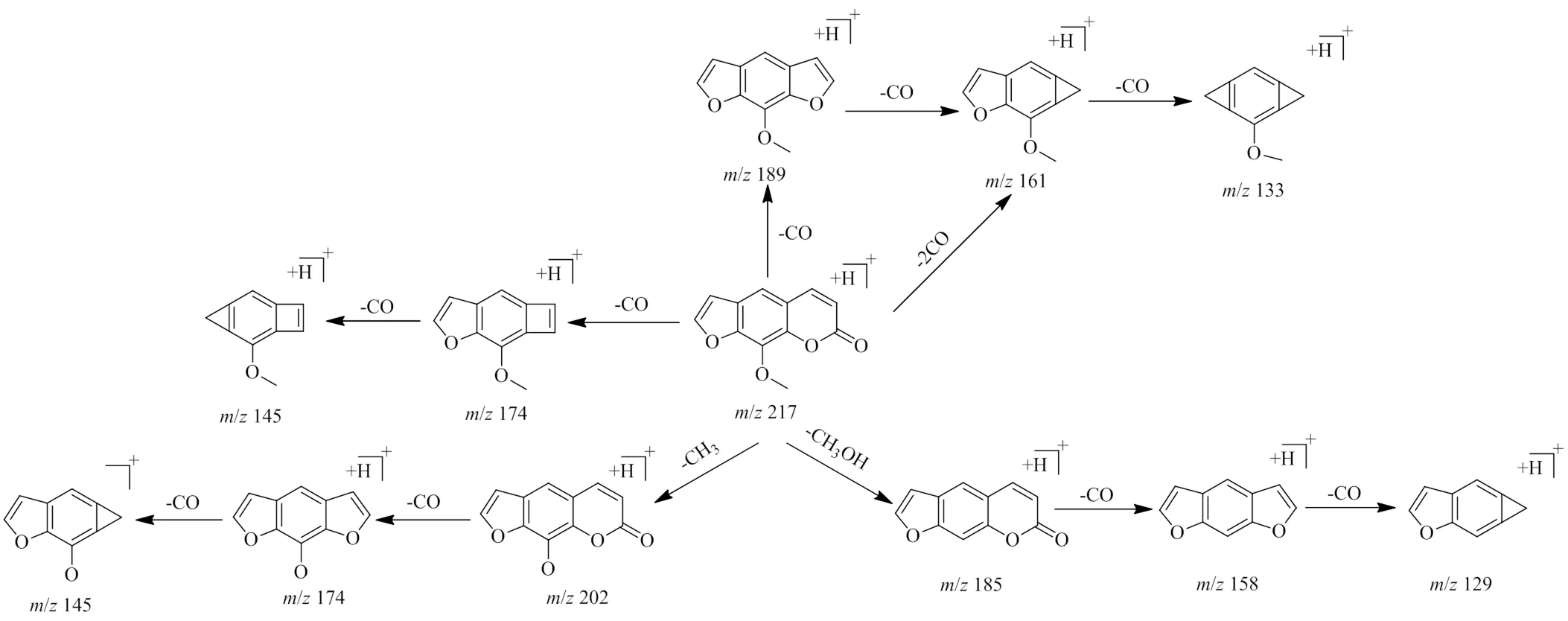
图4 花椒毒素裂解途径
3.3.3 有机酸类 该类化合物的基本结构为酚羟基取代的芳香环、脂肪酸等,易在羰基处断裂形成碎片离子。以负离子模式下化合物4为例,准分子离子峰353.087 16 (C16H18O9)。化合物4碳氧键断裂,得到/191 [M-H-C9H6O3]−碎片,或与氧相连的环烷烃断裂后,再失去1分子CO2,得到/179 [M-H-C7H10O5]−和135 [M-H-C7H10O5-CO2]−碎片。因此,化合物4初步确定为绿原酸,最后比对对照品明确化合物4为绿原酸。裂解途径如图6。
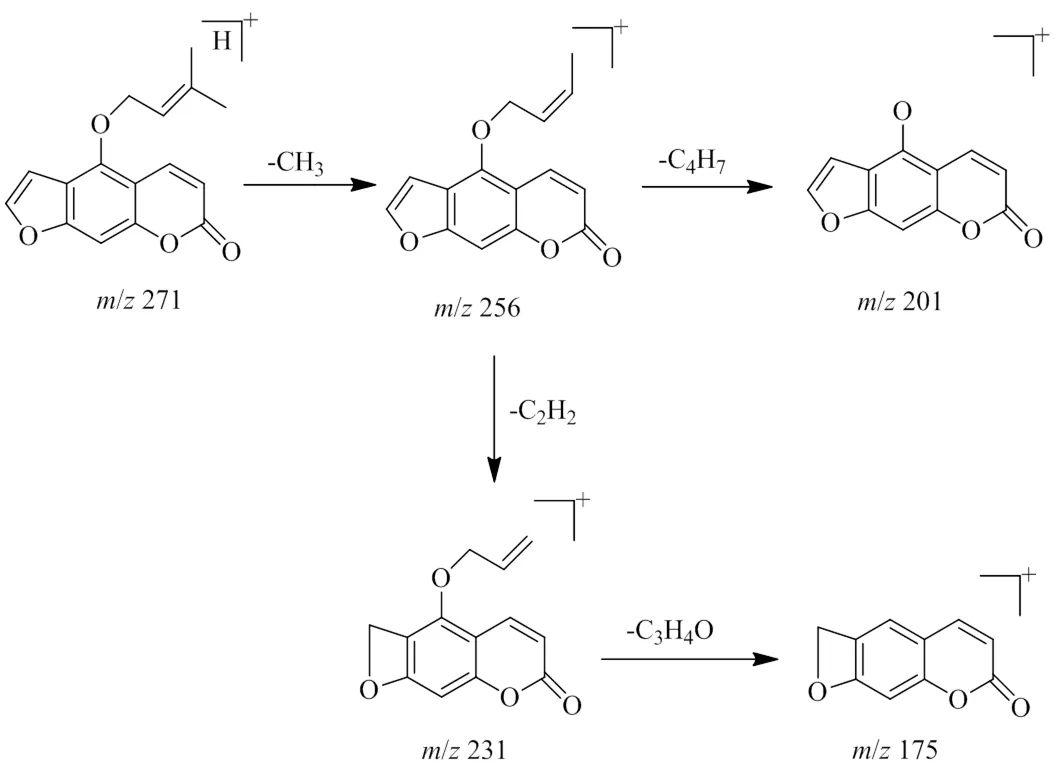
图5 异欧前胡素裂解途径
3.3.4 萜类 本方鉴定出的萜类化合物以三萜类为主,该类化合物易发生麦氏重排和环内裂解。以负离子模式下化合物31为例,在[M+H]+的准分子离子峰为/821.396 91(C42H62O16)。化合物31连续首先脱去2个葡萄糖醛酸,得到/645 [M-H-C6H8O6]−和469 [M-H-2C6H8O6]−碎片,苷元结构进一步发生麦氏重排,并伴随烯丙键均裂,生成/303 [M-H-2C6H8O6-C11H18O]−碎片或304 [M-H-2C6H8O6-C11H16O]−碎片,继续丢失中性分子得到/135 [M-H-2C6H8O6-C11H16O-C10H18O2]−碎片。因此,化合物31被初步确定为甘草酸。裂解途径见图7。

图6 绿原酸裂解途径
以负离子模式下化合物9为例,在[M+H]+的准分子离子峰为/469.333 70(C30H46O4)。化合物9失去1个羧基后具有环内双键的六元环发生了裂解,得到具有AB环和DE环的/243 [M-H-COOH-C7H24O]−和179 [M-H-COOH-C12H20O]−碎片。然后/179碎片失去1分子水,再脱去2个甲基,得到/161 [M-H-COOH-C12H20O-H2O]−和/131 [M-H-COOH-C12H20O-H2O-2CH3]−碎片。因此,化合物9被初步确定为β-甘草次酸。裂解途径见图8。
4 讨论
荆防颗粒源于“治疫第一方”人参败毒散,即人参败毒散去人参、生姜、薄荷加荆芥、防风而成,亦是治疫良方,被称为“瘟疫通治剂”。本实验首次对荆防颗粒的挥发油进行定性鉴定,通过气质数据库匹配,共鉴定出了24个化合物,包括萜类19个、醛类2个、酯类2个、芳香醚类1个。其中薄荷酮和胡薄荷酮是荆防颗粒君药荆芥的主要成分[36]。且有文献表明,胡薄荷酮对急性炎症模型有抑制作用,是荆芥挥发油抗炎作用的物质基础之一[37-38]。并有研究表明荆芥挥发油、薄荷酮及胡薄荷酮能显著降低病毒感染小鼠肺组织病毒滴度,有明显的抗病毒活性[38]。
液质实验前期,为筛选最佳提取方法,分别用水、50%甲醇水溶液、甲醇作为提取溶剂,考察最佳提取溶剂及溶剂用量,结果表明采用2.5倍量甲醇提取时,各分析物响应最好,提取率最高,提取效果最优。通过质谱信息并结合对照品、相关文献、数据库检索,液质联用共鉴定出了85个化合物,包括香豆素类25个、木脂素类6个、黄酮苷15个、黄酮类15个、有机酸类9个、糖苷类5个、三萜类4个和其他类化合物6个。以上成分中,黄酮及黄酮苷类成分如橙皮素、川陈皮素、新橙皮苷等具有抗炎、抗肿瘤等药理活性[39-40],主要存在于枳壳和甘草中;香豆素类成分如异欧前胡素、羌活醇,蛇床子素等,主要存在于防风、羌活、独活、前胡中;有机酸类成分如绿原酸、新绿原酸、阿魏酸等具有保护心血管、降糖、调脂等药理作用[41-43],主要存在于羌活中;三萜类成分如甘草酸、β-甘草次酸等,存在于甘草中;糖苷类成分如紫花前胡苷,主要存在于羌活中。本研究对荆防颗粒中化学成分进行了较为全面的分析,发现其所含有的主要成分与文献报道的相关药理活性成分具有良好的一致性,以上不同来源的不同活性成分可通过协同、互补等作用实现多成分、多靶点、多通路的治疗效果,最终使荆防颗粒更好地发挥发汗解表、散风祛湿等功效。

图7 甘草酸裂解途径
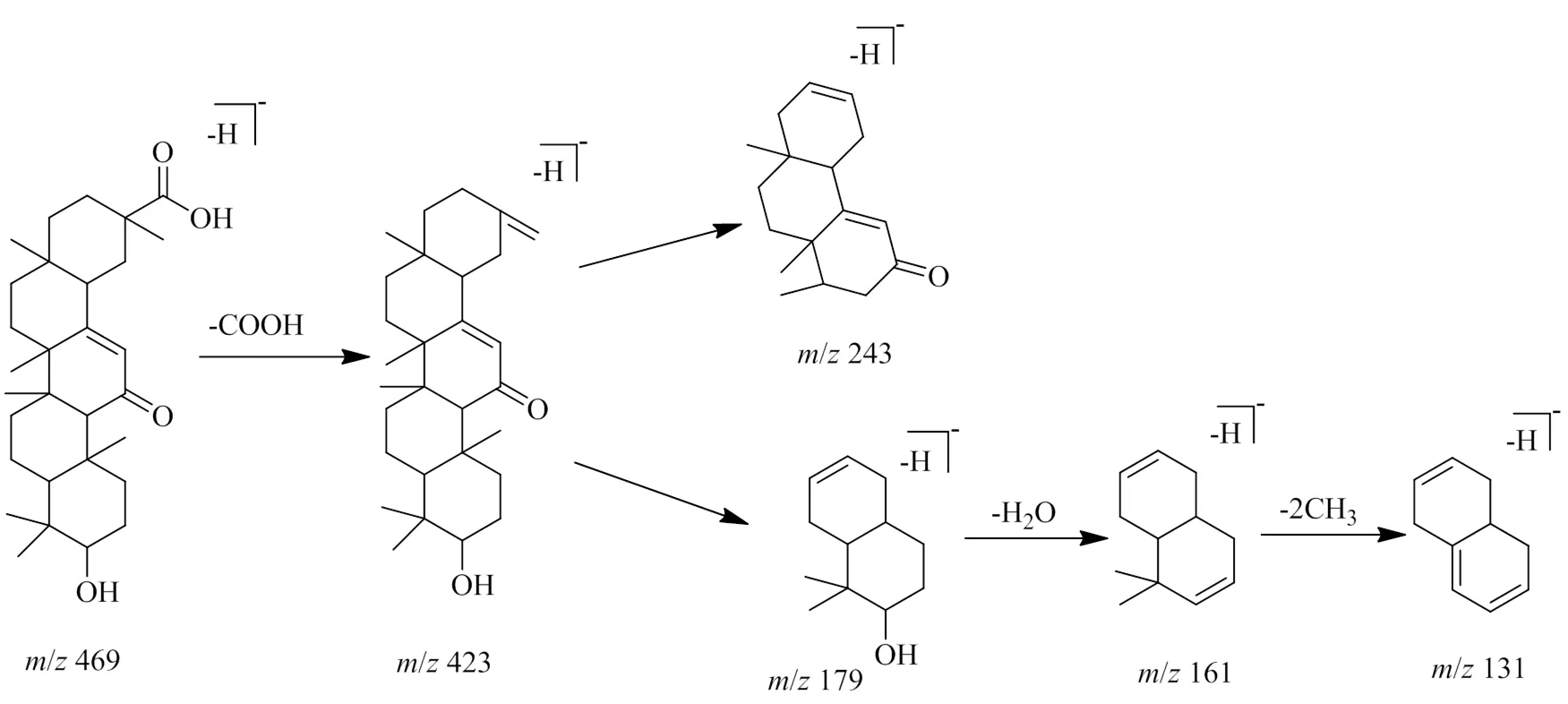
图8 β-甘草次酸裂解途径
本实验运用GC-MS技术可以较好地分析荆防颗粒中的挥发性成分,运用UPLC-Q Exactive MS 技术能够较好地分析鉴定荆防颗粒中的醇溶性有机成分。2种技术合用,根据NIST 14质谱数据库、精确相对分子质量和质谱碎片结构等信息,结合对照品的裂解规律和参考相关文献,鉴定分析了荆防颗粒中109个化合物,并对鉴定出的部分化合物进行了药材归属。此外,荆防颗粒质谱离子流图中尚存在一些响应较好的色谱峰为未知成分有待进一步的实验研究。本实验建立的方法简便、准确,可为荆防颗粒的药效物质基础研究及质量标准提升提供实验依据。期望未来荆防颗粒能在全球新冠疫情防控中发挥积极作用。
利益冲突 所有作者均声明不存在利益冲突
[1] 刘雯, 李峰, 孙春亮, 等. HPLC同时测定荆防颗粒中6种成分 [J]. 中国实验方剂学杂志, 2016, 22(17): 55-58.
[2] 李云静, 何忠梅. HPLC波长切换联合梯度洗脱法同时测定荆防败毒丸中10个成分的含量 [J]. 药物分析杂志, 2017, 37(3): 414-421.
[3] 冯雪, 高玉乔, 范琼瑛, 等. 采用LC-ESI/MS方法同时测定荆防败毒口服液中4个有效成分含量 [J]. 药物分析杂志, 2017, 37(8): 1489-1496.
[4] 严云丽, 张华, 金高娃, 等. 防风挥发油化学成分分析比较 [J]. 世界科学技术: 中医药现代化, 2009, 11(3): 400-406.
[5] 赵博, 杨鑫宝, 杨秀伟, 等. 防风化学成分的研究 [J]. 中国中药杂志, 2010, 35(12): 1569-1572.
[6] 夏伦祝, 彭代银, 汪永忠, 等. 三种方法提取防风挥发油的气质联用成分分析 [J]. 安徽医药, 2009, 13(8): 885-886.
[7] 陈勇, 李晓如, 曾笑, 等. 气相色谱-质谱和化学计量学解析法分析防风挥发油成分 [J]. 中国医院药学杂志, 2008, 28(6): 500-502.
[8] 郭培, 郎拥军, 张国桃. 羌活化学成分及药理活性研究进展 [J]. 中成药, 2019, 41(10): 2445-2459.
[9] 王小云, 脱聪聪, 黄志芸, 等. 新鲜羌活挥发油的成分分析以及抗氧化和抑菌活性探究 [J]. 食品与发酵工业, 2021, 47(5): 193-200.
[10] 黄雪莹, 王圣鑫, 余爱明, 等. HS-SPME-GC-MS联用分析羌活、防风药对配伍前后挥发性组分变化规律 [J]. 中药新药与临床药理, 2019, 30(6): 707-714.
[11] 程梦娟, 耿晓桐, 龚海燕, 等. 基于GC-MS的荆芥和荆芥穗饮片挥发油中化学成分特征分析 [J]. 天然产物研究与开发, 2021, 33(3): 362-372.
[12] 王凤, 温桃群, 桑文涛, 等. 荆芥挥发油化学成分及药理作用研究现状 [J]. 中南药学, 2017, 15(3): 312-318.
[13] 刘双利, 姜程曦, 赵岩, 等. 防风化学成分及其药理作用研究进展 [J]. 中草药, 2017, 48(10): 2146-2152.
[14] 刘佳星, 魏洁, 武锦春, 等. 基于UPLC-Q-TOF- MS/MS技术的酸枣仁汤颗粒化学成分分析 [J]. 中国实验方剂学杂志, 2021, 27(12): 1-12.
[15] 辛国, 李鑫, 黄晓巍. 防风化学成分及药理作用 [J]. 吉林中医药, 2018, 38(11): 1323-1325.
[16] 李石平, 沙龙, 赵祎武, 等. 近30年来中药羌活化学成分研究进展 [J]. 中国中药杂志, 2015, 40(15): 2952-2963.
[17] 贺峰. 防风的化学成分和药理作用 [J]. 内蒙古中医药, 2011, 30(10): 43.
[18] 陈文璐, 张怡萍, 牟艳芳, 等. 基于生物信息技术的荆防颗粒治疗冠状病毒感染疾病机制探析 [J]. 中草药, 2020, 51(15): 3937-3951.
[19] Guo D A, Liu Z A, Lou Z C. Constituents of Chinese drug Fangfeng, the root of[J]., 1992, 1(2): 81-82.
[20] 潘明凤. 川芎的化学成分研究与多指标成分的含量测定 [D]. 成都: 西南交通大学, 2014.
[21] 王文祥, 顾明, 蒋小岗, 等. 川芎化学成分研究 [J]. 中草药, 2002, 33(1): 4-5.
[22] 王普善, 高宣亮, 福山爱保, 等. 中药川芎的化学成分研究: 五种内酯类化合物 [J]. 中草药, 1985, 16(3): 41-42.
[23] 陈佳, 张权, 杨蕊, 等. 不同生长年限甘草主要成分含量测定及多元统计分析 [J]. 药物分析杂志, 2020, 40(7): 1185-1196.
[24] 李欢欢, 林丽, 郭爽, 等. 基于网络药理学及定性定量研究的甘草质量标志物预测分析 [J]. 中草药, 2020, 51(10): 2680-2688.
[25] 陈建维, 刘圆, 刘晟楠, 等. 一测多评法测定枳实中4种黄酮类成分 [J]. 中草药, 2015, 46(9): 1374-1377.
[26] 田玉路. 前胡质量评价方法及呋喃香豆素类同分异构体质谱分析方法研究 [D]. 石家庄: 河北医科大学, 2016.
[27] 张远芳. 羌活质量评价体系的建立 [D]. 太原: 山西中医药大学, 2019.
[28] 龚斌, 李琴, 胡小红, 等. 枳壳化学成分及药理作用研究进展 [J]. 南方林业科学, 2019, 47(3): 40-45.
[29] 李敏. 枳壳化学成分的研究 [D]. 长春: 吉林大学, 2014.
[30] 徐倩, 胡云飞, 汪电雷, 等. 前胡香豆素类提取物的UPLC/Q-TOF-MS分析及其初步药效学研究 [J]. 中草药, 2015, 46(24): 3637-3642.
[31] 刘卫根, 王亮生, 徐文华, 等. 不同商品等级羌活中有机酸和香豆素类化合物的测定 [J]. 中成药, 2012, 34(11): 2181-2186.
[32] 刘育辰, 王文全, 郭洪祝. 甘草中三萜类化合物的生物转化研究进展 [J]. 中药材, 2010, 33(3): 477-482.
[33] 李颖硕, 周秀, 李瑞芳, 等. 基于UPLC-Q-TOF/MS法分析不同产地前胡药材质量 [J]. 中成药, 2019, 41(5): 1110-1114.
[34] 朱艳, 李繁, 刘庆阳. 中药独活本草及药理学研究进展 [J]. 辽宁经济管理干部学院学报, 2010(1): 68-69.
[35] 崔琳琳, 包永睿, 王帅, 等. UPLC-Q-TOF-MS/MS快速鉴定补肺健脾方的化学成分 [J]. 中国实验方剂学杂志, 2020, 26(9): 184-193.
[36] 刘东静, 魏建和, 薛健, 等. 荆芥药材中薄荷酮与胡薄荷酮含量测定方法研究 [J]. 中华中医药杂志, 2010, 25(4): 534-537.
[37] 温桃群. 荆芥挥发油与胡薄荷酮对LPS中毒模型小鼠的抗炎效应及NLRP3通路机制研究 [D]. 成都: 成都中医药大学, 2017.
[38] 何婷, 汤奇, 曾南, 等. 荆芥挥发油及其主要成分抗流感病毒作用与机制研究 [J]. 中国中药杂志, 2013, 38(11): 1772-1777.
[39] 高万丰. 升麻素苷通过靶向MDSCs增强PD-1抑制剂抗肿瘤效果的研究 [D]. 天津: 南开大学, 2019.
[40] 张阳, 姜华茂. 川陈皮素对人前列腺癌DU145细胞生长的抑制作用及其机制 [J]. 吉林大学学报: 医学版, 2020, 46(6): 1260-1266.
[41] 严永旺, 肖兰, 周旭, 等. 绿原酸的药理作用及药用研发对策 [J]. 中国药房, 2017, 28(19): 2729-2732.
[42] 王路, 孙睿, 徐萌, 等. 阿魏化学成分、药理作用及毒理研究进展[J]. 世界中医药, 2020, 15(24): 3887-3894.
[43] 饶文婷, 罗尚菲, 张雅心, 等. 阿魏酸对高脂血症小鼠肝脂肪变性及肠道菌群的调节作用 [J]. 中国实验动物学报, 2020, 28(1): 36-42.
Chemical constituents of Jingfang Granules based on GC-MS and UPLC-Q Exactive MS
LIANG Hong-bao1, 2, 3, JIANG Yu-jun2, 3, YUAN Xiao-mei3, YAO Jing-chun2, 3, QIU Rong-ying2, YANG Min1, ZHANG Gui-min2, 3, LI Feng1
1. Shandong University of Traditional Chinese Medicine, Jinan 250355, China 2. Shandong New Time Pharmaceutical Co., Ltd., Linyi 276006, China 3. State Key Laboratory of Generic Manufacture Technology of Chinese Traditional Medicine, Lunan Pharmaceutical Group Co., Ltd., Linyi 276006, China
To investigate the chemical composition of Jingfang Ganules (荆防颗粒), and analyze its fragmentation pattern.The volatile and non-volatile chemical components in Jingfang Granules were qualitatively analyzed by GC-MS and UPLC-Q-Exactive MS in positive and negative ion mode, respectively.A total of 24 compounds (19 terpenoids, two aldehydes, two esters and one aromatic ether) were identified by GC-MS. And a total of 85 compounds, (25 coumarins, six lignans, 15 flavonoid glycosides, 15 flavonoids, nine organic acids, five glycosides, four triterpenoids and six other compounds) were identified by UPLC-Q Exactive MS and combined with reference materials, related literatures and database retrieval.The separation and identification methods of Jingfang Granules by GC-MS and UPLC-Q Exactive MS were established, which provided a foundation for further research of pharmacodynamic material basis of it.
Jingfang Granules; GC-MS; UPLC-Q Exactive MS;fragmentation pattern; terpenoids; coumarins; lignans
R284.1
A
0253 - 2670(2022)06 - 1697 - 12
10.7501/j.issn.0253-2670.2022.06.012
2021-09-06
国家重大新药创制专项(2017ZX09301058)
梁红宝(1985—),男,山东济宁人,博士研究生,研究方向为中药创新药物。Tel: 18764932621 E-mail: lianghongbao1985@163.com
李 峰(1957—),男,教授,博士生导师,研究方向为中药质量控制与资源研究。E-mail: 13969141796@163.com
[责任编辑 王文倩]

