NF-κB参与感染诱导血管内皮细胞DcR3表达升高的初步研究*
陈洪卫,侯彦强
上海市松江区中心医院检验科,上海 201600
脓毒症是由各种致病性微生物(包括细菌、真菌)侵入人体而引起的全身炎性反应。近年来脓毒症的发病率呈上升趋势,其细菌成分内毒素(LPS)、脂磷壁酸(LTA)以及酵母聚糖(zymosan)是重要的致病物质,可导致组织损伤和脓毒症的发生[1]。有研究表明,内皮细胞的大量活化参与了脓毒症发病的病理过程[2]。诱骗受体3(DcR3)是新近发现的一种缺乏穿膜结构域的可溶性肿瘤坏死因子受体超家族成员,在自身免疫性疾病、炎症性疾病和肿瘤组织中的表达都有不同程度上调,其主要功能为抑制炎症、抵抗凋亡和促进肿瘤细胞的增殖与分化[3]。本课题组前期研究发现脓毒症患者血清DcR3表达升高,为了进一步探讨DcR3在脓毒症中的功能及表达升高的机制,本研究用革兰阴性菌细胞壁的主要成分LPS、革兰阳性菌细胞壁的主要成分LTA以及真菌细胞壁的主要成分zymosan刺激人血管内皮细胞(HUVEC),并检测细胞上清液以及细胞内DcR3表达水平的变化,旨在阐明核转录因子-κB(NF-κB)参与感染诱导DcR3表达升高的信号转导机制。
1 材料与方法
1.1材料来源 采用购于上海艾研生物科技有限公司的HUVEC,分别用0.1、1.0、10.0 μg/mL LPS,5、50、500 ng/mL LTA和10、100、1 000 μg/mL zymosan,低、中、高3种浓度刺激HUVEC,设置4个处理组:LPS组、LTA组、zymosan组和正常对照组(未经过LPS、LTA和zymosan刺激的HUVEC)。
1.2仪器与试剂 大肠杆菌内毒素0111:PDTC、V0126、PD9859、B412630、CTA以及zymosan均购自美国Sigma公司;TLR2以及TLR4抗体购自美国Santa Cruz公司;DcR3 酶联免疫吸附试验(ELISA)试剂盒购置于上海蔚霆生物科技有限公司;反转录和PCR试剂、DcR3和GAPDH抗体购置于上海生工生物工程有限公司。iMark酶标仪购于美国伯乐公司;ABI 7500实时荧光定量PCR(qPCR)仪购于美国ABI公司;FACSCaliburTM流式细胞仪购于美国BD公司。
1.3细胞培养及传代 -80 ℃冰箱中取出HUVEC细胞冻存管,迅速放入37 ℃水浴中,不停摇动,使其在1 min内融化,无菌条件下吸出细胞,1 000 r/min离心5 min,弃上清液,加入适量培养液重悬接种于培养瓶中,5% CO2、37 ℃培养箱培养。待细胞长满细胞瓶时,进行传代,弃去旧培养液,磷酸盐缓冲液(PBS)漂洗一次,再加入1.5 mL胰酶消化,镜下观察细胞回缩变圆、间隙增大时,加入新鲜培养基终止反应,反复吹打细胞重悬,1∶3转移入培养瓶,5% CO2、37 ℃培养箱继续培养。
1.4药物诱导细胞 调整并计数细胞使各孔105个细胞,置于24孔细胞培养板。待细胞贴壁达到约80%时,PBS洗涤细胞2次后,分别用0.1、1.0、10.0 μg/mL LPS,5、50、500 ng/mL LTA和10、100、1 000 μg/mL zymosan,低中高3种浓度刺激细胞,刺激时间为12、24、48 h,各小组设3个复孔,重复实验3次。
1.5采用ELSIA检测细胞上清液DcR3水平 单克隆抗体(mAb)包被ELISA板过夜,次日洗板,5%牛血清清蛋白(BSA)封阻。将各组细胞上清液及DcR3纯标准品加入酶标板中室温孵育2 h,洗液洗板4次,加入生物素化的二抗室温孵育2 h,洗液洗板4次,加入辣根过氧化物酶结合物工作液室温孵育30 min,洗液洗板4次,加入显色底物(TMB),避光孵育15 min,加入终止液,混匀后在酶标仪上测量A450。以吸光度为纵坐标,以标准品浓度为横坐标,绘制标准曲线,根据标准曲线得出各组细胞上清液中DcR3浓度。
1.6qPCR技术检测细胞内DcR3 mRNA的表达 Trizol裂解细胞抽提总RNA并逆转录成cDNA,采用SYBR green法对DcR3 mRNA的表达水平进行检测。DcR3特异性引物由上海生工生物工程有限公司合成(表1)。利用ABI 7500 qPCR仪进行基因扩增。PCR反应条件为:95 ℃预变性30 s;95 ℃变性5 s,60 ℃退火并延伸34 s,进行40个循环。收集每个PCR延伸期的荧光,反应产物经溶解曲线检测特异性,经SDS2.2软件分析循环阈值(Ct)值。以GAPDH作为内参(表1)。采用2-ΔΔCt表示计算mRNA的表达,其中ΔΔCt=ΔCt(实验组)-ΔCt(对照组),ΔCt=Ct(靶基因)-Ct(内参基因)。

表1 DcR3和内参GAPDH引物序列
1.7Western blot检测细胞内DcR3蛋白的表达 以RIPA裂解细胞,BCA蛋白定量试剂盒定量后,取50 μg蛋白,水浴煮沸10 min后进行10.00%十二烷基硫酸钠/聚丙烯酰胺(SDS-PAGE)电泳,并转移至PVDF膜上。5.00%脱脂蛋白室温封闭2 h,加入适量的DcR3和GAPDH抗体,4 ℃孵育过夜,0.10%的PBST漂洗3次,每次5 min。加辣根过氧化物酶标记的二抗,室温孵育1 h后,PBST洗3次,每次5 min。结果用ECL-Plus化学发光试剂盒检测,以X线胶片曝光、显影和定影,并观察结果。
1.8流式细胞术检测细胞表面TLR2和TLR4的表达水平 在细胞培养24 h后,收集细胞,以PBS洗3次,调整细胞浓度为2×106/mL,取100 μL细胞悬液与5 μL FITC-抗人TLR2单抗及5 μL PE-抗人TLR4单抗混匀;同时设阴性对照,置4 ℃下孵育30 min,PBS洗3次后重悬于PBS中,用流式细胞仪检测,以CellQuest软件分析。
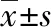
2 结 果
2.1HUVEC细胞表面TLR2和TLR4的表达水平 HUVEC细胞培养24 h后,用流式细胞术检测细胞表面TLR2和TLR4的表达水平。如图1所示,HUVEC细胞表面既表达TLR2又表达TLR4。其中表达TLR2的细胞百分比为(82.23%±2.15%),表达TLR4的细胞百分比为(77.87%±1.06%)。
2.2LPS、LTA以及zymosan刺激细胞后上清液中DcR3表达水平的改变 如图2所示,低浓度LPS(0.1 μg/mL)、LTA(5 ng/mL)以及zymosan(10 μg/mL)刺激细胞后上清液中DcR3表达水平无明显升高,中、高浓度LPS(1.0、10.0 μg/mL)、LTA(50、500 ng/mL)以及zymosan(100、1 000 μg/mL)刺激细胞后上清液中DcR3表达水平明显高于正常对照组,差异有统计学意义(均P<0.05),且高浓度组DcR3表达水平比中浓度组明显增高,差异有统计学意义(均P<0.05)。高浓度刺激后12 h,上清液中DcR3的表达稍有升高,随着时间延长到24 h,上清液中DcR3的表达与正常对照组相比明显升高,差异有统计学意义(P<0.05)。
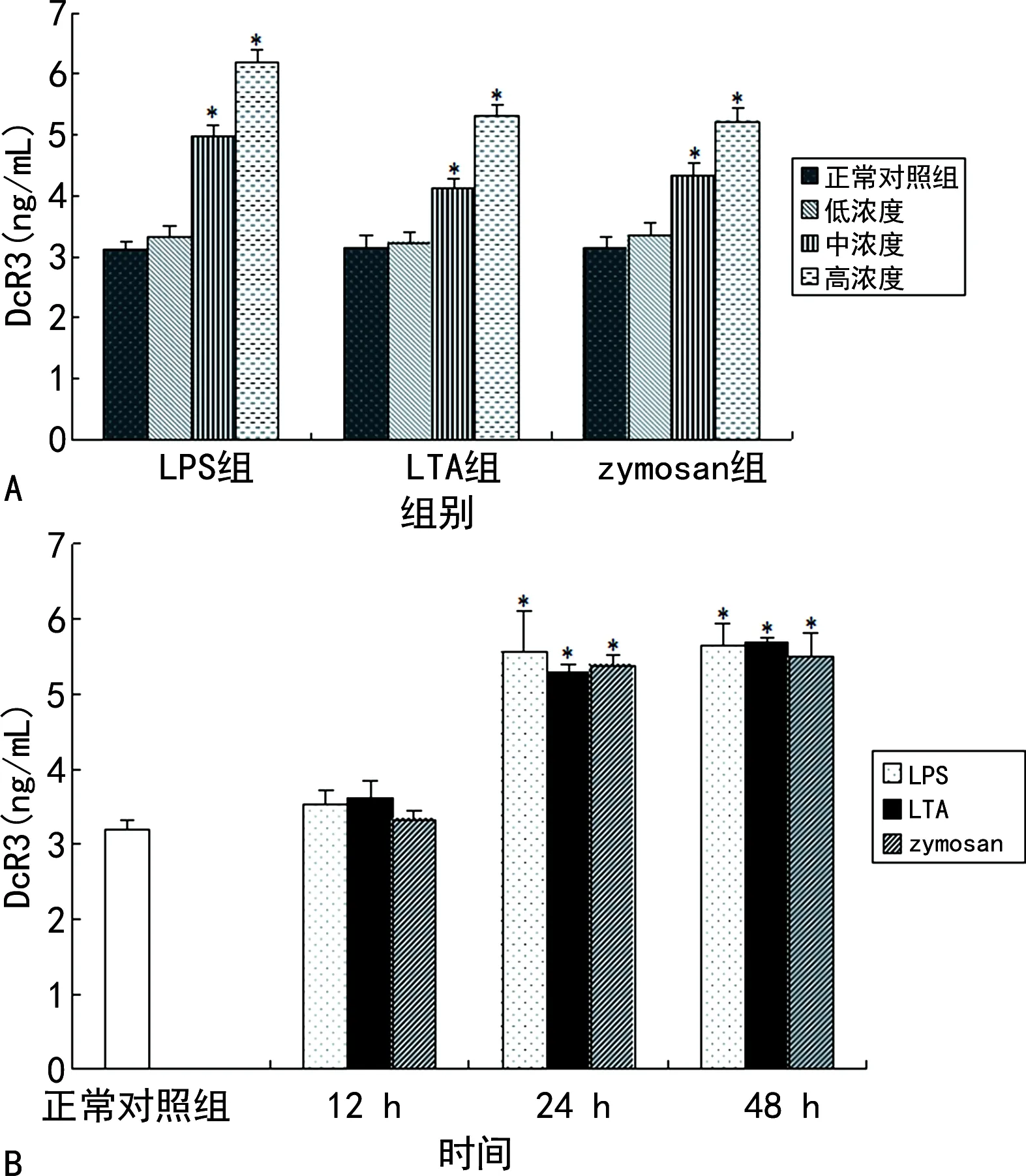
2.3LPS、LTA以及zymosan刺激细胞后细胞内DcR3 mRNA的表达变化 高浓度LPS(10.0 μg/mL)、LTA(500 ng/mL)以及zymosan(1 000 μg/mL)刺激细胞后细胞内DcR3 mRNA的表达见图3。正常对照组、高浓度LPS刺激组、高浓度LTA刺激组以及高浓度zymosan刺激组细胞内DcR3 mRNA的相对表达水平分别为(1.00±0.05)、(2.28±0.26)、(1.98±0.30)、(2.10±0.16)。经统计学分析显示,经高浓度LPS、LTA以及zymosan刺激后细胞内DcR3 mRNA表达明显升高,差异有统计学意义(均P<0.01)。刺激12 h后,细胞内DcR3 mRNA的表达明显升高,与对照组相比差异有统计学意义(均P<0.05)。
注:A为分别用0.1、1.0、10.0 μg/mL LPS,5、50、500 ng/mL LTA以及10、100、1 000 μg/mL zymosan刺激细胞24 h后,收集细胞上清液,ELISA法检测上清液中DcR3的表达;B为分别用10.0 μg/mL LPS、500 ng/mL LTA以及1 000 μg/mL zymosan刺激细胞12、24、48 h后,收集细胞上清液,ELISA法检测上清液中DcR3的表达;与对照组比较,*P<0.05。

注:流式检测细胞TLR2和TLR4受体;A为阴性对照;B为TLR2表达;C为TLR4表达。
2.4LPS、LTA以及zymosan刺激细胞后细胞内DcR3蛋白的表达变化 Western blot检测LPS、LTA以及zymosan刺激后细胞内DcR3蛋白的表达见图4,用高浓度LPS(10.0 μg/mL)、LTA(500 ng/mL)以及zymosan(1 000 μg/mL)刺激后细胞24 h后,细胞内DcR3蛋白的表达水平明显升高,与正常对照组相比,差异有统计学意义(均P<0.05)。
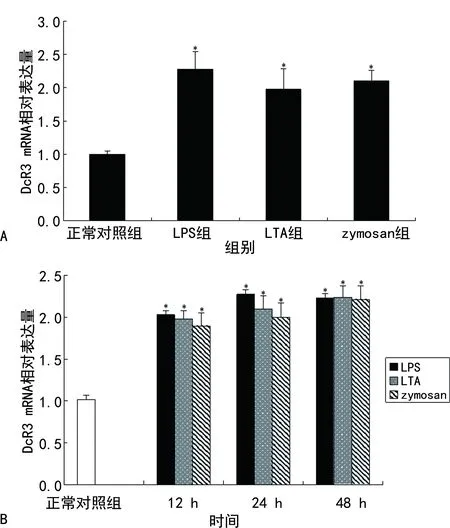
2.5NF-κB信号通路参与了DcR3的表达 在用LPS、LTA以及zymosan刺激的同时加入P38 MAPK抑制剂或NF-κB抑制剂,24 h后检测细胞内以及上清液中DcR3的表达,结果如图5所示,加入NF-κB抑制剂PDTC后,细胞上清液以及细胞内DcR3表达较未加抑制剂组明显下降,差异有统计学意义(P<0.05),而加入P38 MAPK抑制剂U0126和PD9859后,细胞上清液及细胞内DcR3的表达比较差异无统计学意义(P>0.05)。
注:A为分别用10.0 μg/mL LPS、500 ng/mL LTA以及1 000 μg/mL zymosan刺激细胞24 h后,收集细胞,qPCR检测细胞内DcR3 mRNA的表达;B为分别用10.0 μg/mL LPS、500 ng/mL LTA以及1 000 μg/mL zymosan刺激细胞12、24、48 h后,收集细胞,qPCR检测细胞内DcR3 mRNA的表达;与对照组比较,*P<0.05。

注:A为westen blot结果;B为DcR3与GAPDH的灰度比;与对照组比较,*P<0.05。
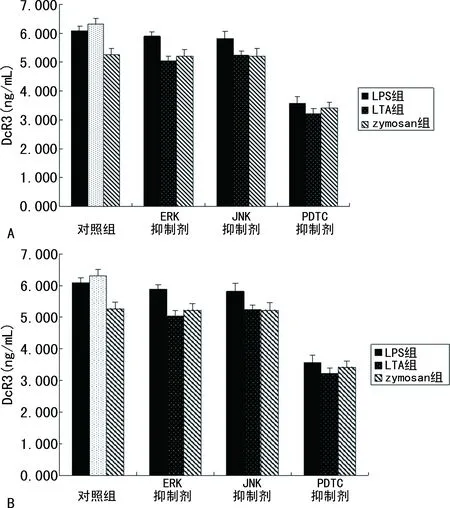
注:HUVEC细胞分别用10.0 μg/mL LPS、500 ng/mL LTA以及1 000 μg/mL zymosan处理的同时加入100 μm NF-κB抑制剂(PDTC)或20 μm ERK抑制剂(U0126)或JNK抑制剂(PD9859),细胞处理24 h后,收集上清液和细胞。A为上清液中DcR3表达水平的变化;B为细胞内DcR3 mRNA的表达水平。
3 讨 论
脓毒症是由感染引起的全身性炎性反应,研究表明,多种病原微生物的细胞壁成分(如革兰阴性菌的LPS、革兰阳性菌的LTA以及真菌的zymosan等)具有强大的抗原刺激能力,均可通过与细胞表面的受体结合,促进内皮细胞活化,释放大量炎症介质,最终导致失控性炎性反应[1-2]。有资料表明,TLRs是病原微生物跨膜信号传导的重要受体,介导了多种病原微生物的跨膜信号传导,其中TLR2和TLR4的作用尤为显著。TLR2识别能力广泛,能够识别革兰阳性菌、革兰阴性菌、真菌、螺旋体以及支原体等多种病原体的成分;而TLR4的识别能力较为局限,可能主要参与了LPS的识别与信号传递过程[4]。由于内皮细胞的激活在脓毒症中发挥了核心作用,本研究首先检测了内皮细胞表面TLRs受体的表达情况,结果显示内皮细胞系HUVEC细胞表面既表达TLR2又表达TLR4。
本课题组前期研究发现,脓毒症患者血清中DcR3表达水平明显高于健康者,且与疾病的严重程度密切相关,但DcR3在脓毒症中表达升高的机制目前尚不明确[5]。本研究利用不同细菌的细胞壁成分作为抗原刺激HUVEC细胞后,观察细胞内以及上清液中DcR3表达的变化。结果显示,LPS、LTA以及zymosan刺激HUVEC细胞,均可引起细胞内DcR3表达升高,其程度呈时间、浓度依赖性,同时上清液中DcR3的表达也升高。已知DcR3是新近发现的一种缺乏穿膜结构域的可溶性肿瘤坏死因子受体超家族成员,其在自身免疫性疾病、炎症性疾病和肿瘤组织中都有不同程度地表达上调。有研究证实,DcR3具有调节巨噬细胞分化、炎性细胞因子和趋化因子分泌的功能,参与免疫调节和免疫监视[6],提示DcR3可能参与脓毒症早期病理生理发病机制。
本研究结果显示,LPS、LTA以及zymosan刺激HUVEC细胞,均可引起细胞内DcR3表达升高,其中LPS的受体主要为TLR4,而LTA以及zymosan的受体主要为TLR2,由于TLR2和TLR4的胞内区在结构和功能上具有部分相似性,因此二者在细胞胞内具有一些共同途径进行信号传导,其中主要的两条途径为:(1)TLR2/TLR4-髓系分化蛋白(MyD88)/IRAK-NF-κB途径;(2)TLR2/TLR4-MyD88/IRAK-丝列原活化激酶(MAPK)途径[7]。为了进一步研究DcR3表达升高的具体机制,本研究在LPS、LTA以及zymosan刺激的同时,加入NF-κB和MAPK信号通路抑制剂,以检测DcR3的表达情况。结果表明,加入NF-κB抑制剂PDTC后,DcR3的表达水平明显下降,而加入MAPK抑制剂U0126和PD9859后,DcR3的表达水平无明显变化,这说明DcR3的表达与激活NF-κB通路有关,而与p38 MAPK通路无关。
NF-κB是一种特殊的核蛋白因子,能与多种蛋白的启动子和增强子序列位点发生特异性结合,促进基因的转录和表达,参与众多与免疫、炎性反应有关的基因转录,同时也参与细胞增殖和凋亡调控等过程[8]。在MAPK通路中,ERK和JNK是并列的两条通路,也是被人们了解最多的成员,该通路的激活在炎性反应过程中也起着关键作用,如产生炎性因子白细胞介素(IL)-1β、IL-6等,还参与细胞生长和细胞周期运行等过程[9],但本研究发现在HUVEC细胞中,MAPK抑制剂不能阻断LPS、LTA以及zymosan诱导的DcR3的表达升高,进一步说明了在体外培养的HUVEC细胞中,革兰阴性菌、革兰阳性菌以及真菌通过TLRs-MyD88-NF-κB信号通路诱导DcR3的表达,参与炎症的发生,本研究结果初步阐述了DcR3在脓毒症中表达升高的机制,下一步笔者将通过过表达以及干扰实验对DcR3在脓毒症中的功能进行研究。

