细胞免疫治疗联合化疗治疗晚期非小细胞肺癌的效果
在我国经济快速发展的过程中,人口老龄化进程也越来越严重,恶性肿瘤的患病人数也越来越多,而肺癌则是增长率最明显的一种恶性肿瘤[1]。就诊时大部分患者都已处于疾病晚期,肿瘤负荷较大,化疗、放疗、手术等传统治疗方法无法对残余病灶进行彻底清除,进而引起肿瘤转移、复发。现阶段临床中在对晚期(Ⅲ B或Ⅳ期)或局部晚期患者进行治疗时,常用的治疗方式包括物理消融、细胞免疫治疗、分子靶向治疗、放疗、局部化疗、全身化疗等[2]。现代医学技术的不断发展,虽然在一定程度上提升了肺癌患者的综合治疗水平,但是却并没有显著改善其生存期,而在提出了肿瘤是一种慢性疾病这一概念后,在治疗肿瘤患者时,也开始更加关注其生存的量与质,所以选择耐受性更好、低毒、高效的方法来治疗肿瘤患者就显得非常关键,近年来临床开始更加关注和重视细胞免疫治疗[3]。本研究主要分析了细胞免疫治疗联合化疗对晚期非小细胞肺癌的疗效及不良反应,希望能为晚期非小细胞肺癌的防治提供指导。
1 资料与方法
1.1 一般资料
选取医院2015年1月—2016年12月收治的50例晚期非小细胞肺癌患者作为对照组,选取医院2017年1月—2018年12月收治的50例晚期非小细胞肺癌患者作为试验组。纳入标准:年龄为18~75岁;经细胞学或病理组织学检查确诊为初治肺鳞癌或者肺腺癌[4];临床分期为Ⅲ B或者Ⅳ期;功能状态卡氏(Karnofsky performance status,KPS)评分≥60分;过往并没有接受细胞免疫治疗;治疗前凝血功能和血常规无异常,重要脏器功能无异常,不存在严重基础疾病;不存在化疗和细胞免疫治疗禁忌证;无法开展放疗或者不愿采用放疗的患者;自愿接受细胞免疫治疗或化疗,患者或者其家属签署知情同意书。排除标准:脑转移患者;伴严重内科系统疾病、自身免疫系统疾病、重要脏器功能损害的患者;妊娠期或哺乳期女性。对照组中,28例男性,22例女性;其年龄26~71岁,平均(62.2±6.4)岁;KPS评分:18例患者≥80分,32例患者<80分;临床分期为:15例患者为Ⅲ B期,35例患者为Ⅳ期;病理类型:30例患者为腺癌,20例患者为鳞癌;病灶大小:28例患者的病灶直径>3 cm,22例患者的病灶直径≤3 cm。试验组中,27例男性,23例女性;其年龄为23~73岁,平均(61.5±6.8)岁;KPS评分:21例患者≥80分,29例患者<80分;临床分期:17例患者为Ⅲ B期,33例患者为Ⅳ期;病理类型:31例患者为腺癌,19例患者为鳞癌;病灶大小为:29例患者的病灶直径>3 cm,21例患者的病灶直径≤3 cm。两组的各项基线资料比较差异无统计学意义(P>0.05),具有可比性。
1.2 方法
对照组接受单纯化疗治疗,试验组接受细胞免疫治疗联合化疗治疗;具体的治疗方法如下。
(1)细胞免疫治疗:①采集血细胞:化疗前1 d,通过血细胞分离机对患者外周血进行采集,采集大约30~50 mL的血细胞,采集后应及时送到GMP实验室。②分离外周血单个核细胞(peripheral blood mononuclear cells,PBMC):新鲜外周血在采集完成之后,应转入到离心管内,进行10 min的离心处理,离心速率为1 500 r/min,选取表面血浆,选择装有淋巴细胞分离液的离心管分装底层的有核细胞,并进行20 min的离心处理,离心速率为2 000 r/min,选取离心管内的白膜层,也就是PBMC。③计数细胞:选择生理盐水进行2次洗涤,每次进行8 min离心处理,离心速率为1 800 r/min,将上清去除,选择无血清的RPMI1 640培养液重悬细胞,选择计数板对细胞进行计数,细胞终浓度调整为2×106/mL。④培养树突状细胞(dendritic cell,DC):在6孔板内接种分离出的PBMC混悬液,每孔所加入的细胞混悬液为2 mL,放置在标准细胞培养箱内进行2 h孵育。孵育完成后,选择悬浮细胞用于培养细胞因子诱导的杀伤细胞(cytokine induced killer,CIK),在6孔板的每一个孔中加入DC完全培养液2 mL,放置在培养箱内进行培养。定时换液,并对细胞状态进行观察。在培养到第5 d时,将肿瘤裂解物加入到6孔板内,在第6 d加入肿瘤坏死因子-α,促进DC成熟,对内毒素、真菌、细菌进行检测,加强质量监控,第8 d进行回输,回输之前应对内毒素、真菌以及细菌进行再次检测。⑤培养CIK细胞:对细胞悬液进行离心洗涤处理,选择无血清RPMI1 640培养液重悬,细胞密度控制为2×106/mL,在培养瓶内进行接种处理,加入包含干扰素-γ的无血清RPMI1 640培养液,放置在细胞培养箱内进行24 h的培养。第2 d加入白介素-1α、CD3单抗和白介素-2,同时将细胞转入到细胞培养袋内。每隔2~3 d进行1次细胞计数,同时应加入CIK细胞完全培养基,细胞密度维持在2×106/mL,并加入白介素-2。当培养到第8天时,根据DC:CIK为1:10~30的比例,在细胞培养带内加入抗原致敏的DC,进行3~5 d配天则可以进行回输。⑥细胞回输:细胞回输时间为第1周期、第2周期化疗间期,从第8 d开始进行DC回输,隔天进行1次回输,共进行4次回输,从第12 d开始进行CIK细胞回输,每天进行2次回输,持续进行3 d回输。收集到的DC和CIK细胞,选择100 mL包含1%人的自体血清白蛋白的生理盐水开展混悬处理,经外周静脉完成回输。
(2)化疗方案:放疗方案为多西他赛或者紫杉醇联合铂类,按照药物剂量标准、患者一般情况、体表面积对药物剂量进行确定,化疗周期为3周。
1.3 观察指标
(1)近期疗效:在结束第2周期化疗后3周,按照实体瘤疗效评价标准对临床疗效进行评估[5],具体可分为完全缓解(complete response,CR)、部 分缓 解(partial response,PR)、疾病稳定(stable disease,SD)、疾病进展(progressive disease,PD),CR例数与PR例数之和则为有效(response rate,RR)例数,CR例数、PR例数、SD例数之和则为疾病控制(disease control rate,DCR)例数。(2)检测外周血淋巴细胞表型:分别在第1周期化疗前、第3周期化疗前,选择流式细胞仪对外周血中的CD4+细胞百分比、CD8+细胞百分比、CD4+/CD8+比值以及NK细胞百分比进行检测。(3)对治疗期间的不良反应发生情况进行统计记录。
1.4 统计学处理
本试验相关数据运用SPSS 21.0软件做统计学处理,计数资料以(n,%)表示,组间数据比较进行χ2检验,计量资料以(±s)表示,组间数据比较进行t检验,以P<0.05为差异有统计学意义。
2 结果
2.1 近期疗效观察
对照组、试验组的RR分别为38.0%、48.0%,两组比较差异无统计学意义(P>0.05);试验组的DCR为66.0%,明显高于对照组的44.0%,差异有统计学意义(P<0.05),如表1。

表1 近期疗效观察 [例(%)]
2.2 外周血中淋巴细胞表型变化情况观察
治疗前两组的CD4+细胞百分比、CD8+细胞百分比、CD4+/CD8+比值以及NK细胞百分比的比较差异无统计学意义(P>0.05);治疗后试验组的CD4+细胞百分比、CD4+/CD8+比值以及NK细胞百分比均明显高于对照组,比较差异有统计学意义(P<0.05);而两组治疗后的CD8+细胞百分比比较差异无统计学意义(P>0.05)。与治疗前相比,试验组治疗后的CD4+细胞百分比、CD4+/CD8+比值以及NK细胞百分比均明显升高,差异有统计学意义(P<0.05),而CD8+细胞百分比则明显降低,差异有统计学意义(P<0.05);与治疗前相比,对照组治疗后的CD4+细胞百分比、CD8+细胞百分比以及NK细胞百分比均明显降低,差异有统计学意义(P<0.05);治疗前后对照组的CD4+/CD8+比值比较差异无统计学意义(P>0.05),如表2。
表2 外周血中淋巴细胞表型变化情况观察(±s)
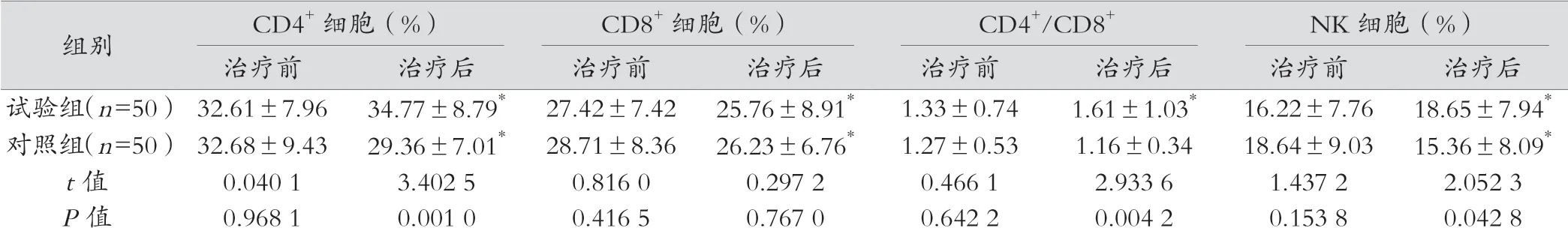
表2 外周血中淋巴细胞表型变化情况观察(±s)
注:*表示与治疗前相比,P<0.05。
组别 CD4+细胞(%) CD8+细胞(%) CD4+/CD8+ NK细胞(%)治疗前 治疗后 治疗前 治疗后 治疗前 治疗后 治疗前 治疗后试验组(n=50)32.61±7.96 34.77±8.79* 27.42±7.42 25.76±8.91* 1.33±0.74 1.61±1.03* 16.22±7.76 18.65±7.94*对照组(n=50)32.68±9.43 29.36±7.01* 28.71±8.36 26.23±6.76* 1.27±0.53 1.16±0.34 18.64±9.03 15.36±8.09*t值 0.040 1 3.402 5 0.816 0 0.297 2 0.466 1 2.933 6 1.437 2 2.052 3 P值 0.968 1 0.001 0 0.416 5 0.767 0 0.642 2 0.004 2 0.153 8 0.042 8
2.3 不良反应观察
试验组患者在CIK细胞回输24 h内,仅5例患者发生寒战、发热等症状,经对症支持治疗后患者症状显著改善;并没有患者因为CIK细胞回输而出现肾脏、心脏功能损害。与对照组相比,试验组治疗后的恶心、骨髓抑制Ⅲ~Ⅳ度发生率均明显降低,差异有统计学意义(P<0.05);而两组治疗后的骨髓抑制Ⅰ~Ⅱ度、外周神经毒性、肝功能损害发生率比较差异无统计学意义(P>0.05),如表3。

表3 不良反应发生情况观察 [例(%)]
3 讨论
肿瘤患病人数的不断增加以及临床病死率的不断增长,也导致肿瘤治疗模式得到了不断完善和变化,细胞免疫治疗现阶段开始受到了临床的关注和重视,成为了现阶段临床中的研究热点[6]。化疗作为现阶段临床治疗晚期非小细胞肺癌的首选方式,虽然化疗能对肿瘤细胞进行有效杀伤,让瘤体明显缩小,同时让患者生存期明显延长,但是因为肿瘤细胞的增殖速度较快,对化疗药物容易出现耐药性,多程化疗后患者体内蓄积大量的化疗药物毒物,可能对机体免疫功能和重要脏器功能造成损伤,进而让治疗失败,导致病情进展[7-9]。
动物模型实验以及体外实验均证实,CIK细胞能有效杀伤胶质瘤、胃癌、肾癌、肺癌以及肝癌等肿瘤细胞[10]。相关临床研究结果表明,采用CIK细胞免疫治疗不但能让肿瘤患者的近期治疗效果明显提升,同时还能对肿瘤复发进行预防,对患者生活质量进行显著改善,让其无进展生存率明显提高,毒副作用也比较轻微[11-12]。本研究中,对照组、试验组的RR分别为38.0%、48.0%,两组比较差异无统计学意义(P>0.05);试验组的DCR为66.0%,明显高于对照组的44.0%(P<0.05);结果表明,化疗与细胞免疫治疗具有比较理想的协同效果,能对晚期非小细胞肺癌患者的疾病控制率明显提高;因为患者肿瘤负荷大,随访时间并不长,所以临床有效率比较无明显差异。DC、CIK细胞能促进NK细胞核T细胞增殖,促进细胞因子的分泌,让外周血NK细胞百分比和CD4+百分比、CD4+/CD8+细胞比值提高,最终对患者免疫功能进行改善[13],本研究结果也证实了上述观点。另外,本研究中,试验组患者在CIK细胞回输24 h内,仅5例患者发生寒战、发热等症状,经对症支持治疗后患者症状显著改善;并没有患者因为CIK细胞回输而出现肾脏、心脏功能损害。与对照组相比,试验组治疗后的恶心、骨髓抑制Ⅲ~Ⅳ度发生率均明显降低,差异有统计学意义(P<0.05);结果表明,细胞免疫治疗联合化疗的毒副作用比较轻微,具有较高的安全性。
总之,细胞免疫治疗联合化疗能让晚期非小细胞肺癌患者的疾病控制率明显提高,对其免疫功能进行显著改善,而且毒副作用比较轻微,具有临床推广价值。

