响应面法优化大豆分离蛋白提取及复合酶解制备活性肽
孙会刚,陈志轩,周中驰,李凡松,王继良,张传丽,陈学红,李同祥*
(1.徐州工程学院 食品与生物工程学院,江苏 徐州 221018;2.廊坊农林科学院,河北 廊坊 065000)
大豆蛋白活性肽不但可以为人体提供大豆所能提供的营养成分,而且由于其自身特有的各种功能特性被广泛应用于食品工业与医疗领域[1]。目前而言,美国和日本在大豆蛋白活性肽研究方面遥遥领先世界其他国家,他们使用大豆蛋白活性肽作为原料用于生产幼儿食品、面包、饮料、运动员专用食品等多种食品。大豆活性肽在国外也常常作为功能保健食品的主要配料使用[2]。尽管我国大豆资源丰富,但是,我国的技术工艺不够成熟,所以目前对大豆蛋白活性肽的研究探索始终处于初级开发应用阶段。虽然也取得了一些成效,大豆蛋白活性肽也可以进行工业化大规模的生产,但是市场上的大豆蛋白活性肽产品还较少,根本不能满足不断增加的市场需求量,更无法与美、日两国媲美[3]。
利用大豆分离蛋白制备活性肽,首先要获得较高大豆蛋白的提取率,目前报道的大豆分离蛋白提取方法主要有酶解酸沉法[4]、膜分离法[5-7]及碱提酸沉法[8-9]等。但在大豆深加工领域,由于成本低、技术水平要求低等优点,应用最多的仍然是碱提酸沉法。对于大豆分离蛋白提取方法的优化已有相关报道,但多数采用单因素或者正交的方法对其进行优化,而且涉及的影响因素也不够全面,本文采用响应曲面优化法对大豆分离蛋白提取的影响因素进行较全面的研究,有望更好地提高提取率。
为了获得高抗菌活性的大豆肽,本研究对大豆分离蛋白的提取方法进行优化,采用复合酶酶解法获得了高抗菌活性的大豆肽,为开发新型具有防腐保鲜及保健功能的食品添加剂提供了新的思路和资源。
1 材料与方法
1.1 材料
黄豆:来自廊坊农科院。
胰蛋白酶(猪胰):购自上海源叶生物科技有限公司;糜蛋白酶:购自南京都莱生物技术有限公司;其余试剂:均购自国药集团化学试剂有限公司。
1.2 实验方法
1.2.1 培养基
LB培养基:根据参考文献[10]制作。
1.2.2 大豆分离蛋白的提取
取适量黄豆去杂、烘干、粉碎、过筛,加入无菌水,液料比为10∶1,用NaOH调节pH值为碱性,水浴加热并搅拌,7000 r/min离心15 min去渣,重复3次,取上清;HCl调pH值为酸性,水浴加热并搅拌,7000 r/min离心15 min去渣,重复3次,取上清,加水溶解沉淀,用透析袋透析大豆分离蛋白水溶液过夜,真空冷冻干燥获得粗蛋白。
蛋白质提取率=提取的粗蛋白重量/原料大豆重量。
1.2.3 大豆分离蛋白提取的单因素优化
根据报道,大豆分离蛋白提取主要受碱提pH值、碱提时间、碱提温度和酸沉pH的影响。因此,以大豆分离蛋白提取率为考察指标,分别考察碱提pH(8,9,10,11,12)、碱提时间(40,50,60,70,80 min)、碱提温度(30,40,50,60,70 ℃)和酸沉pH(2.5,3.5,4.5,5.5,6.5)对大豆分离蛋白提取率的影响。
1.2.4 响应面实验优化大豆分离蛋白提取
在单因素实验的基础上,选取碱提时间、碱提温度、碱提pH、酸沉pH 4个变量为响应因子,以大豆分离蛋白提取率为响应值,采用Design Expert 8.0软件设计四因素三水平响应面实验[11-12]。分析各自变量对大豆分离蛋白提取率的显著性,建立数学模型,进行方差分析及回归分析,确定碱提酸沉法提取大豆分离蛋白的最佳工艺参数。实验因素水平设计见表1。
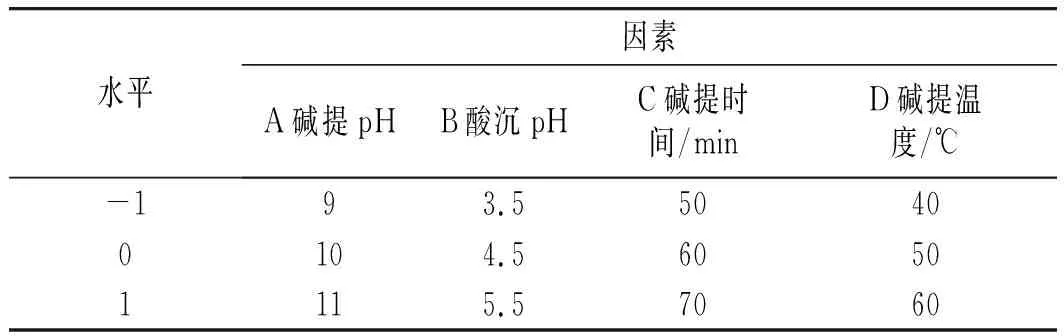
表1 响应面设计因素及水平Table 1 The factors and levels of response surface test
1.2.5 大豆分离蛋白酶解实验
取大豆分离粗蛋白2.0 g,加入无菌水60 mL搅拌溶解,90 ℃水浴10 min灭菌,温度降到室温后用 1 mol/L氢氧化钠调节pH值为7.5,按4000 U/g加入酶,45 ℃水浴4 h,沸水浴20 min使酶灭活,7000 r/min离心15 min去沉淀,重复3次,上清液即为酶解液。复合酶解所用到的酶及其性质见表2。
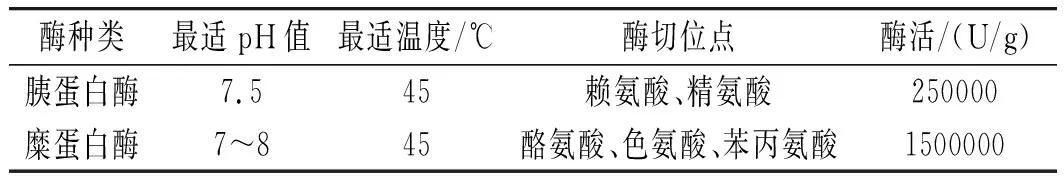
表2 实验所用酶的性质Table 2 The properties of the enzymes used in the test
1.2.6 活性肽抑菌实验
用牛津杯法测定活性肽的抑菌活性[13]。
1.2.7 活性肽的抗氧化活性
采用比色法进行定量分析[14]。
2 结果与分析
2.1 大豆分离蛋白的提取优化
2.1.1 碱提pH值对大豆分离蛋白提取率的影响
实验结果显示:碱提pH值对大豆分离蛋白提取率有较明显的影响,见图1。
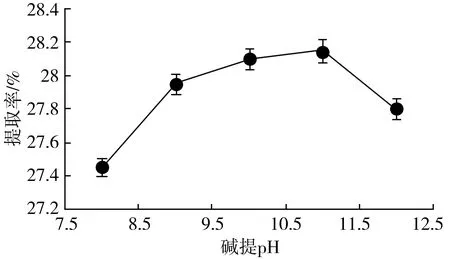
图1 碱提pH对大豆分离蛋白提取率的影响Fig.1 Effect of alkali extraction pH on extraction rate of soybean protein isolate
由图1可知,当pH值为8~11时,大豆分离蛋白的提取率随着pH值的升高而升高,pH值为11时提取率最高,为28.15%。继续增加pH值,提取率反而会下降,且下降较明显。提取率在pH 9~11之间变化幅度较小,所以响应面优化中碱提pH值的变量选取9,10,11。
2.1.2 碱提时间对大豆分离蛋白提取率的影响
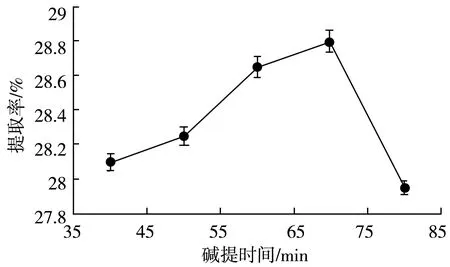
图2 碱提时间对大豆分离蛋白提取率的影响Fig.2 Effect of alkali extraction time on extraction rate of soybean protein isolate
碱提时间对蛋白质的提取率有一定影响但不明显,提取率数值变化幅度较小。由图2可知在40~70 min时,提取率缓慢上升;超过70 min后,蛋白质提取率下降且下降幅度大,蛋白质在碱提70 min左右达到平衡状态;超过70 min,则会浸出许多非蛋白质物质,影响所得蛋白质的纯度,进而影响蛋白提取效率,而且蛋白质长时间处于碱性环境下自身质会水解变性,蛋白提取效率也会下降。响应面优化蛋白质碱提时间变量为50,60,70 min。
2.1.3 碱提温度对大豆分离蛋白提取率的影响
碱提温度对蛋白质的提取率有一定影响,且影响也明显。由图3可知,随着温度不断上升,蛋白质提取率呈现先升后降的趋势,在30~50 ℃范围内,蛋白质分子运动速率不断加快,大量蛋白质分子进入碱提液,蛋白质提取率从27.25%提高到28.25%。温度超过50 ℃后,蛋白质提取率开始降低,70 ℃时提取率为27.65%。这是因为蛋白质在高温下变性,从而打破分子表面侧链基团与水分子相互作用力的平衡,碱提液的黏度增加,不利于蛋白质的溶出[15]。响应面优化蛋白质提取温度选取40,50,60 ℃。
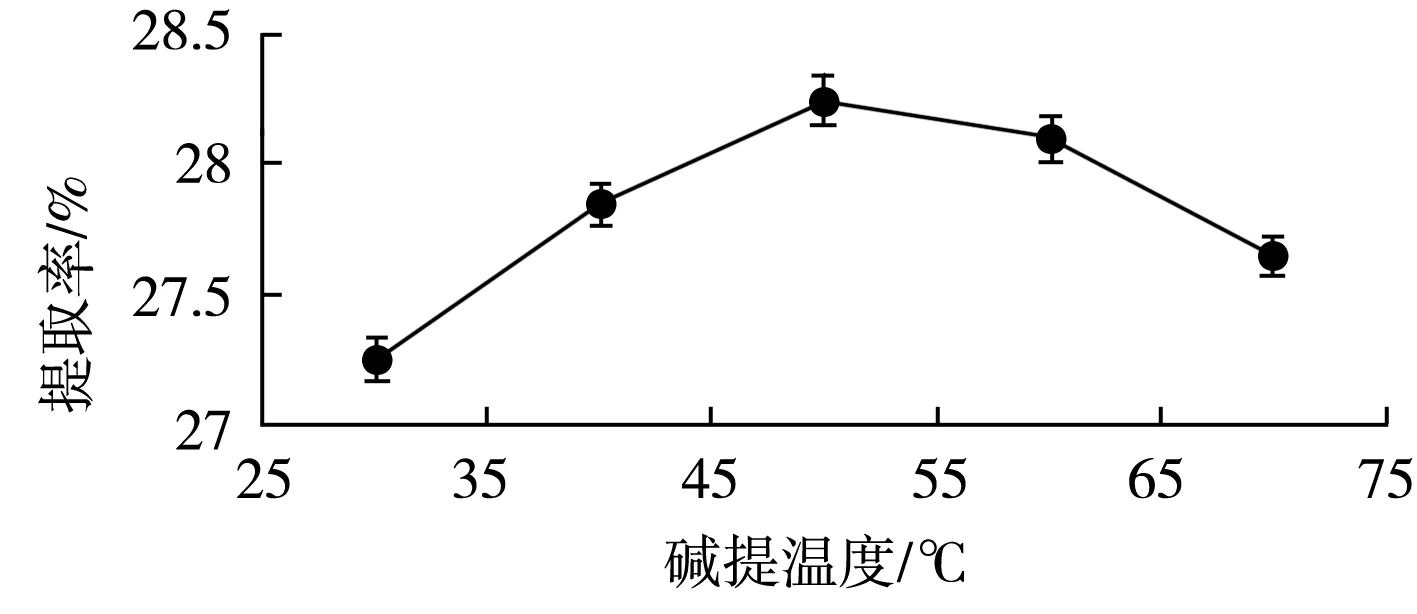
图3 碱提温度对大豆分离蛋白提取率的影响Fig.3 Effect of alkali extraction temperature on extraction rate of soybean protein isolate
2.1.4 酸沉pH对大豆分离蛋白提取率的影响
酸沉pH对大豆分离蛋白提取率有一定影响。由图4可知,大豆分离蛋白在其等电点pH 4.5附近提取率最大,这是因为此时大豆蛋白表面所携带的正、负电荷数量相差不大,呈电中性,蛋白质分子之间静电斥力大大减弱,反而增强了与水分子之间的相互作用力,此时蛋白质分子会聚集沉淀。此外在强酸条件下,肽键会被破坏,导致多肽链缩短,蛋白质沉淀会逐渐消失,所以在pH为2.5时,酸沉无沉淀。响应面优化蛋白质酸沉pH变量为3.5,4.5,5.5。
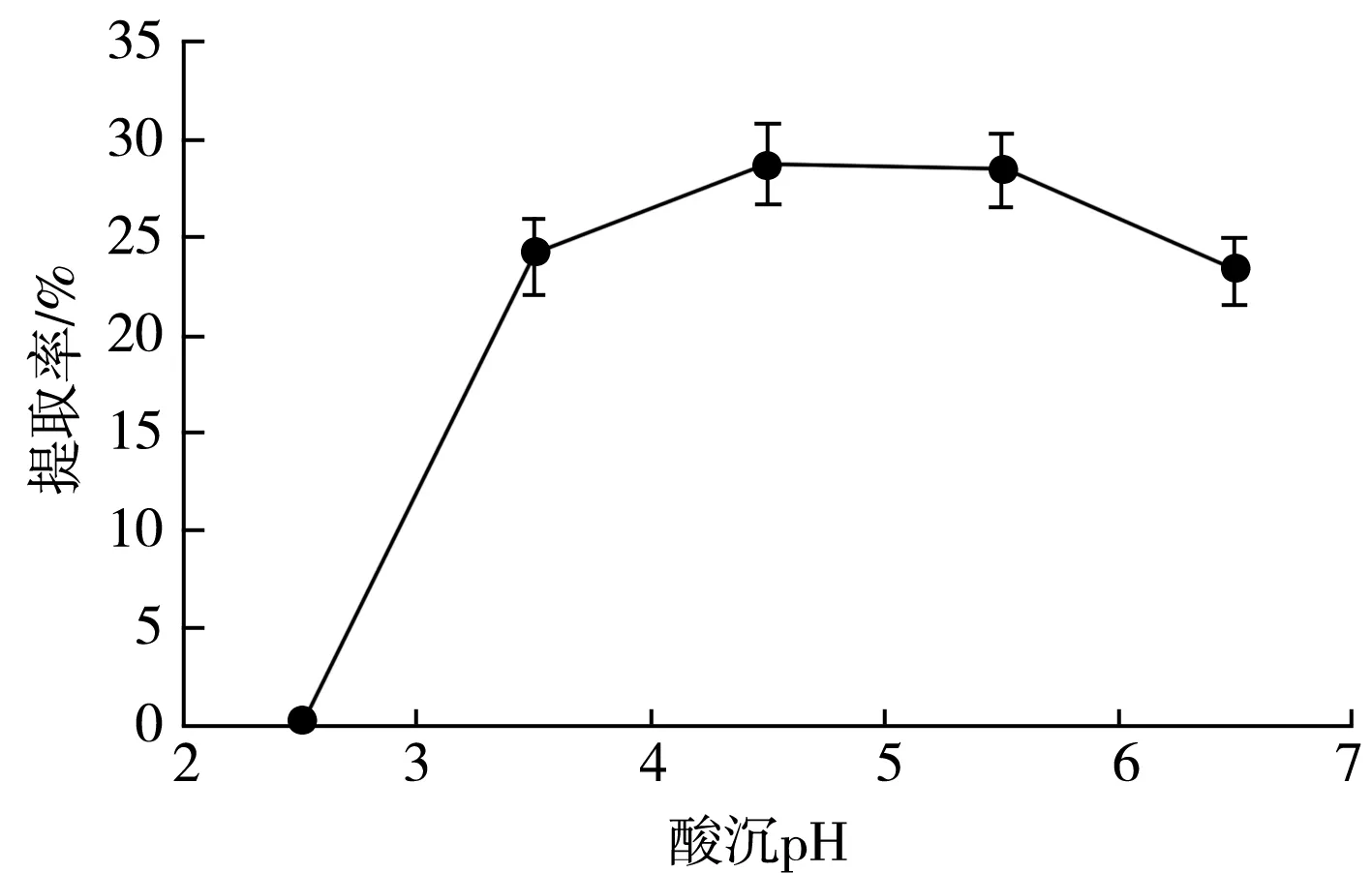
图4 酸沉pH对大豆分离蛋白提取率的影响Fig.4 Effect of acid precipitation pH on extraction rate of soybean protein isolate
2.2 Box-Behnken实验设计与结果
根据单因素实验结果,通过响应面设计法中的Box-Behnken对大豆分离蛋白提取进行优化。在29个实验组合条件下,设计方案和结果见表3。
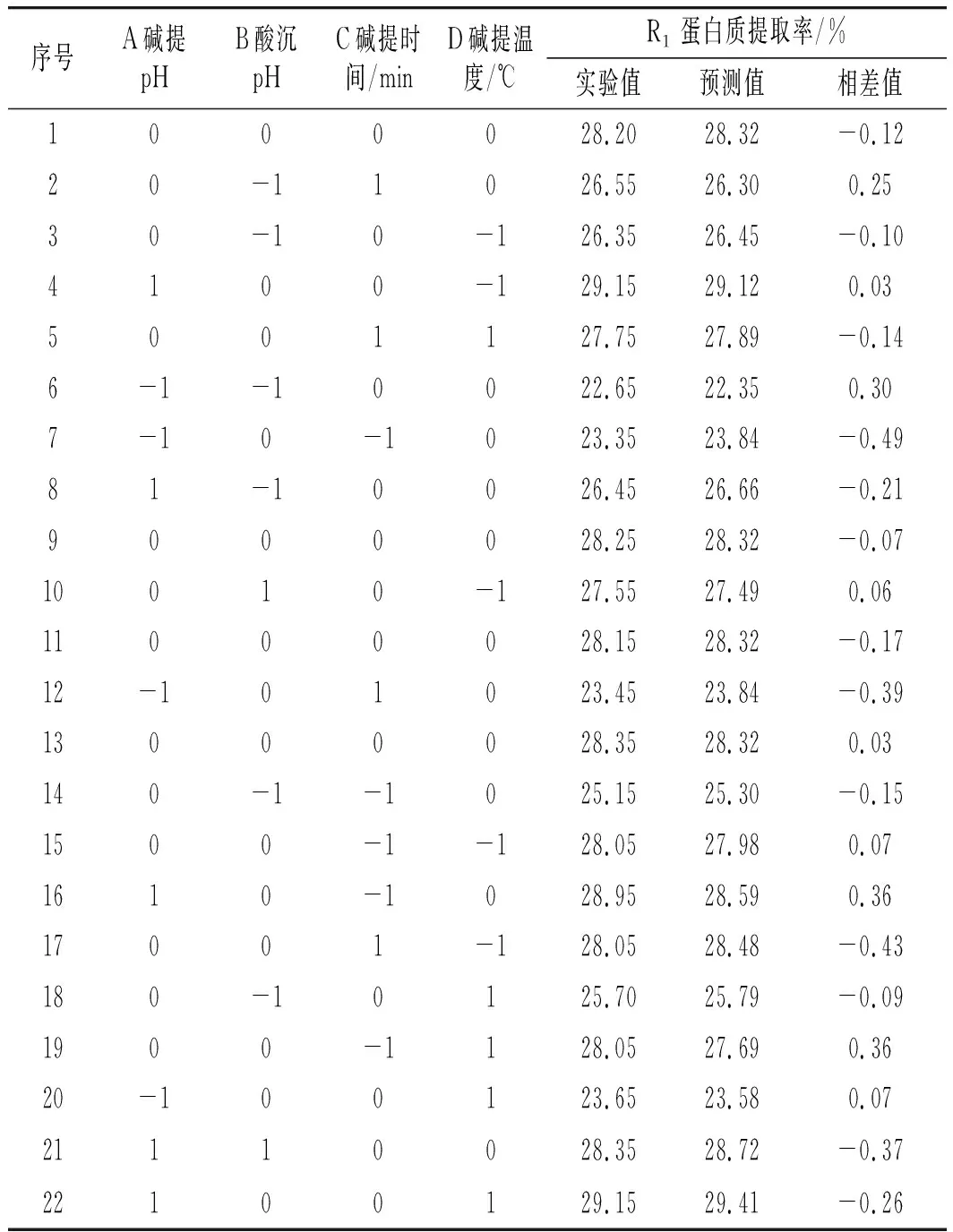
表3 响应面实验设计、预测值及结果Table 3 Response surface test design, predicted values and results
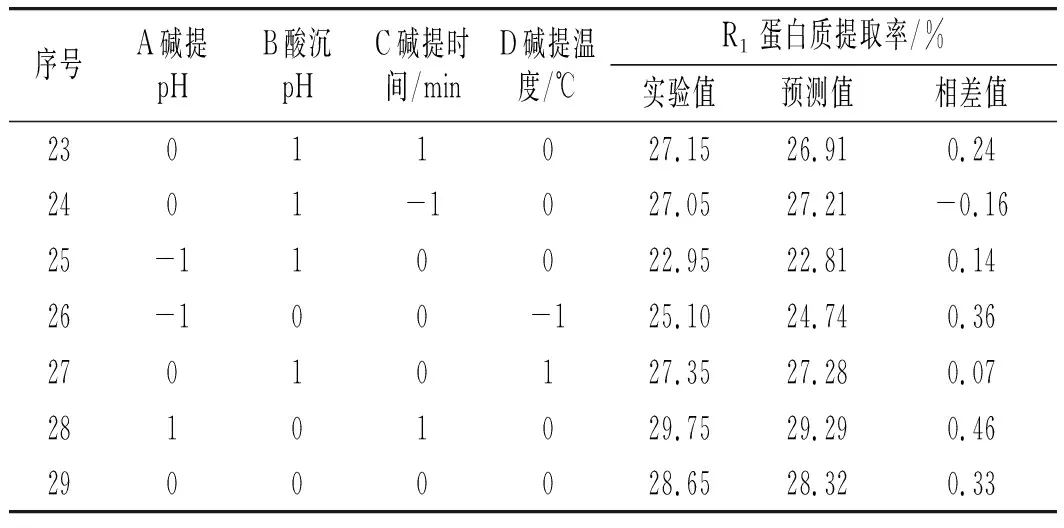
续 表
2.3 模型的建立与显著性分析
采用Design Expert 8.0软件可得响应值和被检变量的逻辑关系。获得大豆分离蛋白提取的二次多元回归方程(Y)为:Y=28.32+2.55A+0.63B+0.17C-0.22D+0.4AB+0.18AC+0.36AD-0.33BC+0.11BD-0.075CD-1.61A2-1.57B2-0.32C2+6.67×10-3D2。
利用软件进一步对模型进行分析以验证其有效性,模型的方差分析和显著性分析见表4。
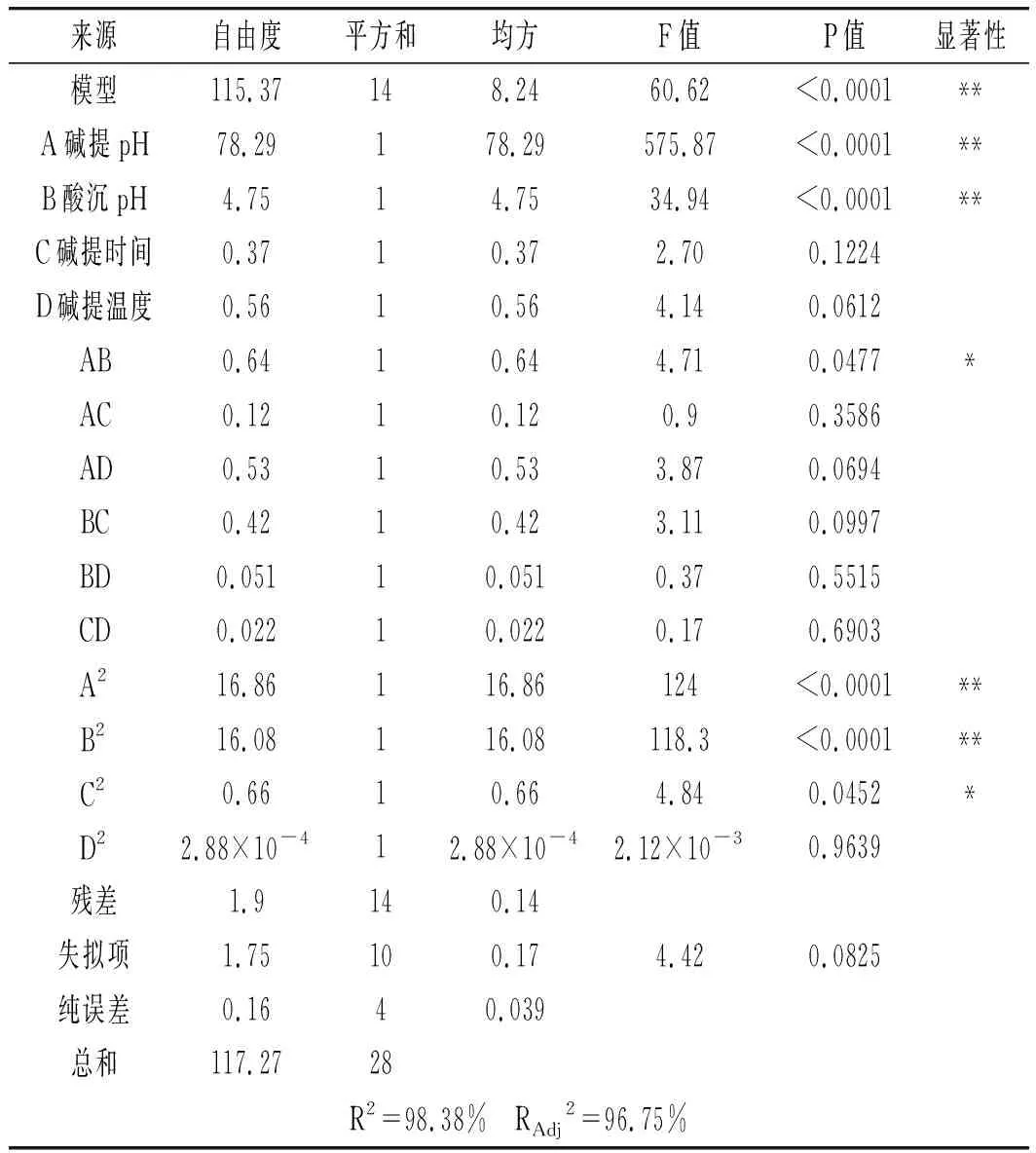
表4 回归方程方差分析和显著性检验Table 4 Analysis of variance and significance test of regression equation
由表4方差分析结果可知,在该实验模型中,响应值的决定系数(R2)为98.38%,表明蛋白质提取率中有98.38%的变化可以使用该模型解释。RAdj2=96.75%,表明大豆分离蛋白提取模型能在96.75%程度上解释实验结果,仅有3.25%不能用该模型表示。失拟项不显著(P>0.05),说明该模型拟合度较好。其中P值越小,则表明该变量对提取率的影响越大:A与B的P值小于0.0001,C与D的P值大于0.05,由此可知影响蛋白提取率的主要因素是碱提pH值与酸沉pH值,而碱提时间、碱提温度对大豆分离蛋白提取的影响较小。

图5 大豆分离蛋白影响因素三维响应曲面图Fig.5 Three-dimensional response surface diagrams of influencing factors of soybean protein isolate
由图5可知,随着碱提温度不断上升、碱提时间增加,蛋白提取率都呈先升后降的趋势且曲面变化幅度小,所以碱提温度和碱提时间两因素对蛋白提取率的影响很小。酸沉pH值不断升高,蛋白提取率呈先升后降的趋势且在蛋白质等电点附近达到最高点,曲面整体变化幅度非常大,表明酸沉pH对蛋白提取率的影响很大。碱提pH值曲面变化幅度类似酸沉pH值的变化幅度,又比碱提温度、碱提时间的变化幅度略大。所以酸沉pH值与碱提pH值对黄豆中大豆分离蛋白提取率的影响最大,碱提温度与碱提时间的影响最小。
由此模型预测出大豆分离蛋白的最佳提取条件(见表5),理论上蛋白提取率可达29.65%,根据实际操作条件对此模型进行验证(见表6),进行3次平行试验,实际蛋白提取率为29.25%,与预测值相差0.40%,因此该模型可以较准确地确定大豆分离蛋白的最佳提取工艺。大豆分离蛋白含量约为40%,有文献报道提取率达到70%以上[16],主要是因为提取率定义不同,文献提取率的定义是:提取的蛋白/原料中蛋白的含量,本研究中提取率为提取的蛋白重量/原料重量,如换算成文献报道的提取率,应该提取率也为75%左右。且文献中大豆分离蛋白提取多为提取后离心沉淀产物,而本研究中大豆蛋白提取以后经透析纯化后冷冻干燥获得,相对蛋白纯度更高。
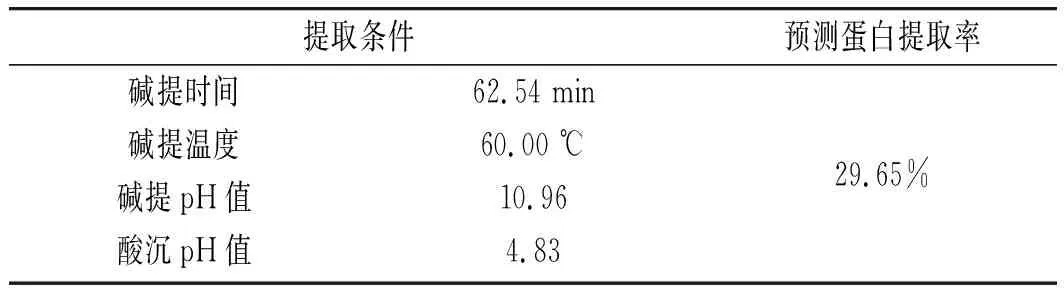
表5 模型预测最佳提取条件
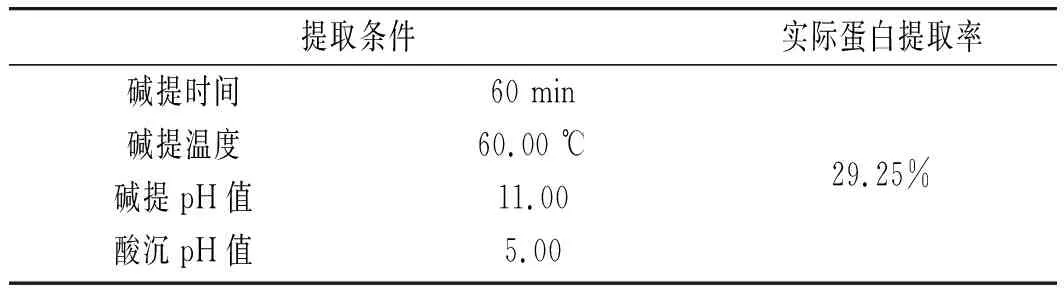
表6 实际测定最佳提取条件Table 6 The optimal extraction conditions of actual determination
2.4 复合酶解活性肽的抑菌活性
采用牛津杯法测定大豆分离蛋白活性肽的抑菌活性,结果显示:用胰蛋白酶和糜蛋白酶单独酶解制备的活性肽对金黄色葡萄球菌、沙门氏菌、蜡样芽孢杆菌均有抑菌活性,且活性大小差不多,而同时采用两种酶复合酶解制备的活性肽抑菌活性比两种酶单独酶解制备的活性肽都要强,说明两种酶复合酶解能制备活性更高的活性肽,见图6。
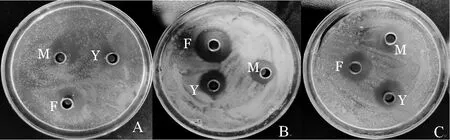
图6 3种酶解液抑菌活性对比Fig.6 Comparison of antibacterial activities of three hydrolysates
2.5 复合酶酶解活性肽的抗氧化活性
测定两种酶单酶酶解活性肽和复合酶酶解活性肽结果显示都有一定的抗氧化活性,且复合酶酶解制备的活性肽抗氧化活性最高,对DPPH自由基的清除率达到30.4%,见表7。
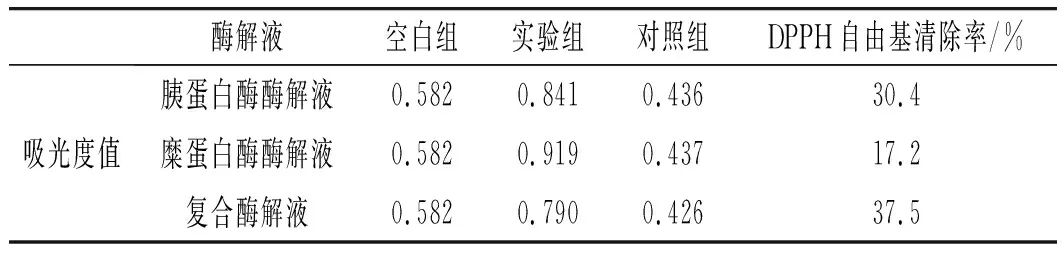
表7 3种酶解活性肽抗氧化能力测定Table 7 The determination of antioxidant capacity of three enzymatic active peptides
目前关于大豆分离蛋白活性肽抗氧化活性的报道不少,如孙莉莉等[17]采用碱性蛋白酶制备大豆活性肽并研究了其抗氧化活性,其对超氧阴离子自由基的清除能力达到41.2%,但该抗菌肽是经过分离纯化的,所以本研究复合酶酶解制备的活性肽抗氧化活性高低还需要进一步深入详细的比较研究才能确定。
3 结论
经单因素及响应面优化法确定大豆碱提酸沉法蛋白最佳提取工艺为碱提时间60 min、碱提温度60 ℃、碱提pH值11.0、酸沉pH值5.0,最佳提取工艺提取大豆分离蛋白提取率为29.25%。采用胰蛋白酶、糜蛋白酶复合酶解法获得对金黄色葡萄球菌、沙门氏菌、蜡样芽孢杆菌具有较高抑菌活性的大豆分离蛋白活性肽,且该活性肽对DPPH自由基的清除率达到37.5%,具有一定的抗氧化活性。该法制备的活性肽有望开发新型营养保健食品,或作为食品添加剂添加到其他食品中起到防腐保鲜和营养保健的功效,开发功能性食品。

