香菇多酚超声波提取工艺及抗氧化性分析
刘馥源,黄占旺,沈勇根,程宏桢,卢剑青,李晓明,安兆祥,徐弦
(江西农业大学 食品科学与工程学院江西省发展与改革委员会农产品加工与安全控制工程实验室,南昌 330045)
香菇(Lentinusedodes(Berk.) Sing)是白蘑科真菌香菇的子实体,又称香菌、香蕈和平庄菇等。香菇风味独特,质地优良,在我国被用作传统食品和药物。香菇是近年来我国发展最快的食用兼药用农产品,并且已成为食品行业和制药行业的重要资源[1]。香菇富含蛋白质、维生素、多糖、纤维素、多酚等多种营养成分[2]。
植物多酚是一类广泛存在于植物的皮、根、木、叶和果中的具有多元酚结构的重要次生代谢产物,常以酚酸和黄酮类化合物形式存在[3-4],研究表明,植物多酚具有抗氧化、抑菌、抗病毒和防癌抗癌等多种生理和药理活性[5-6]。目前植物多酚提取已成为研究热点,如牛肝菌多酚[7]、蜂蜜多酚[8]、茶多酚[9]、陈醋多酚等[10]。其中超声辅助提取技术,利用超声波在溶剂中产生的机械和空化作用,加速有效成分的溶出和扩散,简单方便,更有利于提取[11-12]。
目前国内外对香菇活性物质的研究主要集中在香菇多糖[13]、含氮物质[14]等成分的提取及应用上,而魏倩婷[15]采用溶剂提取法提取香菇多酚,得率为3.07 mg/mL,提取效果不佳。本试验以香菇为原料,采用超声波辅助技术提取香菇多酚,通过单因素试验,结合响应面法优化提取工艺,再用大孔树脂对香菇多酚进行分离纯化。另外,以香菇多酚清除DPPH、ABTS+、·OH自由基能力和还原能力考察了香菇多酚的抗氧化活性,从而拓宽了植物多酚的来源,为开发天然的抗氧化产品和对香菇产业化发展有一定的指导意义。
1 材料与方法
1.1 材料与试剂
香菇:山西省吕梁市;没食子酸、福林酚(1 mol/L)、DPPH(1,1-二苯基-2-三硝基苯肼)、ABTS(2,2′-联氮-双-3-乙基苯并噻唑啉-6-磺酸):北京索莱宝科技有限公司;无水碳酸钠;无水乙醇;NKA-9大孔树脂;磷酸氢二钠、磷酸二氢钾、氯化钾、过硫酸钾、铁氰化钾、三氯乙酸、三氯化铁、硫酸亚铁、双氧水、水杨酸、抗坏血酸:分析纯,南昌市芜锦生物科技有限公司。
1.2 仪器与设备
BYXX-50烘箱 杭州艾博科技工程有限公司;Q500B高速多功能粉碎机 上海冰都电器有限公司;SF-TGL-16G台式高速离心机 上海菲恰尔分析仪器有限公司;LXJ-ⅡB离心机 上海安寿科学仪器厂;WFJ 2100可见分光光度计 尤尼科(上海)科学仪器有限公司;SB-3200DTD超声波清洗仪、Scientz-10N冷冻干燥机 宁波新芝生物科技股份有限公司;RE-52AA旋转蒸发器 上海亚荣生化仪器厂。
1.3 试验方法
1.3.1 样品预处理
将新鲜的香菇置于60 ℃的烘箱中12 h,粉碎后过100目筛备用。
1.3.2 标准曲线的绘制
参照程宏桢等[16]的总酚提取方法,以没食子酸为标准品,采用Folin-Ciocalteu法[17]进行测定。精确称取10 mg没食子酸标准品,待完全溶解后定容至50 mL,得到浓度为0.2 mg/mL的没食子酸标准溶液。依次吸取上述浓度的标准溶液0,0.2,0.4,0.6,0.8,1.0 mL,并用蒸馏水加至1 mL后加入1 mL福林酚试剂,摇匀后避光静置6 min,再加入5 mL 5%碳酸钠溶液,充分混合后定容至25 mL避光放置1 h,在760 nm处测定各溶液的吸光度值。
1.3.3 香菇中多酚含量的测定
准确称取1 g香菇粉末于50 mL离心管中,按照料液比,加入一定体积的乙醇溶液进行超声波提取,4000 r/min离心10 min,取上清液于50 mL容量瓶中,残渣重复提取2次,定容至刻度,再根据1.3.2中的显色方法,计算香菇多酚溶液的得率。
多酚得率(mg/mL)=(c×n×v)/(m×1000)。
式中:c为经提取后的香菇中多酚的浓度(mg/mL);n为稀释倍数;v为溶液体积(mL);m为香菇粉末的质量(g)。
1.3.4 单因素试验
分别研究乙醇浓度(20%、30%、40%、50%、60%)、料液比(1∶25、1∶30、1∶35、1∶40、1∶45、1∶50,g/mL)、超声时间(20,30,40,50,60,70 min)、超声功率(100,120,140,160,180 W)、提取温度(30,40,50,60,70,80 ℃)下对香菇多酚得率的影响,确定最佳的工艺条件。
1.3.5 响应面设计
根据单因素试验的结果,运用Box-Behnken设计29组试验点进行响应面优化试验,确定超声辅助提取香菇多酚的最佳工艺。因素水平及编码的设计见表1。
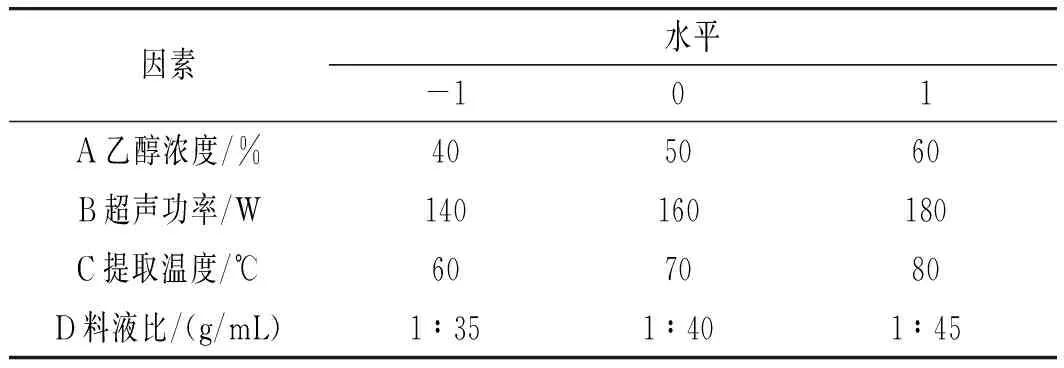
表1 响应面试验因素与水平Table 1 The factors and levels of response surface test
1.3.6 香菇多酚的分离纯化
1.3.6.1 大孔树脂选用和预处理
参照缪彬彬等[18]的大孔树脂纯化香菇多酚方法,将大孔吸附树脂用无水乙醇密封浸泡 24 h,用蒸馏水冲洗至无酒精味,接着用5%的氢氧化钠溶液浸泡24 h后用蒸馏水洗涤至中性,然后用5%的盐酸溶液浸泡24 h后洗涤至中性后备用。
1.3.6.2 香菇多酚物质的分离纯化
按照1.3.5设计完成的最佳提取工艺提取香菇粉中的多酚,提取液经离心、旋转蒸发浓缩至一定体积备用。将浓缩好的多酚粗提液缓缓注入装有大孔树脂的柱子中,分别用蒸馏水、30%的乙醇、50%的乙醇、70%的乙醇溶液依次进行洗脱,洗脱液再经旋转蒸发浓缩至少量体积后冷冻干燥,将干燥成粉末的各个洗脱组分测定其吸光度值。
1.3.7 香菇多酚抗氧化能力的测定
1.3.7.1 DPPH自由基清除能力的测定
分别取2 mL不同浓度(0.5,1.0,1.5,2.0,2.5,3.0 mg/mL)的香菇多酚溶液和2 mL 0.2 mmol/L的DPPH储备溶液加入同一试管中,摇匀,在室温下避光反应30 min,在517 nm波长处测定吸光度为Ai;空白对照为2 mL乙醇溶液,测得吸光度为A0;以相同浓度的2 mL VC溶液作为阳性对照,按下列公式计算清除率:
DPPH自由基清除率(%)=(A0-Ai)/A0×100。
1.3.7.2 ABTS+自由基清除能力的测定
精密称取40 mg ABTS+置于装有8 mL 1 mg/mL的过硫酸钾溶液的试管中,在4 ℃条件下避光16 h后加入32 mL超纯水,用无水乙醇定容至250 mL,低温避光12 h,可得ABTS+工作液。分别取0.5 mL不同浓度的香菇多酚溶液于另一试管中,添加50%的乙醇溶液至2 mL,再加入2 mL ABTS+工作液,混合摇匀,避光保存60 min,在734 nm波长处测定吸光度为Ai;以乙醇溶液为空白,测得吸光度为A0;采用VC溶液为阳性对照。按下列公式计算清除率:
ABTS+自由基清除率(%)=(A0-Ai)/A0×100。
1.3.7.3 还原能力的测定
分别取1 mL不同浓度的香菇多酚溶液、2 mL 0.2 mol/L pH 6的PBS磷酸盐缓冲液、2 mL 1%的铁氰化钾溶液于同一离心管中,摇匀后在50 ℃的水浴锅中避光反应20 min,冷却后各加入2 mL 10%的三氯乙酸溶液,放入离心机中离心10 min,吸取上清液2 mL、0.5 mL 0.1%的三氯化铁溶液、2.5 mL蒸馏水于另一具塞试管中,混合充分,在700 nm波长处测定吸光度为Ai;以VC溶液作为对照,测得吸光度为Aj。
1.3.7.4 ·OH自由基清除能力的测定
分别取2 mL不同浓度的香菇多酚溶液加入具塞试管中,依次加入2 mL 6 mmol/L的硫酸亚铁、2 mL 6 mmol/L的双氧水溶液、2 mL 6 mmol/L的水杨酸溶液,避光反应30 min,在510 nm波长处测定吸光度为Ai;用蒸馏水替换同体积的香菇多酚溶液为空白,测定其吸光度为A0;用蒸馏水替换水杨酸溶液测定其吸光度Aj;用相同的方法测是VC溶液的吸光度作为对照。按下列公式计算清除率:
·OH自由基清除率(%)=[(A0-Ai+Aj)/A0]×100。
2 结果与分析
2.1 单因素试验结果与分析
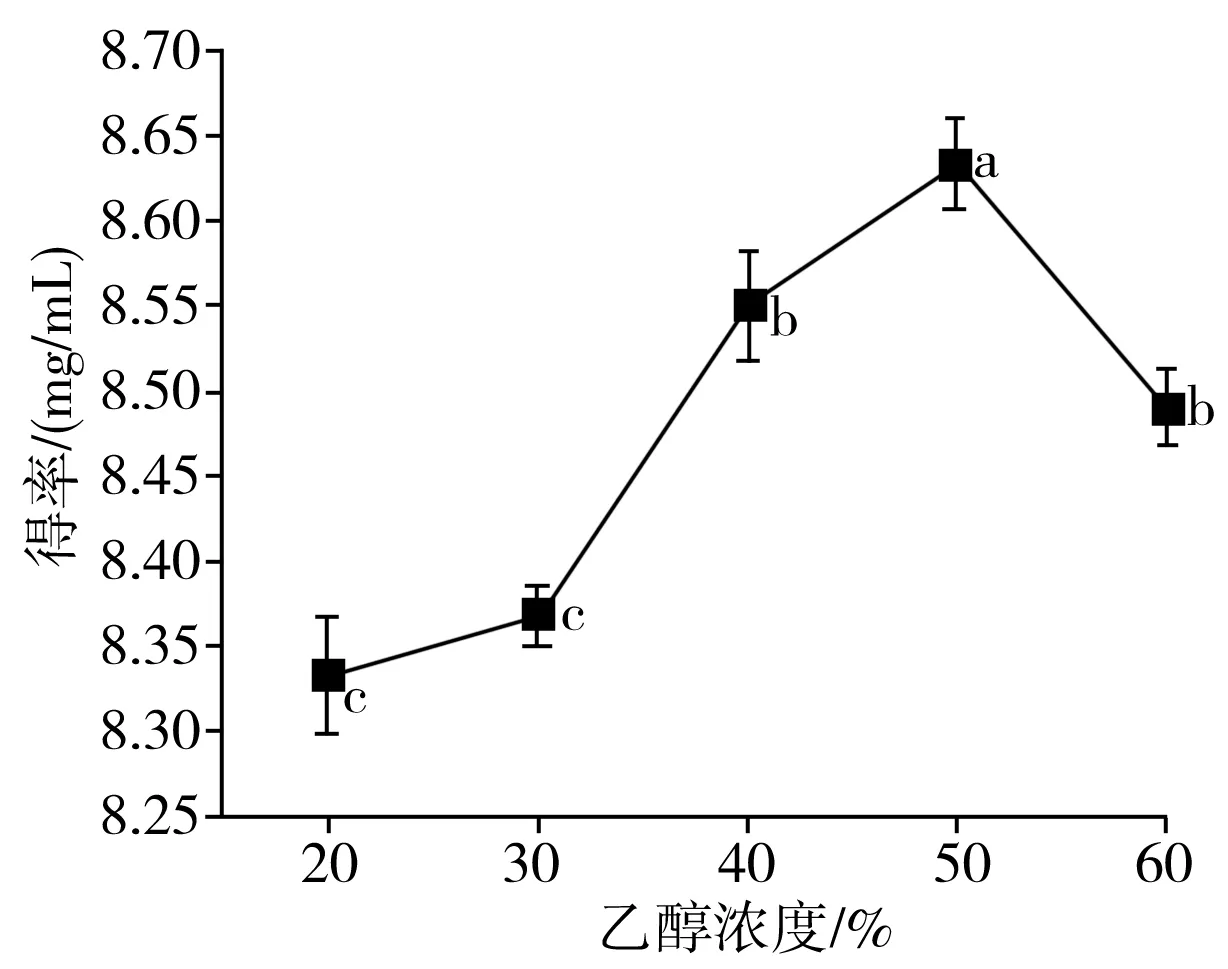
由图1中a可知,香菇多酚得率随着乙醇浓度的增加先上升而后下降,不同浓度乙醇溶液的极性不同,多酚溶解度也不同。当乙醇浓度达到50%时,香菇多酚得率达到最大值,因为在一定浓度范围内,乙醇溶液能有效进入细胞,使多酚扩散到提取液中,但乙醇溶剂浓度过大时,色素、弱极性成分等溶出,抑制了某些多酚类物质的充分溶解[19],因此选择乙醇浓度为50%来提取香菇多酚较为合适。
a
由图1中b可知,料液比在1∶25~1∶40 (g/mL)的范围内,香菇多酚得率随着料液比的增大而提高,达到了最大值,说明溶剂和原料的接触面积增大,多酚在溶剂中充分溶解;而料液比在1∶40~1∶50 (g/mL)的范围内,香菇多酚得率逐渐下降,可能是多酚的溶出量已经达到饱和,导致多酚的得率下降。因此,从节约溶剂的角度考虑,选择 1∶40 的料液比较为合适。
由图1中c可知,超声时间在20~60 min范围内,超声波对香菇粉末的机械和空化作用下,使多酚在溶剂中的溶解度增加,溶出量增大,在60 min时达到最高值。随着时间继续延长,多酚得率明显下降,可能是因为超声时间过短不利于有机溶剂和多酚物质的充分接触,而时间过长,能耗增大,多酚的结构遭到破坏[20],一些杂质随之溶出,不利于多酚物质的提取。因此,选取60 min较为合适。
由图1中d可知,香菇多酚的溶出量随着超声功率的增大而升高,当超声功率为160~180 W时达到最高值,原因可能是超声波使分子运动剧烈,破坏样品的细胞壁后多酚渗透速度增大[21],溶出量增加,而机械运动逐渐过强,会破坏多酚的结构,不利于有效成分的提取。因此,为了节约能耗,超声功率为160 W较适宜。
由图1中e可知,温度在30~70 ℃范围内,香菇多酚得率随着温度的上升呈增加趋势,在提取温度为70 ℃时达到最大值。一般来说,温度越高,会使细胞壁破坏而使提取更加顺利,但温度达到70 ℃时大部分的多酚已经基本溶出,再升高温度会使多酚分解和氧化,丧失活性,也会导致乙醇挥发,改变料液比,香菇多酚的得率反而下降[22]。因此,综合考虑选择70 ℃较为适宜。
2.2 响应面优化试验结果与分析
2.2.1 响应面试验的结果
根据单因素试验的结果,A(乙醇浓度)、B(超声功率)、C(提取温度)和D(料液比)对多酚得率的影响显著,因此运用Design-Expert 8.0.6软件进行四因素三水平的响应面试验,试验结果见表2。

表2 响应面试验设计结果Table 2 The design and results of response surface test
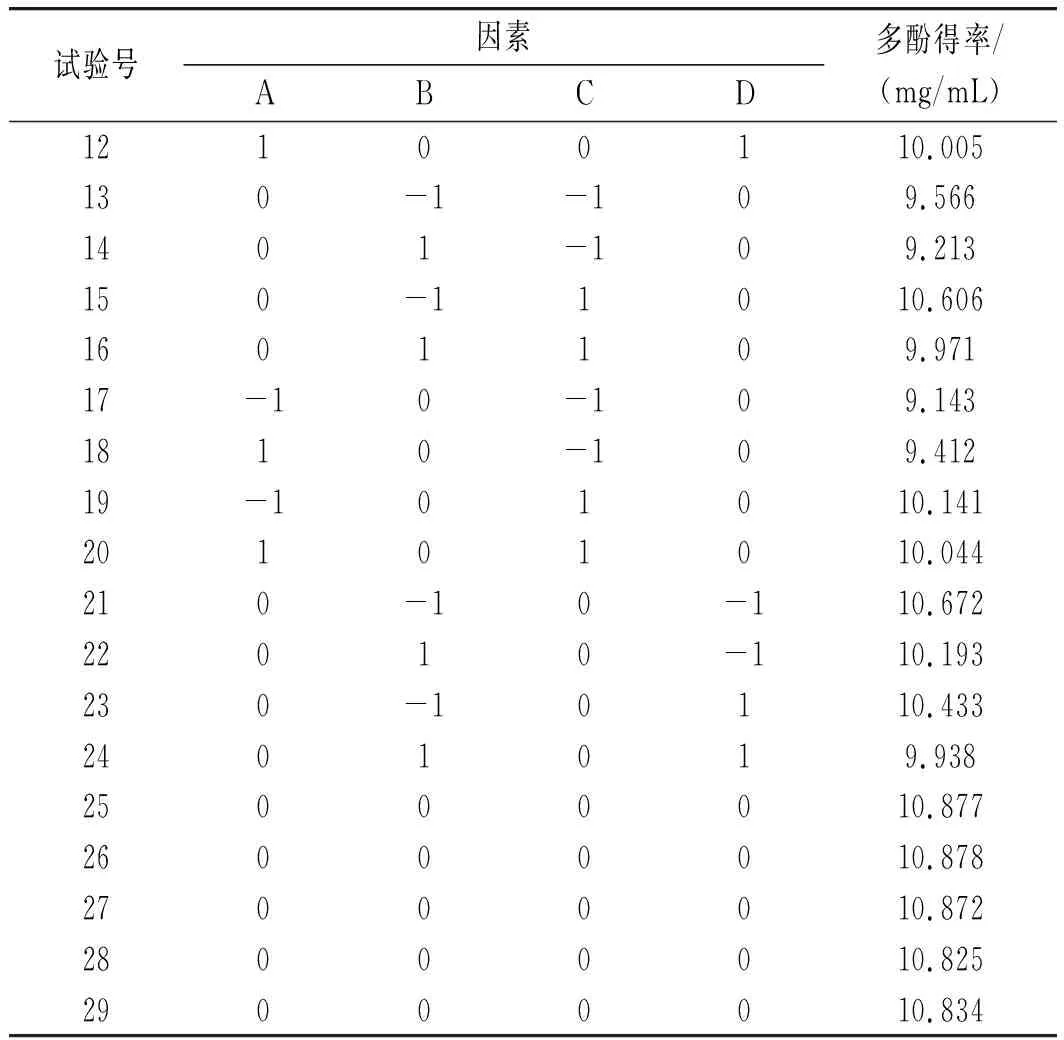
续 表
2.2.2 响应面回归模型的建立与分析
运用Design-Expert 8.0.6软件对表2响应面试验结果进行分析,得到三元二次回归方程:
Y=10.86+0.050A-0.25B+0.43C-0.093D-0.039AB-0.091AC-0.024AD-0.070BC-0.004BD+0.27CD-0.45A2-0.25B2-0.73C2-0.31D2。
由表3可知,回归模型中P值<0.0001,模型差异极显著;失拟项的P值>0.05,失拟检验不显著;决定系数R2为0.9964,校正系数RAdj2为0.9928,说明模型与多酚得率的试验结果拟合程度高,试验稳定性较好,可以较好地对香菇多酚得率进行预测分析。
由表3显著性检验可知,影响多酚得率的因素顺序为提取温度(C)>超声功率(B)>料液比(D)>乙醇浓度(A)。其中A、B、C、D、A2、B2、C2、D2、AC、BC、CD与香菇多酚得率差异极显著(P<0.01),其他因素差异不显著(P>0.05)。
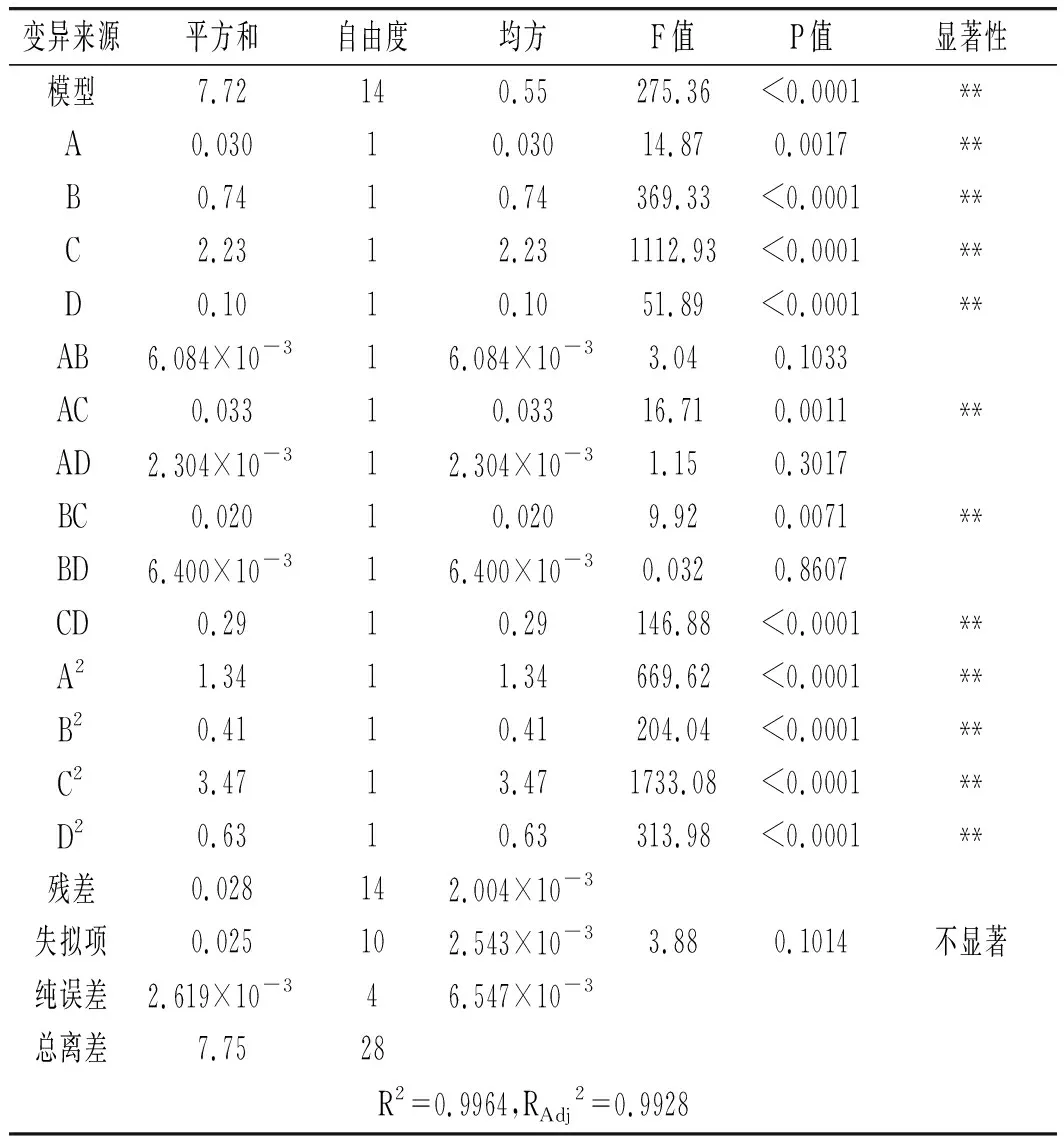
表3 回归模型方差分析Table 3 The variance analysis of regression model
2.2.3 响应面各因素交互作用分析
通过Design-Expert 8.0.6软件,影响多酚得率的两两因素之间的交互作用结果见图2。

a
响应曲面图中曲面越陡峭表示该因素对多酚得率的影响较大,相反,曲面越平缓,影响越小。图2中a、b、d和f的曲面较为陡峭,说明提取温度与乙醇浓度、提取温度与超声功率、料液比与提取温度的交互作用对香菇多酚得率的影响显著;图2中b和e的曲面较缓,说明超声功率与乙醇浓度、料液比的交互作用对多酚得率的影响较小,这与方差分析结果一致。
2.2.4 验证试验
运用Design-Expert 8.0.6软件优化回归模型进行的工艺参数,得到提取香菇多酚的最佳工艺条件为:乙醇浓度50%、料液比1∶42 (g/mL)、提取温度74 ℃、超声功率146 W,在此条件下进行3次平行验证试验,所得香菇多酚得率为10.91 mg/mL,而模型预测值为10.93 mg/mL,相对偏差仅为0.18%,与预测值基本吻合,说明此模型优化香菇多酚提取工艺合理可靠。
2.3 大孔树脂分离纯化结果与分析
对4种洗脱液中的多酚含量进行比较,通过显色反应计算出相应含量。4种不同洗脱组分中多酚含量见图3。
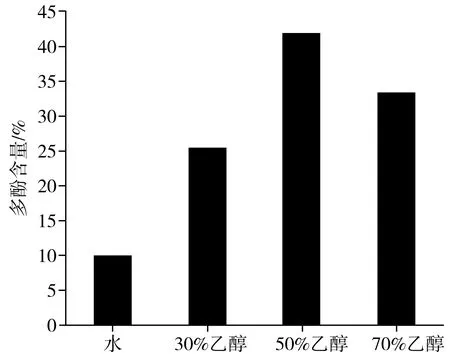
图3 4种不同洗脱组分中多酚的含量Fig.3 The content of polyphenols in four different elution components
由图3可知,水洗物中多酚含量最低,可能其中一些水溶性物质等杂质被洗脱下来。在剩下的3种乙醇溶液中,50%的乙醇洗脱组分中多酚含量最高,达到41.89%,其次为70%的乙醇,说明不同体积分数的乙醇极性大小不同,极性越小则洗脱效果越明显。随着乙醇浓度的增大,30%的乙醇溶液洗脱下来的多酚含量明显减少,可能前期大量的多酚类物质被洗脱下来,剩余的组分中一些脂溶性杂质随之被洗脱下来,从而降低了多酚的纯度。因此,选用50%乙醇洗脱物进行后续试验。
2.4 香菇多酚的抗氧化性分析
2.4.1 DPPH自由基清除能力的测定
香菇中多酚粗提物和多酚纯化物作为样品,测定它们在不同浓度情况下对DPPH 自由基的清除能力并进行对比,以 VC溶液作为阳性对照,结果见图4。
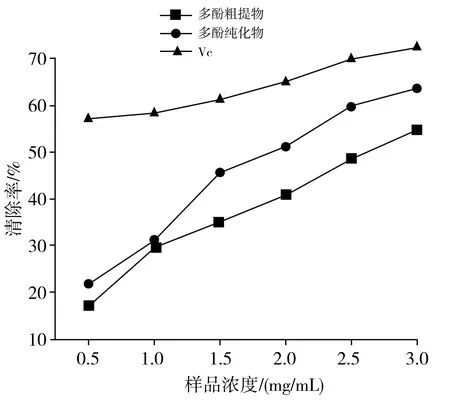
图4 香菇多酚提取物和VC对DPPH自由基的清除能力Fig.4 DPPH radical scavenging activity of polyphenol extracts from Lentinus edodes and VC
由图4可知,多酚浓度和清除自由基的能力呈正相关。多酚纯化物的清除能力明显高于多酚粗提物的清除能力,而VC的清除能力最好。并且多酚纯化物的DPPH自由基清除率均大于分离纯化前的粗提物,因为粗提物中杂质含量过多,相同浓度下多酚类物质含量少,对 DPPH自由基的清除能力最弱,因此需要进一步分离纯化。
2.4.2 ABTS+自由基清除能力的测定
以VC溶液作为阳性对照,ABTS+自由基清除能力的测定结果见图5。
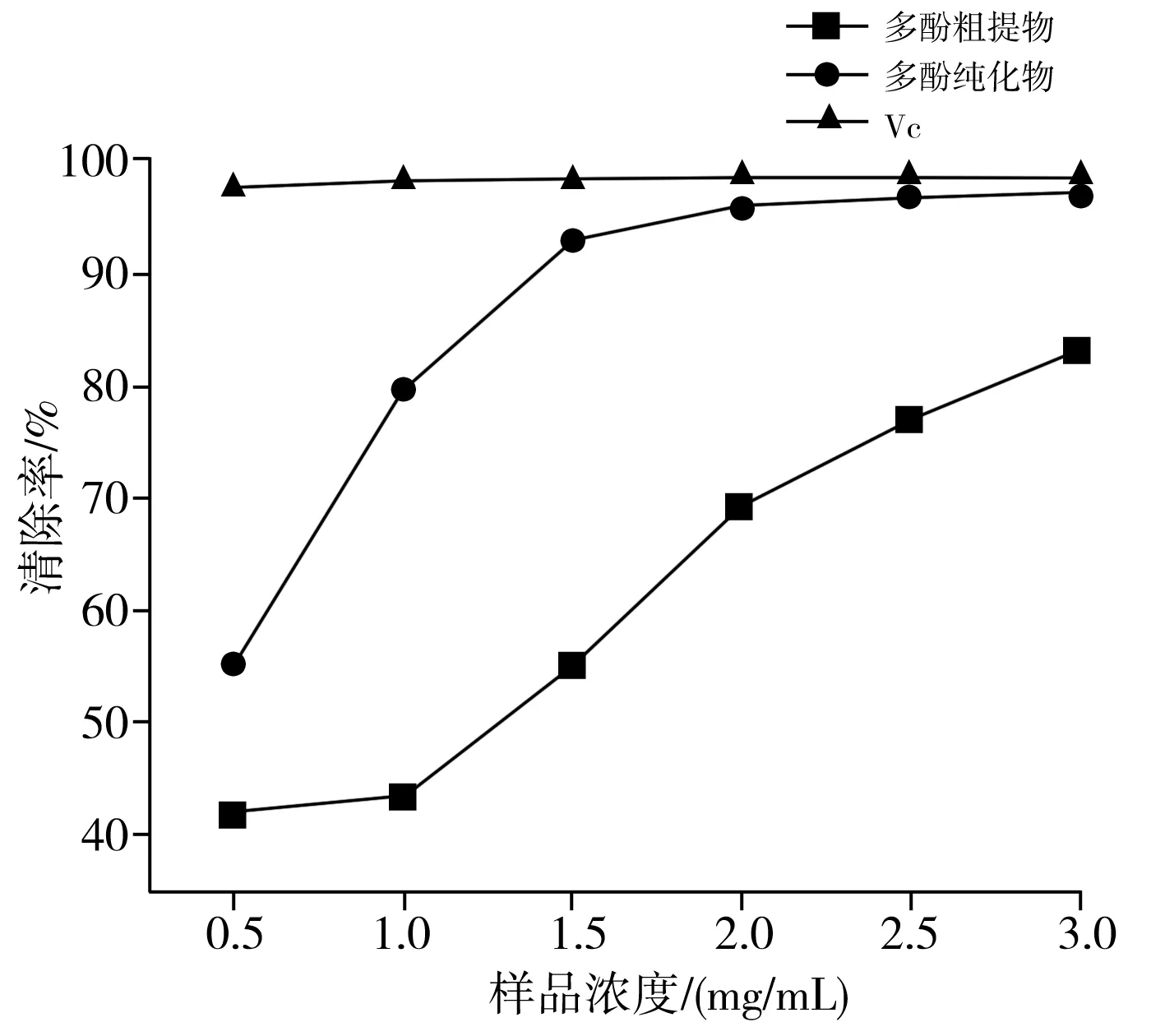
图5 香菇多酚提取物和VC对ABTS+自由基的清除能力Fig.5 ABTS+ radical scavenging activity of polyphenol extracts from Lentinus edodes and VC
由图5可知,香菇多酚纯化物对ABTS+自由基的清除能力明显强于香菇多酚粗提物,说明两种样品对ABTS+自由基都有较强的清除作用,VC对ABTS+自由基的清除能力很强。而浓度在3.0 mg/mL时,多酚纯化物和VC对ABTS+自由基的清除率分别达到了97.18%和98.49%,两者的清除效果相当,说明浓度越高,多酚纯化物有很好的ABTS+清除效果。
2.4.3 还原能力的测定
以VC溶液作为阳性对照,还原能力的测定结果见图6。
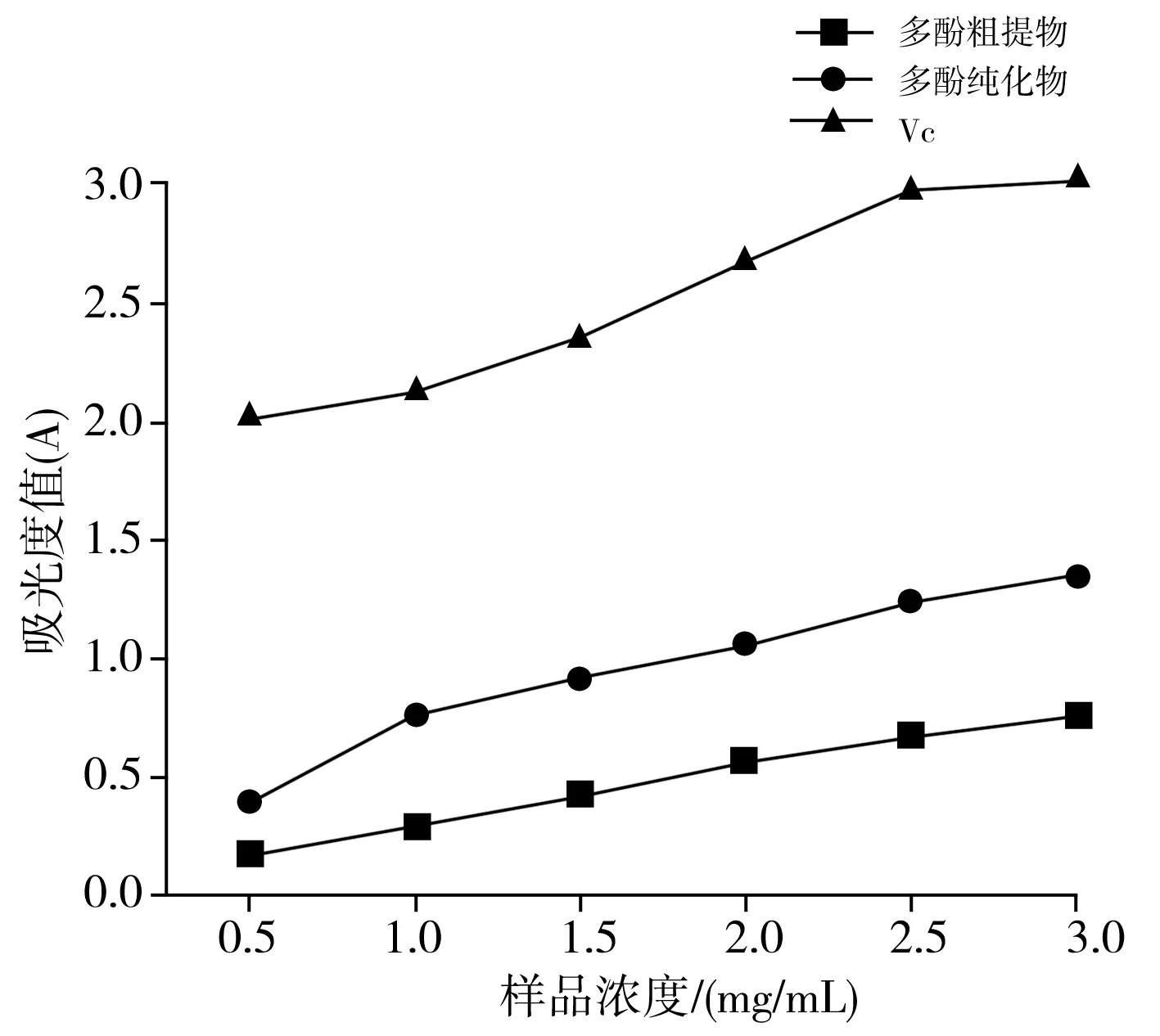
图6 香菇多酚提取物和VC的还原能力
由图6可知,3种样品的还原能力均随着浓度的升高而增强,说明吸光度值越大,还原能力越强。相同浓度条件下,VC的还原能力明显强于多酚粗提物和多酚纯化物的还原能力,香菇多酚纯化物的还原能力一直强于粗提物,说明在纯化的过程中分离了一些影响还原能力的物质,使还原性更强。
2.4.4 ·OH自由基清除能力的测定
以 VC溶液作为阳性对照,·OH自由基清除能力的测定结果见图7。
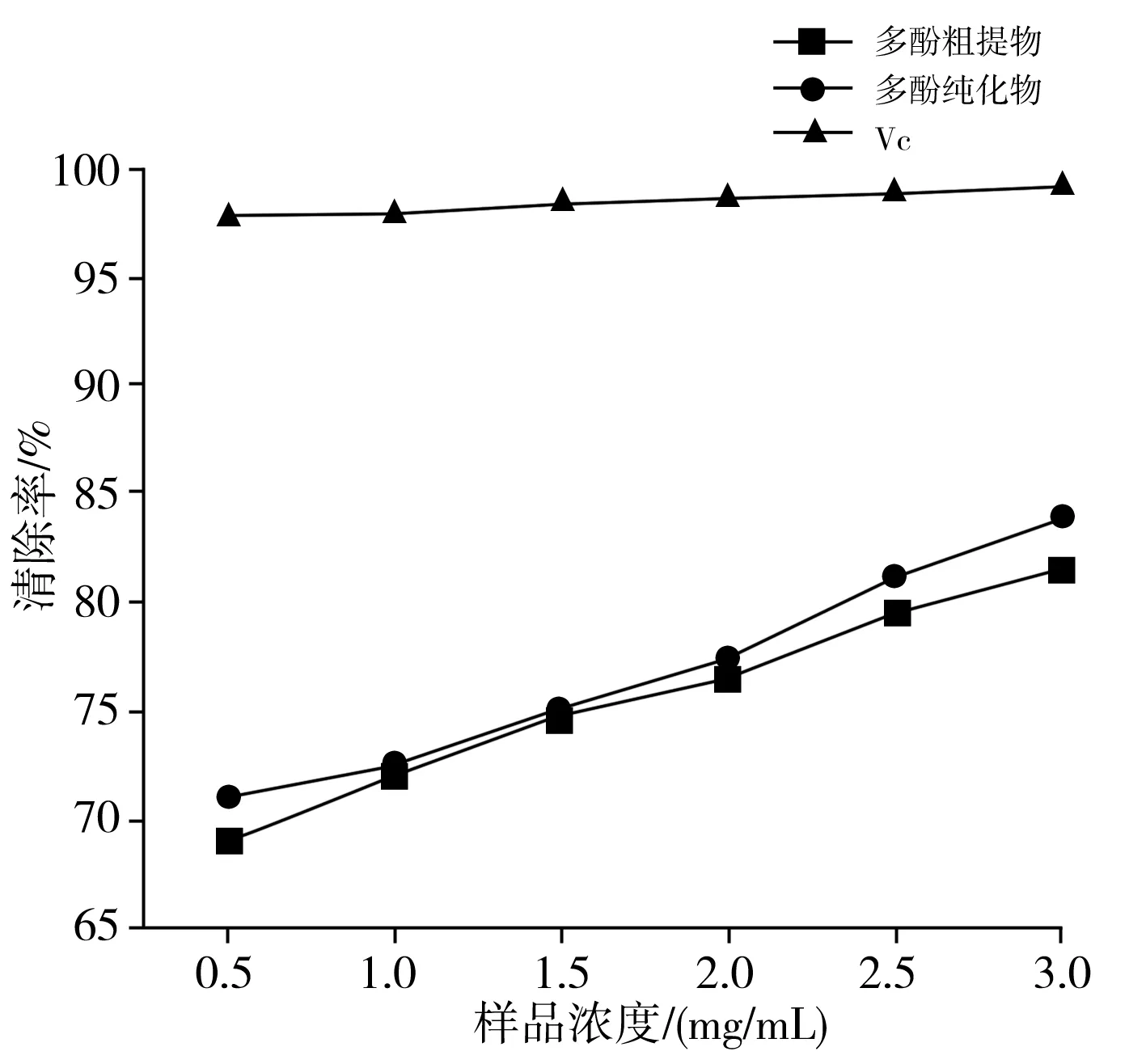
图7 香菇多酚提取物和VC对·OH自由基的清除能力Fig.7 Hydroxyl radical scavenging activity of polyphenol extracts from Lentinus edodes and VC
由图7可知,VC的清除能力很强,明显高于香菇多酚提取物。当浓度为1 mg/mL时,VC对·OH自由基的清除率一直保持在95%以上。随着浓度的升高,香菇多酚纯化物的清除能力略强于多酚粗提物,可能是纯化前后的物质并没有对·OH自由基的清除效果产生很大的影响,但总体来说清除效果随着浓度的增大而逐渐加强。
3 结论
本试验通过超声波辅助提取香菇多酚,在单因素试验的基础上,结合响应面试验优化香菇多酚的最佳提取工艺为乙醇浓度50%、料液比1∶42 (g/mL)、提取温度74 ℃、超声功率146 W,在此条件下香菇多酚得率为10.91 mg/mL,与模型预测结果基本吻合;并采用大孔树脂吸附法分离纯化香菇多酚,发现50%乙醇洗脱物中多酚含量达到41.89%,相比粗提物显著提高。
体外抗氧化性研究表明,香菇多酚具有明显的清除自由基的能力,VC对DPPH、ABTS+、·OH自由基的清除效果和还原能力强于香菇多酚。在相同浓度范围内,香菇多酚纯化后的抗氧化效果强于粗提物。总之,香菇多酚有良好的抗氧化活性,其应用前景广阔,有一定的研发价值,并且为香菇农产品的深加工提供了新思路,下一步将继续进行香菇多酚其他功能活性的研究。

