电感耦合等离子体质谱法测定注射用美罗培南中的13个元素杂质
陈沫 周震宇 程继业 沈心 姚玲
(苏州市药品检验检测研究中心,苏州 215000)
注射用美罗培南为人工合成的广谱碳青霉烯类抗生素,其对革兰阳性菌、阴性菌及厌氧菌均有良好的抗菌活性,且对超广谱β-内酰胺酶稳定,临床上多用于多重耐药菌的感染和重症感染的治疗[1-5]。本品在《中华人民共和国药典》(简称《中国药典》)2020年版二部[6]、美国药典(USP43)[7]、日本药局方(JP18)[8]中均被收载。其中,中国药典和日本药局方均对其原料药设有重金属检查项。但重金属检查法存在灵敏度低、专属性不足、无法测定单个元素含量和目测比色有主观误差等缺点。
在药品生产过程中,由不同来源的原辅料、试剂(如催化剂残留)以及生产设备等均可引入元素杂质。ICH Q3D[9]基于风险管控的原则,对药品中元素杂质的限度提出了控制和评价的要求,将元素杂质分为4类(1类、2A类、2B类、3类),针对口服、注射和吸入制剂等不同剂型设立不同的限值(日允许暴露量,PDE)。USP <233>[10]也提出了元素杂质方法学验证的一般要求。因本品为注射剂,考虑到安全性要求更为严格,需建立更灵敏、准确的分析方法来监测元素杂质水平。
电感耦合等离子体质谱(ICP-MS)法具有灵敏度高、干扰少、检出限低且可同时分析多种金属元素等优点[11-13],已在元素杂质分析中广泛应用。本文建立ICP-MS方法测定注射用美罗培南中的13种元素杂质的含量,并对国家药品抽验工作中抽检的11家企业产品中的元素杂质进行了比较分析,为药品质量的精准控制提供参考依据。
1 仪器与试药
1.1 仪器
赛默飞Xseries2电感耦合等离子体质谱仪,Millipore超纯水处理系统。
1.2 试剂与试药
硝酸(UP级),苏州晶瑞化学股份有限公司;砷(As)、镉(Cd)、汞(Hg)、铅(Pb)、钴(Co)、钒(V)、镍(Ni)、铑(Rh)、钯(Pd)、锂(Li)、锑(Sb)、铜(Cu)、锌(Zn)单元素标准溶液(1000 μg/mL);内标溶液铍(Be)、锗(Ge)、铟(In)、铋(Bi)单元素标准溶液(1000 μg/mL),均购于国家有色金属及电子材料分析测试中心;调谐溶液为锂(Li)、钇(Y)、铈(Ce)、钛(Ti)、钴(Co)的混合标准溶液(Agilent 公司,质量浓度为10 μg/mL)。
注射用美罗培南为2021年国家药品监督抽验样品,来自11家生产企业(企业A~K)共100批次,其中企业A为原研生产企业,B~K为国内生产企业。
2 试验条件
射频功率为1500 W,载气(高纯氩气)流速为1.05 L/min,冷却气流速13 L/min,雾化气流量1.0 L/min,辅助气流量为0.8 L/min,泵速30 r/min,雾化室温度为2℃;数据采样模式:跳峰采集模式,采样深度为15 mm,样品重复测定次数为3次,扫描次数为100次。选取被测同位素为7Li、51V、59Co、60Ni、65Cu、66Zn、75As、103Rh、105Pd、111Cd、121Sb、202Hg和208Pb,其中7Li以9Be作为内标,51V、59Co、60Ni、65Cu、66Zn、75As以72Ge作为内标,103Rh、105Pd、111Cd、121Sb以115In作为内标,202Hg、208Pb以209Bi作为内标。内标通过T型三通管在线引入等离子体。
3 溶液制备
3.1 标准储备液的制备
标准曲线储备液1:分别精密量取As、Cd、Pb、Co、V、Ni、Rh、Pd、Sb单元素标准溶液适量,用2%硝酸溶液制成每1 mL分别含As 15 μg、Cd 2 μg、Pb 5 μg、Co 5 μg、V 10 μg、Ni 20 μg、Rh 10 μg、Pd 10 μg、Sb 90 μg的混合标准储备液1。
标准曲线储备液2:分别精密量取Li、Cu、Zn单元素标准溶液适量及标准曲线储备液1 50 μL,置15 mL量瓶中,用2%硝酸溶液稀释至刻度,制成每1 mL分别含As 50 ng、Cd 6.666 ng、Pb 16.67 ng、Co 16.67 ng、V 33.33 ng、Ni 66.67 ng、Rh 33.33 ng、Pd 33.33 ng、Sb 300 ng、Li 833.3 ng、Cu 1000 ng、Zn 4333 ng的混合标准储备液2(0℃~5℃密封贮存)。
3.2 标准曲线溶液的制备(临用新制)
精密量取“3.1”项下的混合标准储备液275、125、250、375和500 μL,分别置20 mL量瓶中,以2%硝酸溶液稀释为不同浓度的混合标准曲线溶液。
Hg标准曲线溶液:精密量取Hg单元素标准溶液适量,用2%硝酸溶液稀释成含Hg为0.075、0.125、0.250、0.375和0.500 ng/mL的标准曲线溶液。
3.3 混合内标溶液的制备
分别精密量取Be、Ge、In和Bi各单元素标准溶液1 mL,置10 mL量瓶中,用2%硝酸溶液稀释至刻度,摇匀;精密量取25 μL,置500 mL量瓶中,用2%硝酸溶液稀释至刻度,摇匀,即得。0℃~5℃密封贮存。
3.4 供试品溶液的制备
取注射用美罗培南1瓶,加2%硝酸使溶解并转移至50 mL量瓶中,用2%硝酸稀释至刻度,摇匀;精密量取125 μL(1.0 g规格)、250 μL(0.5 g规格)、500 μL(0.25 g规格),置10 mL量瓶中,用2%硝酸稀释至刻度,摇匀,即得。
4 方法学考察
4.1 线性关系试验
取空白溶液(2%硝酸溶液)、混合标准曲线溶液、Hg标准曲线溶液适量进行ICP-MS进样分析,内标溶液通过在线加入的方式,以各目标元素浓度X(ng/mL)为自变量,目标元素与内标元素的响应比值Y为因变量,进行线性回归(表1)。结果表明,在实验范围内,各元素杂质测定的线性良好(r≥0.9997)。
4.2 检测限与定量限
取空白溶液(2%硝酸溶液)适量,连续测定11次,计算各目标元素的信号响应值的标准偏差(SD),以3倍SD与各目标元素标准曲线斜率的比值作为检测限,以10倍SD与各目标元素标准曲线斜率的比值作为检测限,结果见表1。各元素检测限为0.000131~0.023898 ng/mL,定量限为0.00044~0.07966 ng/mL,表明方法灵敏度良好。

表1 13种目标元素线性关系、相关系数、检测限和定量限结果Tab.1 The linearitY,correlation coefficient,LOD and LOQ for 13 elemental impurities
4.3 加样回收率试验
取批号2441C的注射用美罗培南样品9瓶,按“3.4”项下方法制备供试品溶液,以限度浓度的80%、100%和120%水平分别加入标准曲线储备液2和20 ng/mL Hg标准溶液各100、125和150 μL,每个浓度平行制备3份样品进行测定,计算回收率。结果如表2所示,表明本方法准确性良好,符合USP 43<233>要求。
4.4 重复性与中间精密度
取目标元素标准曲线溶液,按照“4.3”项下方法配制限度浓度的供试品溶液6份进行测定。结果见表2,各目标元素的RSD为2.3%~4.6%,表明本方法重复性良好。在不同时间由不同的分析人员按“4.3”项下方法同法操作,各目标元素的12份测定结果的RSD值作为中间精密度结果。中间精密度RSD为2.9%~5.7%,表明本方法中间精密度良好。
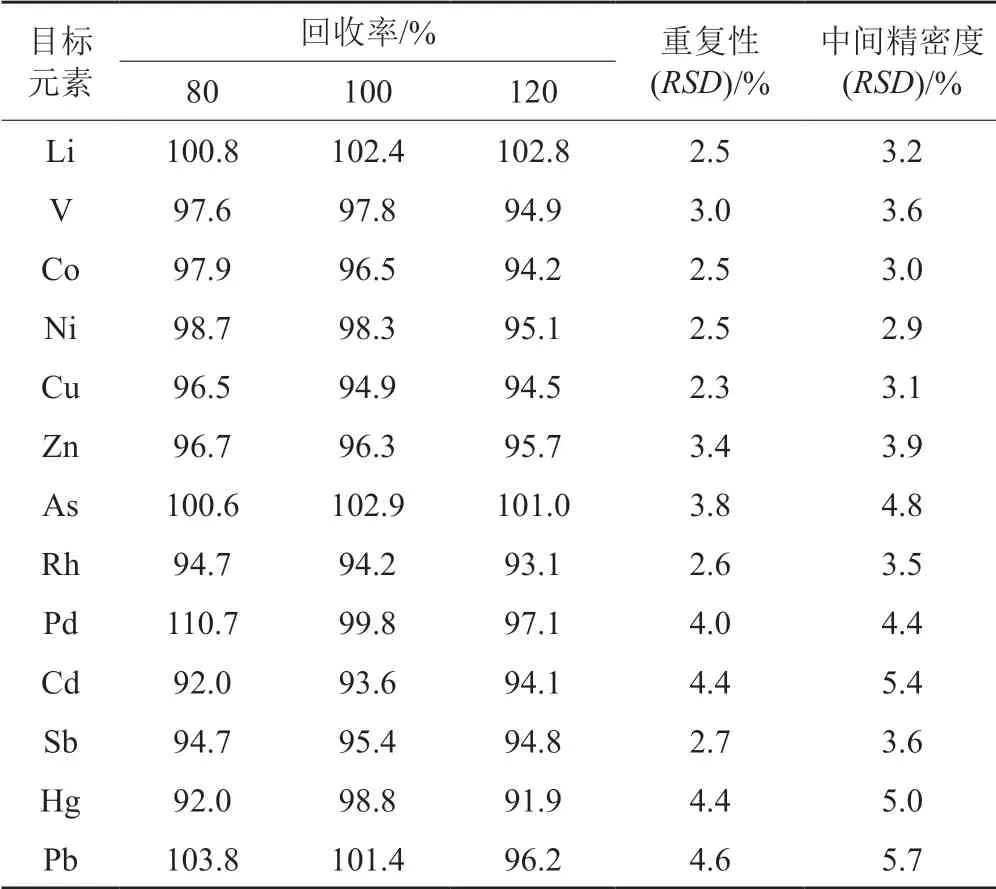
表2 13种目标元素的加样回收率、重复性以及中间精密度结果Tab.2 Results of recovery,repeatability and intermediate precision for 13 elemental impurities
4.5 稳定性试验
取注射用美罗培南样品(批号2441C)3瓶,按“3.4”项下方法制备供试品溶液,放置24 h后分别测定,与临用新制溶液比较,计算各元素含量,考察溶液稳定性。放置24 h后Li、V、Co、Ni、Cu、Zn、As、Rh、Pd、Cd、Sb、Hg、Pb元素RSD%分别为6.5%、5.1%、6.8%、3.4%、4.9%、2.1%、7.1%、3.1%、5.9%、7.8%、6.3%、8.1%和7.5%,表明供试品溶液在24 h内稳定。
5 样品测定
本次评价性抽验共抽取到11家企业的共100批注射用美罗培南样品,分别按“3.4”项下方法配制供试品溶液,计算元素杂质含量,各企业样品中目标元素杂质的绝对含量以及相对含量(绝对含量/限度)结果见图1~2,结果表明11家企业注射用美罗培南样品中元素杂质的含量均低ICH Q3D[9]限度要求。
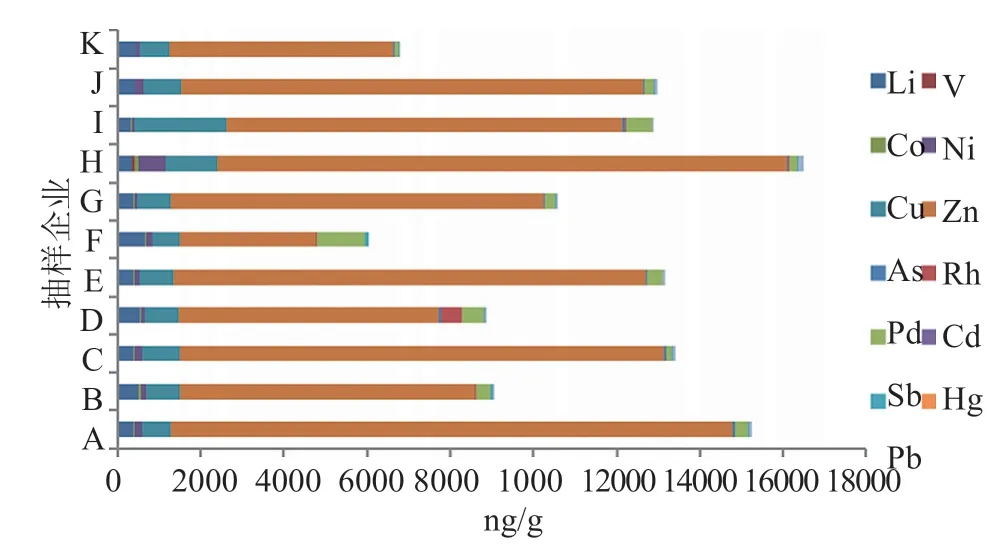
图1 11家企业注射用美罗培南中目标元素的绝对含量Fig.1 The results of elemental impurities in meropenem injections from 11 manufactures
6 讨论
6.1 元素杂质选择
根据ICH Q3D[9]对注射剂评估要求,需要对分类1的4个元素、分类2A的3个元素以及分类3的3个元素进行评估,其他元素如非有意添加,可不进行评估测试。根据前期对11家生产企业注射用美罗培南的处方及合成工艺的调研结果可知,多家企业在合成美罗培南原料药过程中使用了催化剂铑和钯碳,同时锌在部分厂家的生产工艺中也有使用。因此,本研究选择了Li、V、Co、Ni、Cu、Zn、As、Rh、Pd、Cd、Sb、Hg和Pb共13种元素进行测定,以了解不同厂家样品中的金属元素杂质残留,为产品风险监控提供参考。
6.2 样品处理方法及内标元素选择
本品由美罗培南和无水碳酸钠按处方比例无菌分装制成,且在2%硝酸中极易溶解,故样品前处理时优先选择直接溶解的方法。由于本品中的无水碳酸钠含量较高(20.2%~26.7%),高浓度的钠可导致严重的基体效应和电离抑制,在大批量的样品测定后,易引起大量固体沉积在采样锥,产生信号漂移。故本研究综合考虑仪器的灵敏度和耐受性等因素,选择了合适的样品稀释倍数,最终供试品中钠离子的浓度为35 μg/mL,同时采用多元素内标在线加入的方式,有效地消除了基体效应的影响。
6.3 样品结果分析
根据ICH[9]规定由PDE值和日最大给药量折算限度浓度,测定结果表明各企业注射用美罗培南样品中的目标元素杂质含量均低于限度浓度。对13种元素杂质的相对含量(绝对含量/限度浓度)(图2)进行比较发现,除H企业外,各企业样品中相对含量最高的元素均为元素Pd。根据欧洲药品管理局(EMA)对金属催化剂或金属试剂的残留量要求,元素Pd被列为第一类,即具有显著已知的或怀疑的对人体的致癌性或可能导致人体其他方面显著毒性的金属元素[14]。100批次样品中F企业的两批次(200303和200603)样品和I企业的两批次(401201111和401201007)样品中Pd元素的含量分别为限度浓度的80.0%、61.4%和82.6%、63.4%。企业D样品中Rh元素的平均含量约为限度浓度的29.6%,远高于其他样品。提示对美罗培南原料残留催化剂的控制应引起关注,采用精准的元素杂质检测较宽泛的重金属检查更有意义。此外,各企业样品中元素杂质总量的差异主要为元素Zn含量的差异所致,所有企业样品中元素Zn的绝对含量均占总量的80%以上。虽然产品中Zn元素的含量均远低于PDE限度,但Zn具有催化β-内酰胺环水解之功能[15],对美罗培南的稳定性可能有影响,企业对工艺中Zn的控制亦应引起关注。

图2 11家企业注射用美罗培南中目标元素的相对含量Fig.2 The results(absolute content/limit)of elemental impurities in meropenem injections from 11 manufacture

