HPLC法测定注射用盐酸头孢吡肟中2-巯基苯并噻唑
肖慧 王婷婷 吴文获 洪建文,*
(1 广东省药品检验所,国家药品监督管理局药品快速检验技术重点实验室,广州 510180;2 东莞市清溪镇社区卫生服务中心,东莞 523660)
头孢吡肟为第4代头孢类抗生素,主要用于治疗敏感菌引起的皮肤和骨组织、下呼吸道等感染[1]。目前国内头孢吡肟原料合成工艺中均使用了AE活性酯(MAEM)[2-3],AE活性酯生产工艺中使用了二硫化二苯并噻唑原料,其合成工艺中产生的副产物MBT(2-巯基苯并噻唑)为基因毒性杂质,在2017年WHO IARC(International Agency for Research on Cancer,国际癌症研究机构)公布的致癌物清单中MBT属于2A类致癌物[4]。目前该品种各国药典标准均暂未对该杂质进行特定控制[5-6],且暂未查询到国内有关头孢吡肟中MBT定量测定的文献报道,为合理控制注射用盐酸头孢吡肟中2-巯基苯并噻唑含量,满足该品种进一步质量控制及监管需求,建立了采用HPLC法测定注射用盐酸头孢吡肟中MBT(2-巯基苯并噻唑)含量的方法,为该产品相关杂质控制及临床应用安全性提供保障。
1 仪器与试药
Agilent 1260与Shimadzu LC-20AT高效液相色谱仪,Sartorius CP225D电子天平。
2-巯基苯并噻唑对照品(Macklin,Lot#C10866197,98%)、49批次注射用盐酸头孢吡肟制剂(来源:2020年国家药品抽检)、色谱纯甲醇及乙腈,分析纯磷酸二氢钠及磷酸。
2 实验方法
2.1 色谱条件
流动相:50 mmol/L磷酸氢二钠溶液(磷酸调pH值至6.25)-甲醇-80%乙腈(60:10:30);色谱柱:Inertsil ODS-3v(250 mm ×4.6 mm,5 μm);检测波长:320 nm,进样量:10 μL,流速:1.0 mL/min。
2.2 溶液的配制
供试品溶液:取本品1瓶,按标示量加50%乙腈溶解并定量稀释制成每1 mL含头孢吡肟50 mg的溶液。
对照品溶液a:取2-巯基苯并噻唑对照品约10 mg,置100 mL容量瓶中,加50%乙腈适量溶解,并稀释至刻度,摇匀。
对照品溶液b:精密量取上述对照品溶液a 1 mL,置50 mL量瓶中,加50%乙腈适量,稀释至刻度,摇匀。
3 试验结果
3.1 方法的选择
3.1.1 色谱条件的选择
试验分别考察了10 mmol/L的乙酸铵-甲醇(60:40,V/V)与50 mmol/L磷酸氢二钠溶液(磷酸调pH值至6.25)-甲醇-80%乙腈(60:10:30,V/V/V)作为流动相的情况,结果表明采用50 mmol/L磷酸氢二钠溶液(磷酸调pH值至6.25)-甲醇-80%乙腈(60:10:30,V/V/V)作为流动相时,供试品溶液中杂质MBT峰与相邻杂质峰之间的分离度能达到检测要求,MBT峰的响应更强,且峰型更好,分析时间更短,空白溶剂不干扰杂质检测,故选用50 mmol/L磷酸氢二钠溶液(磷酸调pH值至6.25)-甲醇-80%乙腈水(60:10:30,V/V/V)作为流动相;通过紫外分光光度计和二极管阵列检测器进行全波长扫描,MBT最大紫外吸收波长在320 nm左右,选择320 nm为检测波长。典型图谱见图1~2。
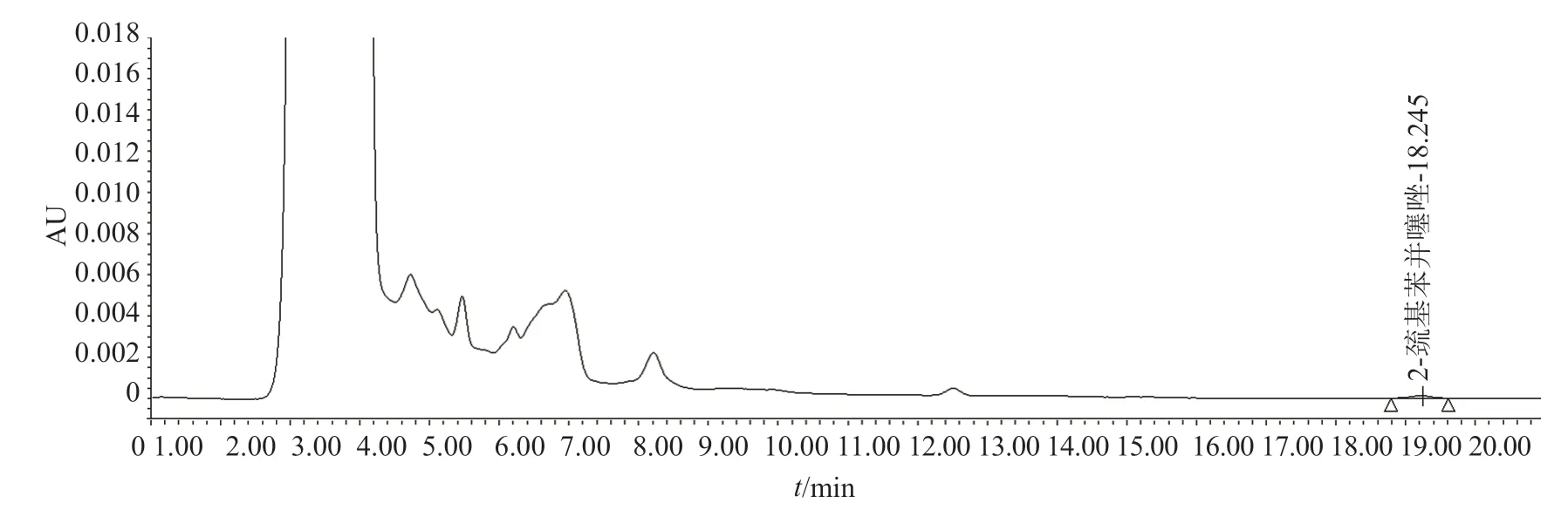
图1 供试品溶液典型色谱图Fig.1 Typical chromatogram of sample solution
3.1.2 提取方法的选择
MBT在三氯甲烷、丙酮和乙腈等有机溶剂中易溶,在苯中微溶,水中不溶[7],文献采用水溶液-三氯甲烷溶剂萃取方式,浓缩提取,测定头孢噻肟中MBT含量[8],同时头孢吡肟在合成工艺中,可通过强酸性条件下,使用二甲苯作为萃取溶剂,降低头孢吡肟水溶液中MBT残留量[4],本次研究尝试将样品用0.25 mol/L的盐酸溶液溶解后,分别采用二甲苯及三氯甲烷作为萃取溶剂,浓缩提取样品水溶液中MBT,结果显示:使用二甲苯及三氯甲烷作为萃取溶剂,回收率均低于70%,且二甲苯及三氯甲烷毒性较大;采用“2.2”项下供试品溶液制备方法,将样品用50%乙腈溶解后直接进样,回收率较高,约为91.7%,操作简单快捷,污染风险较低,故试验选择采用50%乙腈溶解样品后直接进样的提取方法。
3.2 专属性[9]
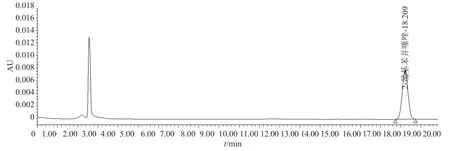
图2 对照品溶液典型色谱图Fig.2 Typical chromatogram of reference solution
取“2.2”项配制的供试品溶液与对照品溶液b,采用二极管阵列检测器,按“2.1”项色谱条件,对目标物进行全波长扫描及峰纯度检查,并进行色谱峰匹配。结果表明,供试品溶液中目标物峰“纯度角度(11.024)”小于“纯度阈值(13.297)”,且“自动阈值曲线”在“纯度曲线”之上,说明供试品溶液中检出目标物峰中基本不含其它混合物;其与对照品溶液b色谱峰匹配结果显示,两者的全波长扫描图谱相同,且“匹配角度(8.494)”小于“匹配阈值(9.320)”,两者成分一致,均为2-巯基苯并噻唑,该方法专属性良好。结果见图3。

图3 专属性试验色谱图Fig.3 Chromatogram in specificity test
3.3 线性
取“2.2”项下对照品溶液a适量,分别加50%乙腈适量并稀释制成含2-巯基苯并噻唑约为0.01、0.025、0.05、0.1、0.4、1、2、10、20、50和100 μg/mL的系列溶液,照“2.1”项下方法分别进样。以2-巯基苯并噻唑浓度(μg/mL)为横坐标,以峰响应值为纵坐标,绘制线性曲线,结果显示,该方法线性良好(线性范围:0.01~129.2 μg/mL,回归方程y=70652x-2167.2,相关系数r=0.9999)。
3.4 回收率试验
取2.2项下对照品溶液a 5 mL,置25 mL容量瓶中,加50%乙腈适量,稀释至刻度,作为回收用对照品储备液。取含量已知的同批供试品9瓶(规格:0.5 g),分别精密加入回收用对照品储备液0.2、1和2 mL各3份,再加50%乙腈定容至10 mL,摇匀,照“2.1”项下方法进行测定,回收率均值为91.7%,见表1。
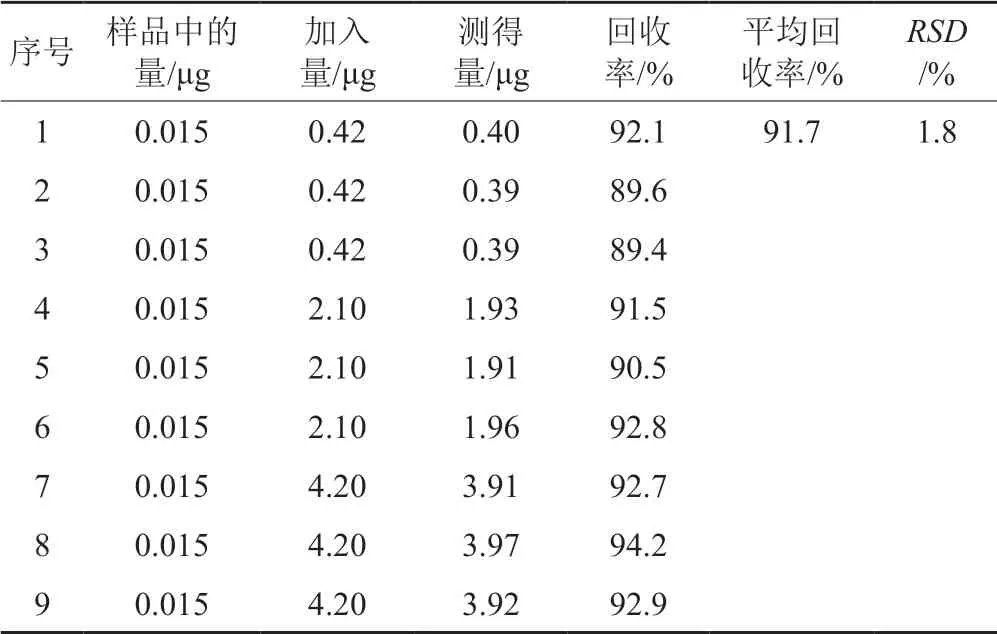
表1 回收率结果表Tab.1 Rate of recovery result table
3.5 精密度考察
3.5.1 重复性
取同批供试品6瓶,按“2.2”项下方法配制供试品溶液,照“2.1”项下条件进行分析,MBT含量测定结果见表2,该方法重复性良好。

表2 重复性结果表Tab.2 Table of repeatability results
3.5.2 中间精密度
采用“2.1”和“2.2”项下方法,使用不同品牌的色谱柱(Inertsil ODS-3v与Phenomenex Luna C18),对同批供试品进行测定,MBT含量结果均为0.2 μg/g,该方法中间精密度良好。
3.6 耐用性考察
采用“2.1”和“2.2”项下方法,分别改变流动相比例、柱温和流速对同批供试品进行测定,结果表明方法的耐用性良好,结果见表3。

表3 耐用性考察结果Tab.3 Durability investigation results
3.7 检测限与定量限
取2.2项下对照品溶液b逐级稀释,以信噪比10:1为定量限,以信噪比3:1为检出限,该方法定量限为0.3 ng,检测限为0.1 ng。
3.8 样品测定
取2020年国家药品抽检不同原料来源的49批次样品,按“2.2”项下方法配制供试品溶液,照“2.1”项下条件测定,按头孢吡肟标示量计算样品中的2-巯基苯并噻唑含量,结果见表4。

表4 49批次样品中2-巯基苯并噻唑含量测定结果表Tab.4 Results of determination of 2-mercaptobenzothiazole in 49 batches of samples
4 讨论
头孢吡肟原料合成过程中产生的副产物2-巯基苯并噻唑为基因毒性杂质,具有比一般杂质更大的危害性[10],可能会间接或直接损伤细胞DNA,诱导细胞产生基因突变,导致染色体重排或断裂,从而产生致突变和致癌作用。本次研究建立的注射用盐酸头孢吡肟中MBT含量测定方法,准确、灵敏、耐用性良好,且样品直接溶解进样,无需浓缩萃取,较为简单快捷,可作为注射用盐酸头孢吡肟常规质量控制及监督检验的有效补充检测方法,为其安全性控制提供了进一步技术支持。
注射用盐酸头孢吡肟为抗感染类注射药物,其治疗周期一般不超过一个月,最大剂量为6 g/d,根据ICH M7 assessment and control of DNA reactive impurities(DNA基因毒性杂质的ICH M7评估和控制指南)与ChP2020年版四部的遗传毒性杂质控制指导原则的规定,按日摄入量120 μg/d计,注射用盐酸头孢吡肟中2-巯基苯并噻唑的限度为:20 μg/g。对2020年国家评价性抽检的不同原料来源49批次样品测定,结果显示,49批次国产制剂中均有检出2-巯基苯并噻唑,但含量均在1.3 μg/g以下,远低于20 μg/g的推算控制限度,整体安全风险较低。

