原子吸收分光光度法测定注射用盐酸头孢替安中碳酸钠含量
李何杏 彭洁 洪建文
(广东省药品检验所,国家药品监督管理局药品快速检验技术重点实验室,广州 510663)
盐酸头孢替安为第二代头孢菌素类抗生素,通过阻碍细菌细胞壁的合成而产生抗菌作用,近年来成为医院常用的β-内酰胺类抗生素之一[1],其制剂为注射用盐酸头孢替安。该制剂有两种原研品的处方,处方1为盐酸头孢替安-无水碳酸钠(83:17),原研厂家是日本富山化学工业株式会社;处方2为盐酸头孢替安-无水碳酸钠-精氨酸(66:5:29),原研厂家日本武田药品株式会社。盐酸头孢替安pH值为1.2~1.7,而注射剂pH要求与血液相等或相近,一般控制pH值在4~9范围内,制剂中加入碱性附加剂无水碳酸钠或(和)精氨酸主要用以调节注射剂的pH值。本实验室在2018年注射用盐酸头孢替安国家评价性抽验的探索性研究中发现多批次样品碳酸钠含量不符合规定,抽验结果也提示注射用盐酸头孢替安碳酸钠含量的控制与溶液澄清度、制剂稳定性及不良反应相关[2],为控制药品质量,保证用药安全有效,应采用相应的方法测定注射用盐酸头孢替安中碳酸钠的含量,但是注射用盐酸头孢替安现行标准均为局颁标准或进口注册标准[2],碳酸钠测定方法不统一,有电位滴定法、原子吸收分光光度单点法及原子吸收标准曲线法,甚至个别厂家未对碳酸钠进行控制。为了更好地对注射用盐酸头孢替安中的碳酸钠含量进行控制,本实验采用原子吸收分光光度法,优化建立了可同时适合两种不同处方的碳酸钠含量的质量控制方法。
1 仪器与试药
1.1 仪器
原子吸收分光光度计(VARIAN AA240FS+Z;ThermoFisheriCE3500);BP211D电子天平。
1.2 试剂与试药
基准氯化钠(天津市天新精细化工开发中心,20180305)、氯化钾(分析纯)、氯化铯(分析纯)、硝酸(分析纯)、纯化水。
1.3 供试品
根据2018年国家评价性抽验情况及市面生产使用的情况,征集到包含两种处方的6个主流企业的供试品,见表1。
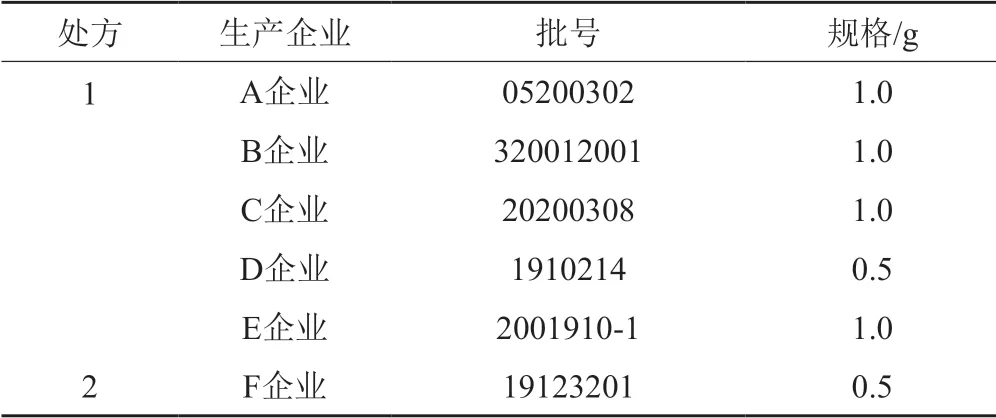
表1 供试品信息Tab.1 Test product information
2 方法
2.1 试验条件的优化
本品现行标准多采用原子吸收分光光度法测定碳酸钠含量。测定方法中电离抑制剂的种类和硝酸的加入量不一致,电离抑制剂有氯化钾和氯化铯,硝酸的加入量也不尽相同,甚至有些标准中未加入硝酸。考虑电离抑制剂是为了在同一条件下加入比待测离子(钠离子)更易电离的金属离子来降低干扰,在碱金属元素中,铯元素的电离电位(3.95 eV)与钾元素的电离电位(4.316 eV)均比钠元素的电离电位(5.12 eV)低,当三者共存时,铯与钾先电离,使电离平衡向基态原子方向移动,从而抑制钠的电离。同时,本品pH值偏中性,加入硝酸,保证在酸性的测定环境,更有利于金属元素溶出。为筛选合适的电离抑制剂及确定硝酸的加入量,统一本品碳酸钠测定的方法,取供试品各6份,照表2设计4种试验方案,考察测定结果的重复性。结果显示,加入氯化钾的供试品测定结果更稳定,且氯化钾比氯化铯更容易获得,因此选择氯化钾作为电离抑制剂。硝酸的加入量中,1 mL硝酸已能满足结果测定的要求,因此,确定试验条件按方案一(电离抑制剂为氯化钾及硝酸加入量为1 mL)进行。

表2 供试品溶液配制方案Tab.2 Test solution preparation plan
2.2 实验条件
光源:钠空心阴极灯;原子化器:空气-乙炔火焰原子化器;分析线:330.3 nm。
2.3 溶液制备
2.3.1 氯化钾溶液
称取氯化钾19.07 g,加水溶解并稀释至1000 mL。
2.3.2 对照品溶液
精密称取经110℃干燥2 h的氯化钠对照品适量,加水溶解并定量稀释成每1 mL中约含2.5 mg的溶液。精密量取氯化钠溶液1、3、5、7和10 mL,分别置100 mL量瓶中,加硝酸1 mL和氯化钾溶液10 mL,用水稀释至刻度,摇匀,作为对照品溶液(1)、(2)、(3)、(4)和(5)。
2.3.3 供试品溶液
精密称取本品适量(约相当于含碳酸钠60 mg),置100 mL量瓶中,加适量水溶解并稀释至刻度,摇匀,精密量取10 mL,置50 mL量瓶,加硝酸0.5 mL和氯化钾溶液5 mL,用水稀释至刻度,摇匀。
2.3.4 空白溶液
取硝酸1 mL和氯化钾溶液10 mL,置100 mL量瓶中,加水稀释至刻度,摇匀。
2.4 方法学验证
2.4.1 标准曲线绘制
按“2.3.2”项下制备,进样分析,测定标准系列钠离子的吸光度,以钠离子浓度为横坐标,吸光度A为纵坐标作图,标准曲线方程为y=0.0038x+0.0093,相关系数r为0.9996。
2.4.2 重复性
取两种处方供试品(处方1批号:1910214和处方2批号:19123201)各6份,照“2.3.3”项下制备,进样分析,结果显示处方1供试品(批号1910214)的平均含量为16.9%,RSD为1.2%(n=6);处方2供试品(批号19123201)的平均含量为4.6%,RSD为2.1%(n=6)。该方法在两种处方中的重复性均良好。
2.4.3 回收率
根据注射用盐酸头孢替安处方中碳酸钠含量,用企业D提供的原料(批号:1912111)和相关辅料无水碳酸钠、精氨酸按照处方的比例混合,每种处方各6份,照“2.3.3”项下制备,进样分析,处方1平均回收率为98.7%,RSD为0.5%(n=6);处方2平均回收率为98.3%,RSD为0.8%(n=6)。该方法在两种处方中的回收率均良好。
2.4.4 中间精密度
使用两种不同仪器(VARIAN/AA240FS+Z和ThermoFisher/iCE3500),取不同厂家供试品,照“2.3.3”项下制备,进样分析,两台仪器结果无明显差异,结果见表3。该方法在两种处方中的精密度均良好。
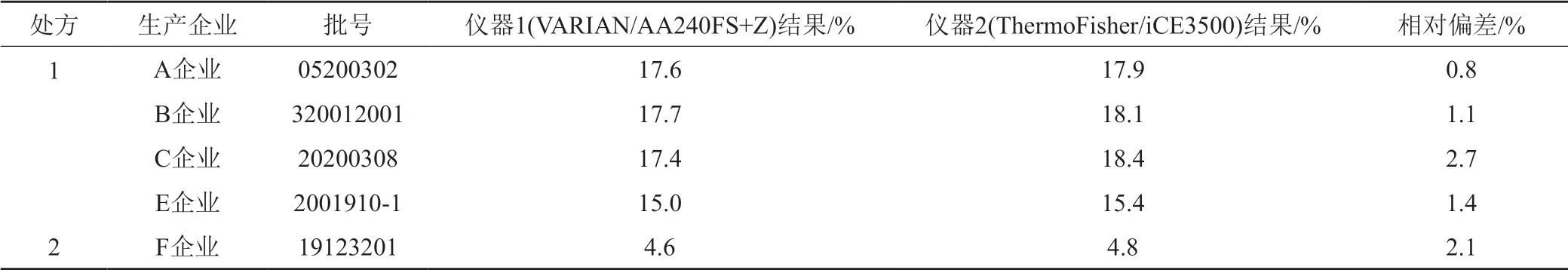
表3 中间精密度Tab.3 Intermediate precision
2.4.5 空白干扰实验
(1)称取盐酸头孢替安原料药,按照处方1比例,照“2.3.3”项下制备,进样分析,结果显示基本无吸收,与空白溶液测定值基本相同。
(2)称取盐酸头孢替安原料药与精氨酸,按照处方2比例混合,照“2.3.3”项下制备,进样分析,结果显示基本无吸收,与空白溶液测定值基本相同。
2.5 样品测定
采用拟定的方法对6个厂家供试品进行碳酸钠的测定,并将结果与按法定质量检验方法测定的结果进行比较,结果显示本方法测定结果与法定质量标准测定结果基本一致,见表4。实验结果显示,E企业产品中的碳酸钠含量偏低,超出处方比例范围(15.8%~19.2%),其法定质量标准中未对产品中的碳酸钠含量进行控制。
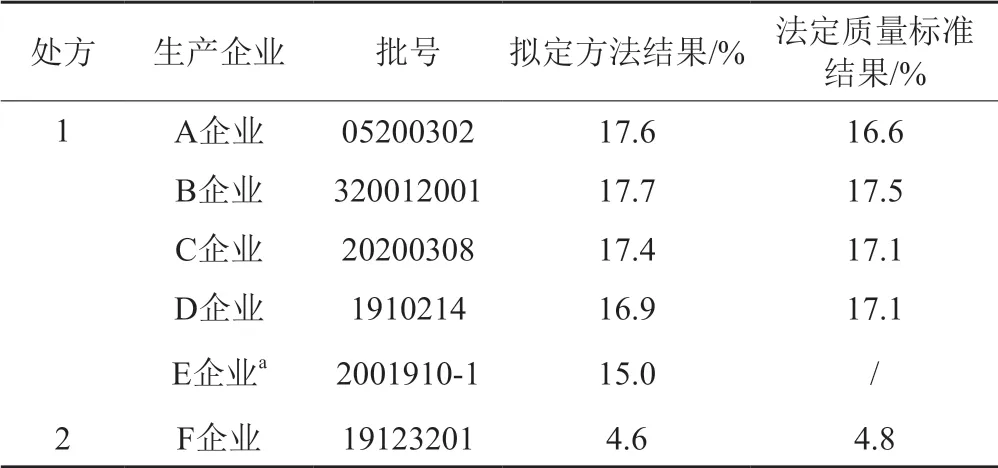
表4 碳酸钠测定结果Tab.4 Sodium carbonate measurement result
3 讨论
本文系统地优化并建立了适合两种不同处方的注射用盐酸头孢替安中碳酸钠含量测定方法,该方法准确、重复性好、操作简便,易于推广。方法应用于实际样品检测时发现,有企业产品存在碳酸钠含量超出处方比例控制范围的情况,亟须加强控制,保证药品质量。
注射用盐酸头孢替安现行标准碳酸钠的测定方法不统一,有电位滴定法和原子吸收分光光度法。电位滴定法不普及,需使用对温度敏感、平衡时间较长钠离子电极;原子吸收分光光度法多采用589.0 nm作为分析线,研究发现,由于钠原子在自然界中非常活泼[3],当波长为589.0 nm时,检测灵敏度过高,在火焰中电离而引起的干扰较大,影响检测结果准确性。注射用盐酸头孢替安中碳酸钠含量分别为17.5%和4.7%,含量相对较高,虽然波长为330.3 nm时,灵敏度约为589.0 nm的1%,但吸光度值适中,能有效减少实验干扰,同时减少实验操作步骤,降低实验误差,完全可满足检测分析要求。

