玉竹多糖对D-半乳糖诱导A7r5细胞衰老的保护作用
李明慧,侯俊宇,胡 迪,刘 静,赵梦丹,葛俊宏,申 野,李 坦,彭钰博,刘 鹏 ,孙 新,
(1.北华大学基础医学院,吉林吉林 132013;2.吉林医药学院药学院,吉林吉林 132013;3.北华大学药学院,吉林吉林 132013;4.北华大学公共卫生学院,吉林吉林 132013;5.北华大学口腔医学院,吉林吉林 132013)
随着人口老龄化的增加,探索衰老的相关分子机制已成为现代科学研究的一个重要研究热点[1-2]。衰老是由氧化应激[3]引起或在正常条件下生物发育成熟后,一个缓慢的自身机能减退以及结构和功能逐渐退化的过程[4-5]。衰老过程中,细胞形态变化与分子水平改变往往渐进性影响健康,因此衰老与疾病和死亡密切相关[6]。大多数正常细胞的分裂能力是有限的,细胞停止分裂后就进入衰老状态,因此衰老细胞被认为是机体衰老的重要原因[7]。
玉竹(Polygonatum odoratum),为百合科黄精属多年生植物的干燥根茎,呈圆柱形,种类各异。为我国传统中药材,并记载在《神农本草经》中。玉竹主要化学成分包括多糖、类固醇、蒽醌、生物碱、皂苷、维生素等[8],已被证明在治疗与年龄有关的疾病如糖尿病、肺病、疲劳和消化不良的临床实践中非常有效,玉竹不仅具有药用价值,还具有食用价值,被列为药食同源性物品[9-10]。许多中草药中的多糖成分已被证明具有抗衰老活性,并引起抗衰老领域专家越来越大的兴趣[11]。多糖是玉竹根中最主要的活性成分,目前有很多关于玉竹多糖(Polygonatum odoratumpolysaccharides,POP)的药理作用、自由基清除及其抗氧化活性的研究[12-14]。李化强等[15]研究表明POP对DPPH·、、·OH和均有一定的清除作用。彭壮等[16]通过实验证实POP能够改善D-半乳糖(D-gal)诱导的衰老模型小鼠认知障碍,改善海马区的病理状态。POP还可通过miRNA-1224的Hippo信号通路抑制破骨细胞生成[17]。但关于POP的体外抗衰老及线粒体膜电位保护作用的研究较为少见。
本研究应用水提醇沉的方法提取POP,并用Sevag法去除多糖中的蛋白质。应用D-gal作用于大鼠胸大动脉平滑肌细胞(A7r5)建立细胞衰老模型,研究POP对D-gal诱导A7r5细胞衰老的保护作用,为POP的抗衰老基础研究及抗衰老食品的研发提供理论依据。
1 材料与方法
1.1 材料与仪器
玉竹干燥根茎 长白山特色植物种植地;大鼠胸大动脉平滑肌细胞(A7r5) 北京北纳创联生物技术研究院;乙醇 辽宁泉瑞试剂有限公司;氯仿 天津凯信化学工业有限公司;苯酚、硫酸、正丁醇 国药集团化学试剂有限公司;D-氨基半乳糖胺(D-gal)北京金泰宏达生物科技有限公司;DMSO、维生素E(VE) 美国 Sigma公司;MTT 美国 Amresco公司;DMEM培养液、胎牛血清 美国Gibco公司;胰蛋白酶 美国Invitrogen公司;BCA蛋白浓度测定试剂盒、细胞衰老β半乳糖苷酶(SA-β-gal)试剂盒、JC-1线粒体膜电位检测试剂盒 碧云天生物科技有限公司。
Z323K低温高速离心机、Infinite M200 PRO酶标仪 美国Beckman公司;TDL-5-R低速离心机上海安亭科学仪器厂;EZ585台式冻干机 美国SIM公司;MCO-18AICUVL-PC二氧化碳培养箱日本Panasonic公司;MDF-U4086S -80 ℃超低温冰箱 日本SANYO公司;CLRSS II TYPE B2超净工作台 北京HDL公司;TH4-200倒置荧光显微镜、FV1200激光共聚焦显微镜 日本Olympus公司。
1.2 实验方法
1.2.1 POP的提取与纯化 目前提取POP的方法有超声波辅助法、超声波辅助酶法、水提醇沉法等。其中超声波辅助法可破坏植物细胞的细胞壁易影响多糖结构[18-19]。本实验采用简单、易操作、提取率高的水提醇沉法提取玉竹粗多糖,经查阅多篇文献,现已确定水提醇沉法提取黑龙江源POP可获得最佳提取率为7.93%,其选择的提取条件为温度80 ℃,时间2 h,固液比1:15 g/mL[20]。在本研究中,在该条件基础上进行多次预实验,优化POP提取条件,发现POP提取条件在料液比为1:20 g/mL、提取温度90 ℃、提取时间为2.5 h条件下进行煎煮,可得到最佳提取率,故我们选用该条件进行POP的提取。首先称取玉竹根茎300 g,研磨打碎,按上述实验条件进行提取,反复三次后合并三次的提取液,而后进行浓缩至700 mL。将浓缩液3500 r/min离心10 min,去除沉淀。用分液漏斗缓慢滴入无水乙醇直至乙醇含量达到90%。4 ℃冰箱静置过夜,次日取出后3500 r/min离心,去上清,沉淀物用无水乙醇洗脱,干燥后得到玉竹粗多糖。
将玉竹粗多糖溶于蒸馏水中配置成5%的糖溶液,放置于-80 ℃冰箱过夜,次日取出置于水浴箱中溶解,12000 r/min离心弃沉淀,反复冻融直至无沉淀离出。将氯仿和正丁醇以4:1的比例配制混合液进行Sevag,取多糖溶液与氯仿、正丁醇混合液按1:4混合,震荡 1 h,4000 r/min离心 15 min,此时离心管内会出现三层,上层为糖溶液,中间层为变性蛋白,下层为有机试剂,收取最上层的糖溶液,反复Sevag直至无变性蛋白析出。把Sevag后的糖溶液加入3500 Da的透析袋中,置于流水下24 h,最后将透析24 h后的多糖溶液收集到平皿中,在22 mT、-102.8 ℃条件下冻干,得到POP。POP得率计算公式:
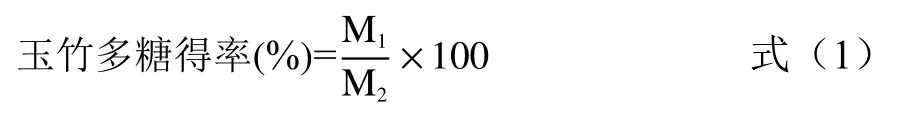
式中:M1为提取出的POP的质量,g;M2为玉竹原材料质量,g。
1.2.2 POP总糖含量测定 本实验应用苯酚-硫酸法测定POP中总糖含量,目前已有研究测量其含量为75.23%[21]。首先配制葡萄糖标准液使其浓度为100 μg/mL,然后将其稀释为 0、10、20、40、60、80、100 μg/mL浓度梯度的葡萄糖溶液,分别取葡萄糖标准液 0、0.1、0.2、0.4、0.6、0.8、1 mL 于试管中,用蒸馏水定容至1 mL,将POP配制成100 μg/mL的糖溶液1 mL,在不同浓度梯度的葡萄糖溶液及POP溶液中依次加入6%苯酚溶液0.5 mL,浓硫酸2.5 mL,振荡,沸水浴10 min,然后冷却至室温,490 nm处测得吸光度值。以葡萄糖浓度为横坐标,吸光度为纵坐标,绘制葡萄糖标准曲线,计算POP中总糖含量。
1.2.3 A7r5细胞活力测定
1.2.3.1 POP对A7r5细胞增殖的影响 将含有10%FBS、1%青霉素链霉素的DMEM培养基用于培养A7r5细胞后,以5000 cells/孔接种于96孔板中,设置对照组,25、50、100、200、400、800 μg/mL POP处理组,每组6个平行实验,置于37 ℃、5% CO2培育箱孵育过夜。次日用上述浓度梯度的POP溶液处理细胞24 h。然后每孔加入20 μL 5 mg/mL MTT,培养箱孵育4 h后去除上清,每孔加入150 μL DMSO,置于酶标仪上混匀,490 nm处测得吸光度值,细胞存活率计算公式:

式中:A处理组为不同浓度POP处理后测得的吸光度值;A对照组为正常培养液培养细胞测得的吸光度值。
1.2.3.2 D-gal对A7r5细胞增殖的影响 将含有10%FBS、1%青霉素链霉素的DMEM培养基用于培养A7r5细胞后,以5000 cells/孔接种于96孔板中,根据查阅文献得到D-gal致细胞衰老模型的适宜浓度梯度[22-23],对本实验的处理浓度及处理时间进行条件摸索。设置对照组,5、10、20、40、80 mg/mL D-gal处理组,每组6个平行实验,至于37 ℃、5% CO2培育箱孵育过夜。次日用上述浓度梯度的D-gal处理细胞24和48 h。然后每孔加入20 μL 5 mg/mL MTT,培养箱孵育4 h后去除上清,每孔加入150 μL DMSO,置于酶标仪上混匀,490 nm处测得吸光度值,细胞存活率计算公式:

式中:A处理组为不同浓度D-gal处理后测得的吸光度值;A对照组为正常培养液培养细胞测得的吸光度值。
1.2.3.3 POP对D-gal处理A7r5细胞增殖的影响将含有10% FBS、1%青霉素链霉素的DMEM培养基用于培养A7r5细胞后,以5000 cells/孔接种于96孔板中,设置对照组、D-gal模型组、POP处理组,每组6个平行实验。置于37 ℃、5% CO2培育箱孵育过夜。待细胞长到适宜的密度后,首先用25、50、100、200、400、800 μg/mL POP 处理细胞 5 h后,将模型组和处理组同时加入D-gal使其浓度达到40 mg/mL,放入培养箱孵育48 h。然后每孔加入20 μL 5 mg/mL MTT,培养箱孵育4 h后去除上清,每孔加入150 μL DMSO,置于酶标仪上混匀,490 nm处测得吸光度值,细胞存活率计算公式:
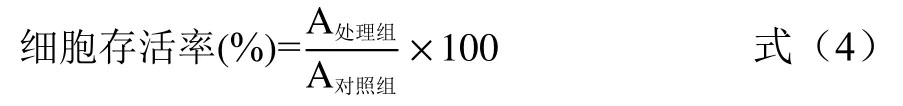
式中:A处理组为不同浓度POP处理组及D-gal模型组测得的吸光度值;A对照组为正常培养液培养细胞测得的吸光度值。
1.2.4 POP对D-gal诱导A7r5细胞内指标的影响
1.2.4.1 A7r5细胞内SA-β-gal活性的测定 将含有10% FBS、1%青霉素链霉素的DMEM培养基用于培养A7r5细胞后,以1.1×105cells/孔接种于6孔板中,设置对照组、D-gal模型组、POP处理组和VE阳性对照组,每组3个平行实验。至于37 ℃、5%CO2培育箱孵育过夜。次日先用100 μg/mL POP和100 μg/mL VE处理细胞5 h后,将模型组、POP处理组和阳性对照组同时加入D-gal使其浓度达到40 mg/mL,放入培养箱孵育48 h。然后用β-半乳糖苷酶染色试剂盒进行染色,首先用PBS清洗1次,加入染色固定液每孔1 mL,37 ℃、5% CO2培育箱固定15 min,然后用PBS清洗3次,每次3 min,清洗完毕后加入染色液 A 10 μL/孔、染色液 B 10 μL/孔、染色液 C 930 μL/孔、X-Gal溶液 50 μL/孔,而后将培养皿封闭放入无CO2培养箱中孵育过夜。倒置荧光显微镜对细胞进行拍照,以评估POP对D-gal诱导A7r5细胞内SA-β-gal活性的影响。
1.2.4.2 A7r5细胞产生活性氧(ROS)的测定 为检测D-gal诱导A7r5细胞内活性氧的产生,应用ROS试剂盒进行染色。细胞培养方法同1.2.4.1。将处理后细胞中的培养液去除,加入PBS清洗1次,以1:2000的比例用无血清的DMEM稀释DCFH-DA,每孔加入1 mL DCFH-DA稀释液使其细胞表面充分覆盖,37 ℃细胞培养箱孵育20 min后去除稀释液,用无血清的DMEM清洗3次,3 min/次。荧光显微镜观察各组细胞染色的荧光强度,研究POP对ROS产生的影响。
1.2.4.3 A7r5细胞线粒体膜电位的测定 为了检测POP对D-gal诱导A7r5细胞线粒体膜电位变化的影响,采用线粒体膜电位试剂盒(JC-1)以JC-1为荧光探针检测细胞的线粒体膜电位变化。将6孔板内每孔滴入200 μL培养液,将高压灭菌后的盖玻片缓慢放入6孔培养皿中使盖玻片与培养皿底部贴合,培养A7r5细胞后,以11×104cells/孔接种于6孔板中,每孔缓慢滴入2 mL细胞培养液。设置对照组、D-gal模型组、POP处理组和VE阳性对照组,每组3个平行实验。至于37 ℃、5% CO2培育箱孵育过夜。次日先用 100 μg/mL POP 和 100 μg/mL VE处理细胞5 h后,将模型组、处理组和阳性对照组同时加入D-gal使其浓度达到40 mg/mL,放入培养箱孵育48 h。然后用线粒体膜电位试剂盒进行染色,首先PBS清洗1次,加入1 mL培养液再加入1 mL JC-1染色工作液,充分混合后放入CO2培养箱孵育20 min,然后用JC-1染色缓冲液(×1)4 ℃冰浴洗涤2次,最后每孔加入2 mL培养液,将有细胞覆盖的盖玻片用针头取出,封片在激光共聚焦显微镜下进行观察拍照。
1.3 数据处理
数据进行处理与统计学分析应用GraphPad Prism 6.01,试验结果均为3次平行试验所得,数据以均值±标准差(±SD)表示,P<0.05差异具有统计学意义。
2 结果与分析
2.1 POP的提取及测定
300 g玉竹根茎按照料液比为1:20 g/mL、提取温度90 ℃、提取时间为2.5 h条件下煎煮浓缩,醇沉、sevag提取POP共24.68 g,POP得率为8.23%。
苯酚-硫酸法测得POP总糖含量,根据葡萄糖标准曲线,得到线性回归方程y=0.007x+0.0162,R2=0.9923。POP浓度为 100 μg/mL时吸光度为 0.52,根据公式得POP的总糖含量为76.48%±0.036%。
2.2 POP对A7r5细胞增殖的影响
MTT检测POP对A7r5细胞活力的影响,如图1,实验表明 25、50、100、200、400、800、1600 μg/mL浓度梯度的POP处理A7r5细胞24 h后,POP呈剂量依赖性提高细胞活力,促进细胞增殖,当浓度为400 μg/mL时,POP对A7r5细胞促增值作用最强,细胞存活率为 174.89%±3.30%(P<0.001,n=3)。
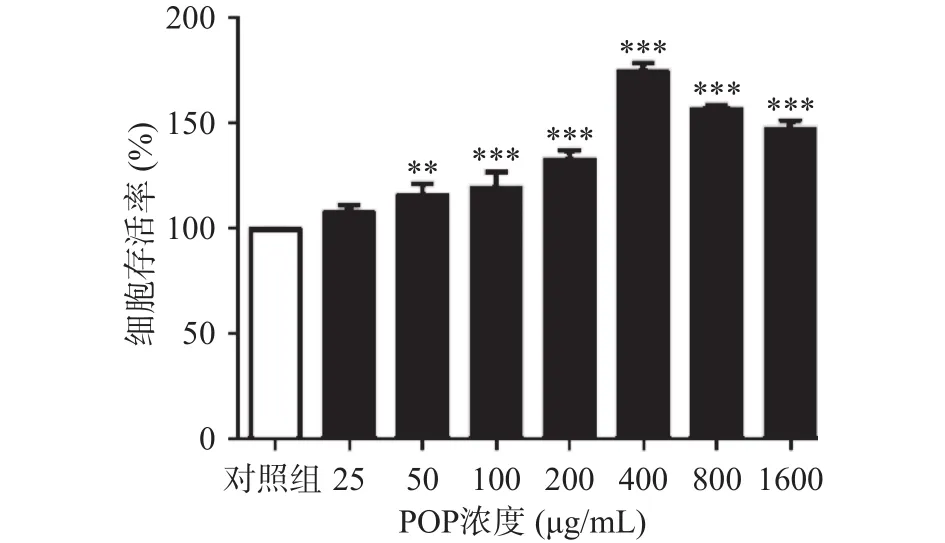
图1 POP对A7r5细胞存活率的影响Fig.1 Effect of POP on the survival of A7r5 cells
2.3 D-gal对A7r5细胞增殖的影响
MTT实验表明,图2A为不同浓度D-gal处理A7r5细胞24 h,与对照组相比,80 mg/mL D-gal刺激A7r5细胞24 h,细胞存活率约为56.95%±2.78%(P<0.001,n=3)。图2B为不同浓度 D-gal处理A7r5细胞48 h,与对照组相比,40 mg/mL D-gal刺激A7r5细胞48 h细胞存活率约为65.93%±1.63%(P<0.001,n=3)。D-gal呈剂量依赖性诱导 A7r5 细胞存活率下降。考虑到D-gal浓度过高会导致细胞凋亡或死亡的不可逆性损伤,此时的细胞损伤量是研究体外细胞衰老的最适剂量与时间。因此,本实验选用40 mg/mL D-gal处理48 h进行构建A7r5细胞衰老模型。
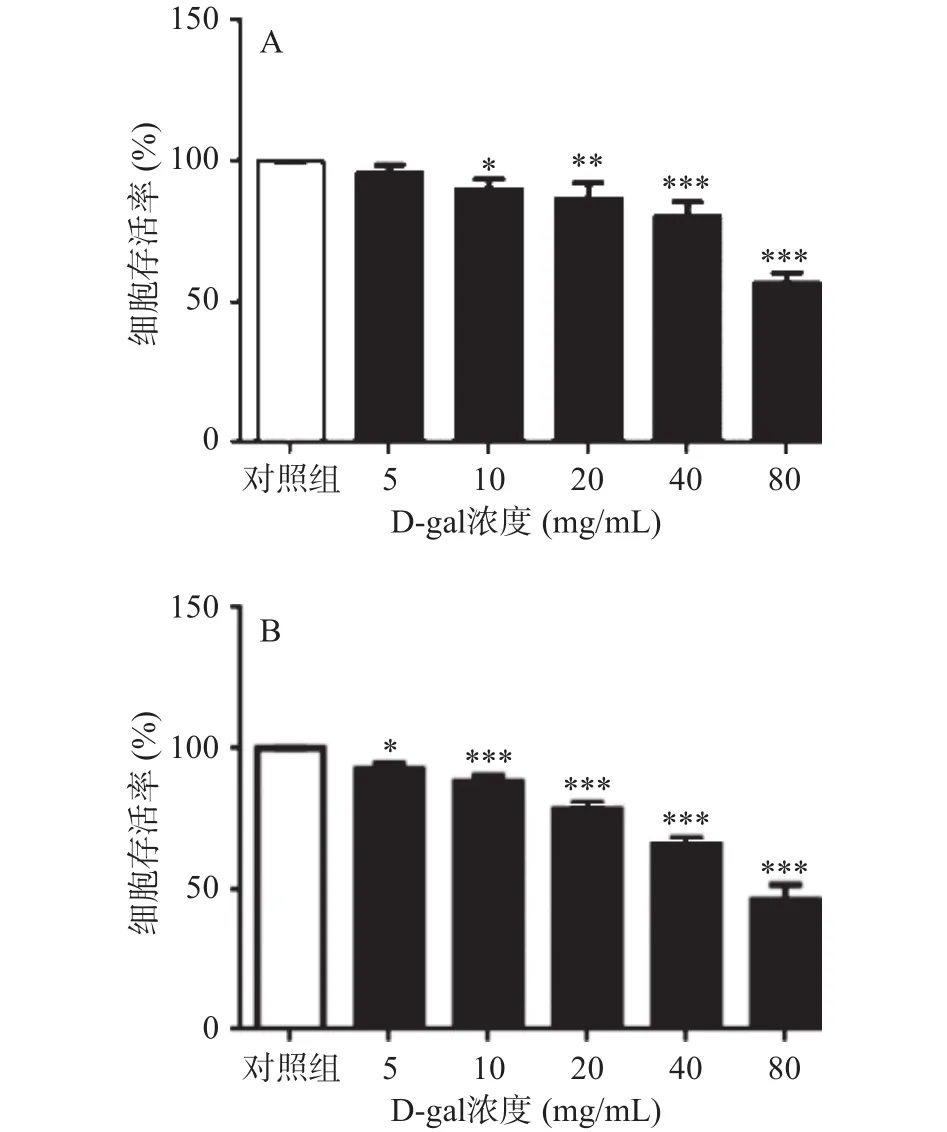
图2 D-gal对A7r5细胞存活率的影响Fig.2 Effect of D-gal on the survival of A7r5 cells
2.4 POP对D-gal处理A7r5细胞增殖的影响
MTT实验结果表明,如图3,与对照组相比,D-gal组诱导 A7r5 细胞存活率下降(P<0.001,n=3);与D-gal组相比,在加入25~800 μg/mL浓度梯度的POP 5 h后,加入 40 mg/mL D-gal处理 48 h后,均可促进细胞增殖。浓度为100 μg/mL时POP对D-gal诱导A7r5细胞存活率下降的保护作用最为显著,细胞存活率为 226.87%±12.58%(P<0.001,n=3)。因此,本实验选用浓度为100 μg/mL的POP及相应浓度的VE阳性对照进行后续细胞染色的研究。

图3 POP对D-gal诱导A7r5细胞存活率下降的影响Fig.3 Effect of POP on D-gal-induced decline of A7r5 cell viability
2.5 POP对A7r5细胞内SA-β-gal产生的影响
对D-gal及POP处理A7r5细胞后所产生的衰老相关SA-β-gal进行检测,如图4A~D为对照组、模型组、阳性对照VE组(100 μg/mL)、POP 组(100 μg/mL)细胞的 SA-β-gal染色情况,图4E 为 SA-β-gal染色阳性细胞计数分析。染色结果表明,与对照组相比经D-gal处理的模型组SA-β-gal表达水平明显增加,SA-β-gal染色阳性细胞百分比为81.33%±8.17%(P<0.001,n=3)。100 μg/mL POP 处理组及 VE阳性对照组处理后,图4C~D中SA-β-gal催化下生成的蓝色产物明显减少,SA-β-gal染色阳性细胞百分比分别为44.67%±2.49%、39.67%±2.05%。实验结果表明,D-gal诱导细胞发生衰老,且POP有效降低了D-gal刺激A7r5细胞产生SA-β-gal的表达情况(P<0.01,n=3)。

图4 POP对D-gal诱导的A7r5细胞产生β-半乳糖苷酶的影响作用Fig.4 Effect of POP on the production of β-galactosidase in A7r5 cells induced by D-gal
2.6 POP对D-gal诱导A7r5细胞产生ROS的抑制作用
如图5A~D为对照组、模型组、阳性对照VE组(100 μg/mL)、POP 组(100 μg/mL)细胞的 ROS 荧光染色情况,图5E为ROS染色的荧光强度细胞计数分析,与对照组相比,模型组中阳性细胞数增多,ROS染色阳性细胞荧光强度为75.15%±3.70%(P<0.001,n=3)荧光强度明显增强。结果表明A7r5细胞经D-gal处理后ROS水平升高。与模型组相比,VE阳性对照组和POP处理组中细胞染色阳性细胞数减少,ROS染色阳性细胞荧光强度分别为27.41%±1.96%、25.41%±2.58%,荧光强度明显下调(P<0.001,n=3)。细胞内的酯酶可以将本身没有荧光的探针DCFH-DA水解。活性氧可将水解产物DCFH氧化为有荧光的DCF,从而利用荧光强度反应活性氧水平。实验结果表明,POP可以有效抑制D-gal诱导的A7r5细胞中ROS的表达水平。

图5 POP对D-gal诱导的A7r5细胞中ROS水平的影响Fig.5 Effect of POP on the level of ROS in A7r5 cells induced by D-gal
2.7 POP对A7r5细胞线粒体膜电位的影响
应用线粒体膜电位检测试剂盒(JC-1)对D-gal刺激A7r5细胞的线粒体膜电位变化进行检测。如图6A~D为对照组、模型组、阳性对照VE组(100 μg/mL)、POP组(100 μg /mL)、图6E为 JC-1染色的荧光强度细胞计数分析。通过共聚焦显微镜检测JC-1时可以参考观察其它荧光时的设置,通过PI通道可观察到聚合物(JC-1 aggregates)红色荧光,FITC通道可观察到JC-1单体(JC-1 monomer)绿色荧光。并对不同通道的红绿荧光进行Merge。通过红绿荧光颜色的转变可知线粒体膜电位的变化。染色结果表明,与对照组相比,经D-gal处理的模型组JC-1染色的红色荧光强度为18.74%±2.96%(P<0.001,n=3),此时JC-1多为单体,绿色荧光强于红色荧光,表明线粒体膜电位降低。与模型组相比,100 μg/mL POP处理组及VE阳性对照组处理后,JC-1在线粒体的基质中聚集形成聚合物,绿色荧光强度减弱,红色荧光强度升高分别为41.78%±3.24%、51.48%±4.69%,线粒体膜电位升高。结果表明POP对D-gal诱导的A7r5衰老细胞线粒体膜电位具有保护作用。
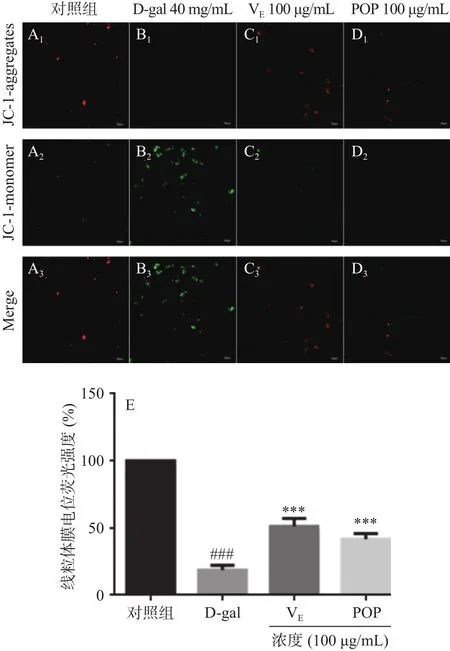
图6 POP对D-gal诱导的A7r5细胞线粒体膜电位的影响作用Fig.6 Effect of POP on the mitochondrial membrane potential of A7r5 cells induced by D-gal
3 讨论
随着老龄化社会的到来,衰老相关疾病阿尔茨海默病、2型糖尿病、骨质疏松、动脉粥样硬化等可严重影响人群健康。因此,抗衰老的研究也成为衰老研究领域的热点。本研究采用水提醇沉法提取传统中草药玉竹根中的多糖活性成分,在料液比为1:20 g/mL、提取温度90 ℃、提取时间为2.5 h条件下POP得率可达到8.23%,测得所提取的POP总糖含量为76.48%±0.036%。通过β-gal染色法、活性氧染色法、JC-1染色法深入探讨POP体外抗衰老的生物学过程。
D-gal致衰老模型的生化指标和生理指标均与自然衰老相似,并广泛用于抗衰老的研究[24]。目前有很多研究应用D-gal构建衰老模型,诱使ROS累积产生氧化应激[25-26]。Liu等[27]应用D-gal诱导心肌细胞衰老,影响心肌细胞内 SA-β-gal活性、ROS的产生及MDA含量。本研究成功构建D-gal诱导A7r5细胞衰老模型,并进一步证实POP可呈剂量依赖性增强A7r5细胞活性,且浓度在100 μg/mL时可显著保护D-gal诱导的A7r5细胞存活率下降,维持细胞正常活性。蒋春茂等[28]的研究证实POP浓度为1250 μg/mL时可增强T淋巴细胞的活性,并增强脂多糖刺激后脾脏B淋巴细胞的活性。王迦琦等[29]研究表明植物中多糖成分具有提高细胞存活率,保护细胞氧化损伤的能力。
衰老细胞通常在pH6.0时有高酶活性的SA-βgal,目前SA-β-gal已被证实与衰老密切相关[30]。SA-β-gal作为一种溶酶体水解酶,是目前应用最广泛的细胞衰老生物标志物[31]。吴爽等[32]的研究中表明衰老的人皮肤成纤维细胞中SA-β-gal活性显著升高。本研究检测不同组别A7r5细胞中SA-β-gal活性的变化,与模型组相比,POP可降低 D-gal诱导的A7r5细胞中SA-β-gal活性。因此POP可以减少衰老细胞中SA-β-gal的产生。
D-gal可诱导细胞代谢及特异性酶的改变,半乳糖合成酶可将D-gal氧化产生大量自由基,并使ROS水平增加,导致DNA稳定性遭到破坏进而诱导氧化应激反应,损伤细胞,改变细胞膜的成分,从而诱导细胞衰老[33-34]。ROS在细胞生物学中发挥重要的作用,它们主要来源于线粒体[35-36]。ROS的产生可以引发氧化应激[37],从而导致线粒体功能紊乱。细胞衰老与线粒体功能障碍有很大的联系。许梦然等[38]证实植物中草药中的多糖成分可有效抑制ROS水平,保护及线粒体膜电位稳定。但目前还未有关于POP抑制氧化应激保护线粒体膜电位的研究。应用线粒体膜电位的变化反应其线粒体功能的稳定性,在线粒体膜电位较高时,JC-1聚集在线粒体的基质中形成聚合物产生红色荧光。在线粒体膜电位较低时,JC-1不能聚集在线粒体的基质中,此时JC-1为单体产生绿色荧光[39-40]。我们的研究证实,与模型组相比,POP可使D-gal诱导的A7r5细胞中ROS水平明显降低,抑制氧化应激,此时JC-1多为聚合体形式红色荧光增强,线粒体膜电位升高。因此POP可抑制细胞内ROS的产生,抑制线粒体膜电位下降使线粒体膜电位稳定,从而保护D-gal诱导的A7r5细胞衰老。
4 结论
多糖为玉竹中最主要成分,毒副作用小,具有药食同源的功效。本研究应用简单、易操作、得率高的水提醇沉法提取POP。并将所提取纯化的POP作用于A7r5细胞研究其对D-gal刺激A7r5细胞损伤的保护作用。细胞实验表明POP可有效地促进细胞增殖,增强细胞活力,抑制D-gal诱导A7r5细胞存活率下降,减少D-gal诱导A7r5细胞衰老时SA-βgal的产生。POP可降低经D-gal诱导后A7r5细胞中ROS的荧光强度,抑制氧化应激保护线粒体膜电位稳定,从而抑制细胞衰老。在今后的研究中,本实验将针对其生物学分子机制,更深入地研究POP的抗衰老作用机制,为POP的应用及抗衰老食品的研发领域提供理论依据。

