血清白介素17、脂蛋白(a)水平与ST段抬高型心肌梗死患者经皮冠状动脉介入术后支架内血栓形成的关系研究
崔玉梅,董蕾
经皮冠状动脉介入术(percutaneous coronary intervention,PCI)是治疗ST段抬高型心肌梗死(ST-segment elevation myocardial infarction,STEMI)的主要手段,可疏通狭窄/闭塞的冠状动脉管腔,快速恢复心肌血供,进而减轻患者病情严重程度[1]。但部分STEMI患者经PCI后会发生支架内血栓形成,从而影响PCI治疗效果,增加患者死亡风险[2]。因此,寻找可早期预测STEMI患者PCI后支架内血栓形成的临床指标至关重要。炎症反应在STEMI发生、发展过程中具有重要作用,白介素17(interleukin 17,IL-17)为炎症反应的早期启动因子,可促进T细胞激活内皮细胞、上皮细胞,从而产生多种炎症因子,进而诱发炎症反应[3]。STEMI发生与血脂异常所致的动脉粥样硬化密切相关,其中脂蛋白(a)〔lipoprotein(a),Lp(a)〕是一种特殊脂蛋白,其已被证实与动脉粥样硬化性心血管疾病有关[4]。基于此,本研究旨在探究血清IL-17、Lp(a)水平与STEMI患者PCI后支架内血栓形成的关系,现报道如下。
1 对象与方法
1.1 研究对象 回顾性选取2016年2月至2020年12月于北京市第六医院行PCI的256例STEMI患者,其中男178例,女78例;年龄40~63岁,平均(53.5±5.4)岁;合并症:高血压142例,糖尿病143例。根据患者PCI后1年内是否发生支架内血栓形成分为血栓组和无血栓组。纳入标准:(1)随访1年;(2)病历资料完整。排除标准:(1)存在脑梗死病史者;(2)合并恶性肿瘤者;(3)合并肝、肾等脏器疾病者;(4)合并风湿性疾病者;(5)合并血液系统疾病者;(6)有心脏手术史者;(7)合并心源性休克者;(8)伴有严重出血倾向者。
1.2 支架内血栓形成评估方法 患者PCI后遵医嘱定期回院复查,采用西门子Artis Zee Ceiling血管造影机(上海三崴医疗设备有限公司生产)行冠状动脉造影检查,结果显示既往植入的支架上有造影且明确为支架内血栓,判定为支架内血栓形成。
1.3 研究方法
1.3.1 基线资料收集 查阅患者病历资料,收集其基线资料,包括性别、年龄、BMI、合并症(高血压、糖尿病)。
1.3.2 实验室检查指标 收集患者实验室检查指标,具体指标及检测方法如下:采用贝克曼库尔特LH 750型全自动血细胞分析仪检测血小板计数、白细胞计数,采用酶联免疫吸附试验检测血浆纤维蛋白原、脑钠肽及血清肌红蛋白、IL-17、Lp(a)水平,采用全自动生化分析仪(深圳迈瑞生物医疗有限公司生产,BS-280)检测血清总胆固醇水平。
1.4 统计学方法 采用SPSS 25.0统计学软件进行数据处理。计量资料进行Shapiro-Wilk正态性检验,均符合正态分布,以(±s)表示,组间比较采用两独立样本t检验;计数资料以相对数表示,组间比较采用χ2检验;STEMI患者PCI后支架内血栓形成的影响因素分析采用多因素Logistic回归分析;绘制ROC曲线以评价血清IL-17、Lp(a)水平及二者联合对STEMI患者PCI后支架内血栓形成的预测价值,其中AUC>0.90为预测价值较高、0.71~0.90为预测价值中等、0.50~0.70为预测价值较差。双侧检验水准α=0.05。采用R 4.1.0统计分析软件中“rmda”软件包绘制决策曲线,以分析血清IL-17、Lp(a)水平及二者联合在临床决策中的应用价值。
2 结果
2.1 STEMI患者PCI后支架内血栓形成发生情况 256例STEMI患者中,50例PCI后1年内发生支架内血栓形成,发生率为19.5%(50/256)。
2.2 两组患者基线资料及实验室检查指标比较 血栓组和无血栓组患者性别、年龄、BMI、高血压发生率、糖尿病发生率、血小板计数、白细胞计数及血浆纤维蛋白原、血清肌红蛋白、血清总胆固醇水平比较,差异无统计学意义(P>0.05);血栓组患者血浆脑钠肽、血清IL-17、血清Lp(a)水平高于无血栓组,差异有统计学意义(P<0.05),见表1。
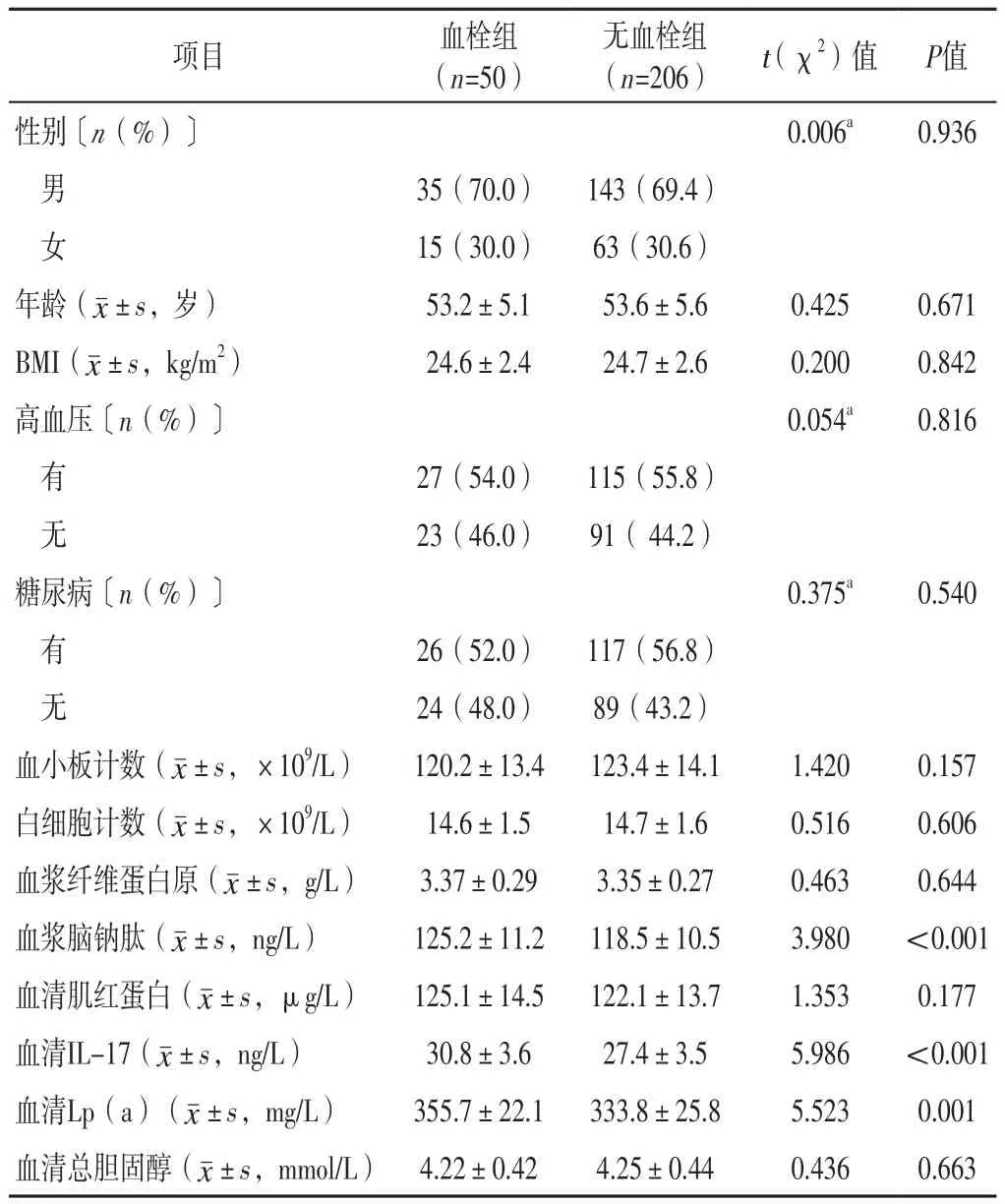
表1 两组患者基线资料及实验室检查指标比较Table 1 Comparison of baseline data and laboratory indicators between the two groups
2.3 多因素Logistic回归分析 将表1中差异有统计学意义的指标作为自变量(赋值:实测值),将STEMI患者PCI后支架内血栓形成作为因变量(赋值:未发生=0,发生=1),进行多因素Logistic回归分析,结果显示,血浆脑钠肽、血清IL-17、血清Lp(a)水平是STEMI患者PCI后支架内血栓形成的独立影响因素(P<0.05),见表2。
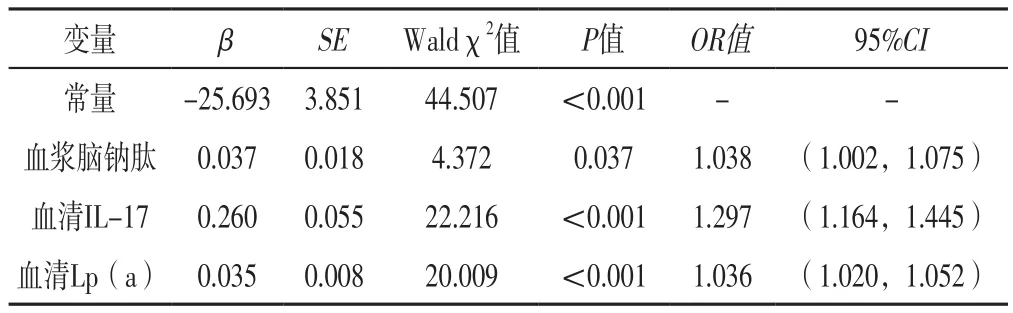
表2 STEMI患者PCI后支架内血栓形成影响因素的多因素Logistic回归分析Table 2 Multivariate Logistic regression analysis of influencing factors of in-stent thrombosis after PCI in patients with STEMI
2.4 ROC曲线 ROC曲线分析结果显示,血清IL-17、Lp(a)水平及二者联合预测STEMI患者PCI后支架内血栓形成的AUC分别为0.745〔95%CI(0.667,0.822)〕、0.748〔95%CI(0.677,0.819)〕、0.777〔95%CI(0.711,0.842)〕,见表3、图1。
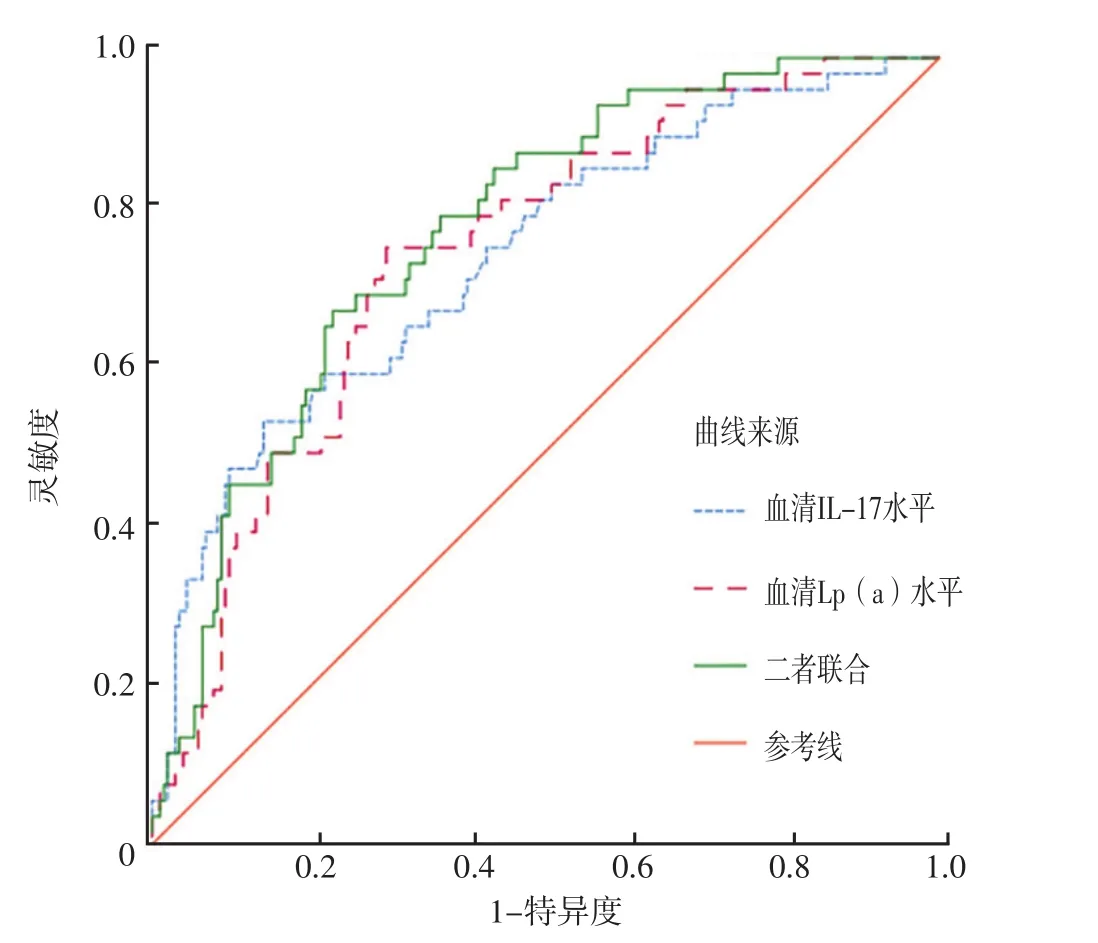
图1 血清IL-17、Lp(a)水平及二者联合预测STEMI患者PCI后支架内血栓形成的ROC曲线Figure 1 ROC curve of serum IL-17,Lp(a) levels and their combination for predicting the in-stent thrombosis after PCI in patients with STEMI
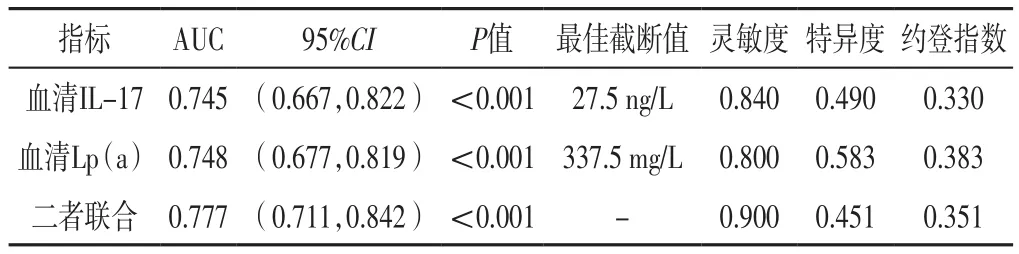
表3 血清IL-17、Lp(a)水平及二者联合对STEMI患者PCI后支架内血栓形成的预测价值Table 3 Predictive value of serum IL-17,Lp(a)levels and their combination for in-stent thrombosis after PCI in patients with STEMI
2.5 决策曲线 决策曲线分析结果显示,在0.01~0.41的阈值概率区间,血清IL-17、Lp(a)水平联合评估STEMI患者PCI后支架内血栓形成的净收益率优于单一血清IL-17、Lp(a)水平,见图2。
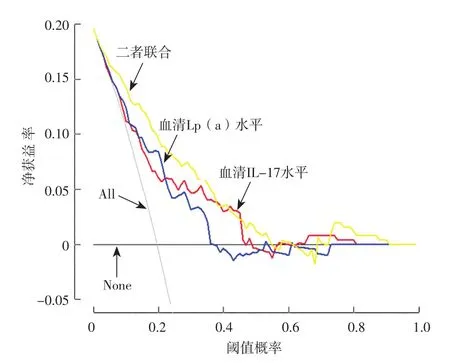
图2 血清IL-17、Lp(a)水平及二者联合评估STEMI患者PCI后支架内血栓形成风险的决策曲线Figure 2 Decision curve of serum IL-17,Lp(a)levels and their combination for predicting the risk of in-stent thrombosis after PCI in STEMI patients
3 讨论
STEMI多因冠状动脉急性闭塞引起,具有较高的发病率,是威胁中老年人群健康的主要原因之一[5]。PCI是治疗STEMI的重要方法,可促进缺血心肌血流再灌注,减轻患者胸痛、心悸等症状,但仍有部分STEMI患者PCI后会发生支架内血栓形成,从而引发不稳定型心绞痛、急性心肌梗死、心脏性猝死等,严重威胁患者的生命安全[6-7]。本研究结果显示,本组STEMI患者PCI后支架内血栓形成发生率为19.5%,与贺伟[8]研究报道的STEMI患者PCI后支架内血栓形成发生率(18.75%)相似,提示STEMI患者PCI后支架内血栓形成发生风险较高。因此,寻找可以早期评估STEMI患者PCI后支架内血栓形成发生风险的临床指标具有重要意义。
临床已证实,心脏标志物心肌肌钙蛋白诊断心肌损伤具有较高的灵敏度和特异度,且临床指南已将其作为诊断STEMI、评估STEMI患者预后的常用指标之一[9]。因此,本研究未对心肌肌钙蛋白进行分析。
脑钠肽主要由心室肌细胞合成、分泌,可以反映心肌梗死局部室壁张力变化情况,而监测心肌梗死患者血浆脑钠肽水平可以预测梗死区域及左心室功能等[10]。当机体发生心肌细胞收缩障碍或因心室重构导致心室壁张力升高时,心室肌细胞会释放大量脑钠肽,进而导致血浆脑钠肽水平异常升高[11]。脑钠肽水平越高,表明心肌损伤越严重,STEMI患者PCI后支架内血栓形成发生风险越高。本研究结果显示,血浆脑钠肽水平是STEMI患者PCI后支架内血栓形成的独立影响因素,证实了上述观点。
既往研究表明,STEMI的发生与冠状动脉粥样硬化有关,而血脂异常、炎症因子是冠状动脉粥样硬化形成的危险因素[12]。Lp(a)、IL-17均参与冠状动脉粥样硬化形成,且在心血管疾病发生、发展过程中具有不可忽视的作用[13]。本研究结果显示,血清IL-17、Lp(a)水平是STEMI患者PCI后支架内血栓形成的独立影响因素,分析其原因如下:IL-17是由辅助性T细胞分泌的特征性因子,也是诱导炎症反应的重要因子,可活化巨噬细胞,促进多种细胞因子释放白介素8、白介素6及肿瘤坏死因子α等炎症因子,进而诱导炎症反应,造成血管炎性损伤,促进STEMI的发生、发展[14]。研究表明,高水平IL-17是导致急性心肌梗死患者斑块不稳定甚至破裂的主要原因,而斑块不稳定、破裂会加重机体的炎症反应,诱发支架内血栓形成[15]。Lp(a)独特的载脂蛋白A和低密度脂蛋白部分会参与机体的脂质代谢、纤维蛋白溶解及凝血等,促使平滑肌细胞增殖,在动脉粥样硬化及血栓形成中具有重要作用[16]。Lp(a)可以选择性损伤冠状动脉内皮细胞,其经平滑肌细胞与内皮细胞过度氧化修饰后可被巨噬细胞吞噬,促进泡沫细胞生成,进而影响动脉粥样硬化斑块的稳定性,增加PCI后支架内血栓形成发生风险[17]。
本研究进一步绘制ROC曲线,结果显示,血清IL-17、Lp(a)水平及二者联合预测STEMI患者PCI后支架内血栓形成的AUC均>0.70,具有中等预测价值;决策曲线分析结果显示,在0.01~0.41的阈值概率区间,血清IL-17、Lp(a)水平联合评估STEMI患者PCI后支架内血栓形成的净收益率优于单一血清IL-17、Lp(a)水平,表明对STEMI患者进行PCI时可以监测血清IL-17、Lp(a)水平并采取对应的干预措施,以减少支架内血栓形成发生风险,改善患者预后。
综上所述,血清IL-17、Lp(a)水平升高会增加STEMI患者PCI后支架内血栓形成发生风险,血清IL-17、Lp(a)水平及二者联合对STEMI患者PCI后支架内血栓形成具有一定预测价值;在0.01~0.41的阈值概率区间,血清IL-17、Lp(a)水平联合在临床决策中具有更高的应用价值。本研究因人员及时间限制问题,仅对STEMI患者PCI后1年内的随访资料进行分析,未来还需要延长随访时间,深入分析血清IL-17、Lp(a)水平在临床疾病监测及治疗中的应用价值。
作者贡献:崔玉梅进行文章的构思与设计、结果分析与解释,负责撰写、修订论文;董蕾进行研究的实施与可行性分析,数据收集、整理、分析,负责文章的质量控制及审校,并对文章整体负责、监督管理。
本文无利益冲突。

