脊髓海绵状血管瘤的临床特征及显微外科手术治疗预后分析
史良,阎涛,王科大,刘龙奇,王汉斌,乔京元,苏亦兵
本领域存在的争议:
脊髓海绵状血管瘤(SCCH)的症状多变,手术风险较高,故手术适应证及手术时机尚存在争议。多数研究认为症状严重或进展的SCCH患者需手术干预;而症状轻微或处于缓解期的SCCH患者是否需要手术治疗尚存在争议。
本研究观点:
本研究结果发现,症状轻微或处于缓解期的SCCH患者如手术风险可控,应与患者充分沟通后尽早手术治疗,以免再次出血而导致不可逆的神经损伤。
海绵状血管瘤亦称海绵状血管畸形(cavernous malformation,CM),属于血管畸形的一种,并非真正意义上的肿瘤,其病变多为良性血窦样血管瘤结构,内衬为血管内皮细胞[1]。海绵状血管瘤可发生于身体的任何部位,中枢神经系统中原发海绵状血管瘤多发生于脑及脑干,而发生于脊髓内的海绵状血管瘤则较为罕见,占所有脊髓血管病变的5%~12%,占髓内肿瘤的5%[2]。脊髓海绵状血管瘤(spinal cord cavernous hemangioma,SCCH)多发生于胸段脊髓内,其起病早期症状隐匿,因瘤体常反复出血,可导致严重的脊髓损伤,造成脊髓功能下降甚至截瘫,临床工作中极易误诊漏诊,需早期识别,目前治疗仍以显微外科手术切除为主,但手术风险较大,手术时机、手术入路及预后值得进一步总结与讨论。本研究回顾性选取17例SCCH患者的相关资料,分析其临床表现、影像学表现、手术及随访情况,以期为SCCH的临床诊疗提供依据。
1 对象与方法
1.1 研究对象 回顾性选取2005年1月至2021年1月北京积水潭医院神经外科收治的17例SCCH患者,其中男7例,女10例;年龄26~67岁,平均(50.3±12.9)岁;病程1周~10年。均采用脊髓磁共振成像(magnetic resonance imaging,MRI)诊断为SCCH,其典型的表现为脊髓内占位病变,T1加权成像(T1 weighted imaging,T1WI)及T2加权成像(T2 weighted imaging,T2WI)呈混杂信号,增强呈“桑葚”状,病灶周边呈T2低信号[1,3]。纳入标准:(1)经脊髓MRI明确诊断,并经手术证实者;(2)曾出现或存在明确的SCCH相关症状、体征者;(3)入院前未行其他相关手术治疗者。排除标准:(1)伴其他类型脊髓血管畸形者;(2)有手术禁忌证者;(3)临床资料不完整者。
1.2 显微外科手术 所有患者确诊后,根据临床表现及分类、影像学资料及实验室检查结果,与患者及家属沟通后确定治疗方案。治疗方案首选显微外科手术,即后路椎板减压、显微镜下脊髓内病变切除、硬膜修补并棘突椎板复位术。患者均进行全身麻醉,取俯卧位,采用C型臂进行术前定位,定位针位于相应节段棘突,根据病变累及范围,选择相应的后正中切口,显露相应节段椎板,使用磨钻/铣刀或超声骨刀分离椎板及棘突,暴露硬膜,切开硬膜,常可见脊髓表面呈淡黄色或黄褐色,部分患者瘤体突出脊髓表面,使脊髓局部呈蓝褐色,周边常伴随血管迂曲增多。在病变最近的脊髓后正中、后外侧切开软膜,清除陈旧出血后沿瘤体周围黄染的胶质增生带进行分离,肿瘤周边血管应酌情离断,瘤体可整块或分块切除。常规缝合硬膜,留置引流管后,止血并行椎板棘突复位,同时常规送病理检查。
1.3 术后处理及随访 术后给予抗感染、激素、营养神经及康复等治疗,常规佩戴支具固定3个月。所有患者每6~12个月定期复查脊髓MRI,随访截至2021-06-01。并分别于入院时、出院时及出院后6个月采用疼痛视觉模拟量表(Visual Analogue Scale,VAS)[4]评估疼痛程度,采用McCormick脊髓功能分级[5]评估脊髓损伤情况,采用欧洲脊髓病评分(European Myelopathy Score,EMS)[6]评估预后情况。其中VAS评分范围为0~10分,0分为无痛,10分为最剧烈疼痛,分数越高表示疼痛越剧烈。McCormick脊髓功能分级为,Ⅰ级:神经功能正常;Ⅱ级:神经功能缺损影响肢体活动,但仍能行走;Ⅲ级:稍严重的神经功能缺损,需支具或轮椅辅助行走;Ⅳ级:严重神经功能缺损,不能独立行走。EMS评估内容包括上运动神经元功能、下运动神经元功能、共济步态、感觉异常与疼痛、膀胱和直肠功能等,总分为5~18分,评分越低提示脊髓受损越严重。术后EMS或随访EMS高于术前EMS视为手术有效。
1.4 观察指标 记录患者的临床表现、影像学表现、手术及随访情况。根据病情进展进行疾病分类:(1)急性起病型:第一次发病为急性起病合并较重的神经功能障碍;(2)缓解复发型:急性起病后自行好转,被患者忽略或被漏诊,再次发病或多次发病;(3)进行性加重型:发病后症状长期未缓解并呈缓慢进行性加重[3]。
1.5 统计学方法 采用SPSS 22.0统计学软件进行数据分析。计量资料符合正态分布以(±s)表示,组内比较采用配对t检验;计数资料以相对数表示。以P<0.05为差异有统计学意义。
2 结果
2.1 临床表现 17例患者中,14例(82.4%)无明显诱因出现症状,2例(11.8%)自述劳累后发病,1例(5.9%)搬重物后发病;首发症状为颈肩、腰背或肢体不适感,其中11例(64.7%)以疼痛为主要表现,4例(23.5%)表现为感觉减退、肢体麻木、发凉等,2例(11.8%)以肢体无力为首发症状;疾病分类:急性起病型2例(11.8%),缓解复发型10例(58.8%),进行性加重型5例(29.4%);入院时查体:完全截瘫1例(5.9%),不完全截瘫2例(11.8%)(双下肢肌力0~2级),肢体无力5例(29.4%)(肢体肌力3~4级),仅表现为局部疼痛伴/或不伴肢体感觉障碍9例(52.9%)(其中合并括约肌功能异常4例)。
2.2 影像学表现 所有患者入院后行MRI平扫+增强扫描,可见脊髓相应节段占位性病变,矢状面上表现为病灶呈“爆米花”或“桑葚”状,T1WI及T2WI呈混杂信号,边界清楚,T2WI中病灶周围有低信号环状包绕区域,增强MRI表现为病变有不同程度强化;但所有病灶内部无血管流空影,未见明显灶周水肿及占位效应(见图1),2例患者因合并出血病灶可依血肿时间不同出现不同信号。病变累及1~2个脊髓节段,平均(1.1±0.3)个节段;累及胸髓11例(64.7%),圆锥4例(23.5%),颈髓2例(11.8%)。

图1 SCCH患者术前影像学表现Figure 1 Preoperative imaging findings of SCCH patients
2.3 手术情况 17例患者均接受手术治疗,手术时间为175~240 min,平均(206.2±17.2)min;术中出血量为200~500 ml,平均(344.1±84.6)ml;住院时间为15~46 d,平均(22.1±7.4)d。术中病变切除程度:完全切除13例(76.5%),近全切除3例(17.6%),部分切除1例(6.9%)。所有患者术后给予常规抗炎、对症支持治疗,术后病理检查均证实为海绵状血管瘤结构。
2.4 随访情况 入院时17例患者VAS评分为0~6分,平均(3.2±1.2)分;McCormick脊髓功能分级:Ⅰ级2例,Ⅱ级7例,Ⅲ级5例,Ⅳ级3例;EMS为7~16分,平均(11.8±2.3)分。
17例患者中1例出现术后切口感染,给予对症治疗,其余未见其他严重并发症;2例出现局部疼痛,VAS评分为3~4分,给予药物止痛治疗。
出院时17例患者VAS评分为0~4分,平均(1.8±1.1)分,低于入院时,差异有统计学意义(t=3.55,P=0.001)。McCormick脊髓功能分级:Ⅰ级5例,Ⅱ级7例,Ⅲ级4例,Ⅳ级1例。EMS为7~17分,平均(12.8±2.7)分;所有患者术后EMS高于术前EMS。
患者随访10~134个月,平均37.5个月。随访6个月时,VAS评分为0~4分,平均(1.2±1.1)分,低于入院时,差异有统计学意义(t=5.07,P<0.001)。McCormick脊髓功能分级:Ⅰ级12例,Ⅱ级4例,Ⅲ级1例,Ⅳ级0例。EMS为9~17分,平均(14.5±2.3)分;所有患者随访EMS高于术前EMS。每6~12个月定期复查脊髓MRI,未见复发或再次出血。
2.5 典型病例 患者女,26岁,主诉“突发双下肢麻木无力5 d,伴大小便障碍2 d”,于2018-03-13入院。入院前5 d,患者无明显诱因出现臀部及双下肢麻木、无力,大小便失禁,急诊入院。入院查体:双下肢肌力1~2级,感觉减退位于T11平面;术前MRI见图2A~D。完善检查后行后路椎板减压、显微镜下脊髓内病变切除、硬膜修补并棘突椎板复位术,术中MRI见图2E~G。术后19 d出院,出院时患者双下肢麻木感较术前好转,双下肢肌力3~4级,大小便较前好转。术后半年复查时,患者主诉下肢运动及大小便完全恢复正常,麻木感仍存在,但较术前明显好转。查体:肌力5级,痛温觉基本正常,深感觉稍差。复查MRI见图2H~K。
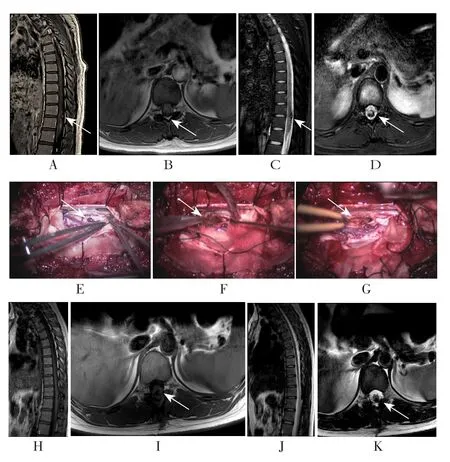
图2 1例SCCH患者术前、术中、术后影像学表现Figure 2 Preoperative, intraoperative and postoperative imaging findings of one SCCH case
3 讨论
SCCH属于隐匿性脊髓血管畸形,可发生于任何年龄段,多数学者认为其好发于青壮年,发病高峰为30~40岁[3,7],祝永杰等[4]报道了一组病例,平均年龄为37岁,男女比例为3.4∶1。SANDALCIOGLU等[8]报道,SCCH发病年龄为17~73岁,平均34.5岁。而AOYAGI等[7]报道的一组病例年龄为5~78岁,平均47岁,男女比例为2∶1。本研究中17例患者的发病年龄为26~67岁,平均50.3岁,与AOYAGI等[7]报道基本一致;而男女比例为1∶1.43,与以上报道似有一定差异,但与SANTORO等[9]报道一致。有报道认为,SCCH可伴发其他部位的血管病变及Klippel-Trenaunay Weber综合征,并有一定家族聚集倾向[10],但本组未见有明显家族史或合并其他血管性疾病者,需进一步研究证实。
SCCH的临床表现与严重程度主要取决于血管瘤累及部位、出血量、受累节段脊髓的损伤程度、出血的次数等多种因素,故症状多种多样,主要症状包括局部神经压迫引起的疼痛、感觉运动障碍以及括约肌功能障碍等。SANDALCIOGLU等[8]根据SCCH的临床发病特点,将其总结并分为4种类型:(1)间断、反复发作性神经功能减退,在发作间期又有不同程度的功能恢复,为主要的临床特征;(2)进行性神经功能减退,中间缓解期不明显;(3)急性出血,发病急骤,神经功能急剧减退,可造成截瘫等严重后果;(4)急性发病,但症状轻微,以反复发作性背部或肢体疼痛最为常见。而祝永杰等[3]与杨玉明等[11]认为其临床表现分为三类,取消了第四种类型。本研究观察发现17例患者中,首发症状11例表现为局部疼痛,4例表现为感觉减退、肢体麻木、发凉等,2例表现为肢体无力,且疼痛患者也表现为缓解、加重反复发作特征,故认同将第四种类型SCCH归于第一种类型,即将SCCH分三类即可。本研究17例患者中急性起病型2例,仅占11.8%,该类型患者神经功能损伤较重,进展迅速,常提示预后不佳,MRI显示为典型的出血信号,但信号多变且与血肿时间差异有关,此类患者常需早期手术治疗以解除脊髓压迫;缓解复发型10例(58.8%),与既往研究结果[12]一致,这是最为常见的类型,症状突发,如反复发作的颈肩痛、腰背酸痛或肢体麻木等,而后自行缓解,多被忽略或误诊,反复发作并症状逐渐加重后确诊,MRI显示为典型的矢状位上呈“爆米花”或“桑葚”状,混杂信号,边界清楚,T2WI中病灶周围有低信号环状包绕区域,增强MRI表现为病变有不同程度强化;进行性加重型5例(29.4%),其多因瘤体内反复少量出血并周围胶质增生,瘤体逐渐增大压迫脊髓所致,表现为在数周或数月内神经功能症状缓慢进行性加重,无明显的症状缓解期,MRI也表现为典型的“爆米花”或“桑葚”状,混杂信号及低信号环状包绕区域。
SCCH反复出血后可形成不同时期的出血灶及含铁血黄素沉积和钙化等,从而形成MRI特征性表现的病理学基础[10]。MRI可作为诊断SCCH的重要手段,其典型的MRI表现为脊髓内T1WI及T2WI混杂信号影,有时为强化的“爆米花”或“桑葚”状病灶,并且病灶周边为T2WI低信号的含铁血黄素带,即“牛眼征”,本研究中15例患者均为此典型表现,但2例患者因急性出血的时期不同,表现为不同的特征性T1WI及T2WI信号。MRI还可为手术提供瘤体的部位、大小、脊髓内侧别等信息。本组均为单发海绵状血管瘤,累及1~2个脊髓节段,平均(1.1±0.3)个节段。而病灶位于胸髓11例(64.7%),圆锥4例(23.5%),颈髓2例(11.8%),胸段最多见,与文献报道结果相仿[8,13]。但CHOI等[14]回顾文献认为,颈段及胸段SCCH的发病率相当,值得进一步总结。
SCCH虽不是真正意义的肿瘤,但其具有反复出血、瘤体缓慢增大的特点,加之其位于脊髓内,代偿空间狭小,常导致进展性的脊髓功能障碍,严重时甚至导致截瘫等恶性后果,故根治性切除病灶是治疗SCCH的首选方法,但对于不同类型的患者,手术适应证及手术时机尚有争议[15]。(1)对于急性出血伴神经功能障碍患者,应及早行手术治疗,但是否应立即急诊手术存在争议。AOYAGI等[7]与JALLO等[16]均建议在急性出血后4~6周的亚急性期再进行手术治疗,因此时脊髓水肿减轻,血管瘤与脊髓区分更清楚,利于完整切除血管瘤,但也有学者主张尽早行急诊手术以改善预后[3,11-12]。本研究中2例急性起病型患者均行急诊手术治疗,虽瘤内积血及脊髓水肿增加了手术难度,但仍可行肿瘤全切,患者术后神经功能也明显好转,同时避免了再次出血的风险,本研究认为此类患者应尽早手术治疗。(2)对于进行性神经功能减退者,学者一致认为应早期接受手术治疗,争取在脊髓功能发生不可逆损伤之前切除病变,这虽有可能导致短期内病情加重的风险增加,但患者远期预后较好。OGILVY等[17]研究指出,有症状的SCCH患者在出现严重或长期神经功能障碍前,早期接受手术治疗,可获得最佳的手术效果。本研究中5例进行性加重型患者均行早期手术治疗,除1例外,其他4例术后未见症状明显加重,5例患者长期预后均良好。(3)缓解复发型为最常见的类型,尤其是症状轻微或处于缓解期的SCCH患者,是否进行手术治疗存在争议。GROSS等[18]及JALLO等[16]认为,海绵状血管瘤多进展缓慢,手术风险较高,故倾向于对此类患者进行长期随访及MRI复查,一旦出现病灶向外部生长或出现渐进、严重的神经功能障碍,应进行手术治疗。但其他学者认为海绵状血管瘤年平均出血率达2.1%~4.5%[1-2,7-8],而SANDALCIOGLU等[8]特别指出曾经有过出血症状的患者,二次出血的风险可高达66%,其突发严重神经功能损伤风险远高于手术风险,故也建议应该早期进行手术治疗。本研究中的10例缓解复发型患者术前McCormick脊髓功能分级多为Ⅰ、Ⅱ级,术后疼痛等症状较术前明显缓解,但1例患者局部疼痛加重,2例患者出现麻木等神经症状加重;长期随访多数患者McCormick脊髓功能分级达Ⅰ级,术后EMS高于术前EMS,未见明显症状复发或加重情况,故本研究认为应与此类患者沟通手术必要性与风险,争取获得患者理解并尽早进行手术治疗,不要因症状缓解或担心手术风险而延误手术时机,导致预后不良,但同时应尽可能减少术中脊髓损伤,这就要求医师须有丰富的脊髓手术经验,熟悉脊髓结构与功能区域;术中应明确病灶区域,必要时采用超声及导航等手段定位,以减少脊髓的破坏;术中应在电生理监测下,精细柔和操作,术中双极电凝功率保持最小,避免热损伤,严格沿胶质增生带分离并整块切除病变,如非必要,不宜分块切除以免加重出血或损伤。
综上所述,SCCH作为一类罕见的脊髓内病变,其症状多变,手术风险较高。对于有临床症状进展的SCCH患者,早期行显微外科手术是最佳治疗选择,但术前应制定个体化手术方案,术中精细操作,可获得较满意的预后。而对于症状轻微或处于缓解期的患者,如手术风险总体可控,可积极进行手术治疗。但本研究为单中心、小样本量、回顾性研究,仍需进一步扩大样本量联合多中心、前瞻性研究进一步验证本研究结论。
作者贡献:史良、苏亦兵进行文章的构思与设计、研究的实施与可行性分析、质量控制与审校;史良撰写论文,对文章整体负责、监督管理;阎涛、王科大、乔京元进行资料收集;阎涛、王科大、刘龙奇进行资料整理;史良、王汉斌进行统计学处理与论文的修订。
本文无利益冲突。

