基因编辑技术在昆虫中的研究与应用
邱雨浩, 贾 豫, 倪建泉, 王 冰, 王桂荣
(1. 中国农业科学院植物保护研究所, 植物病虫害生物学国家重点实验室, 北京 100193;2. 清华大学医学院, 基因表达与调控实验室, 北京 100084)
随着测序技术的发展,多种常见昆虫的基因组均得到完整的测序与详细注释,提供深入了解昆虫的途径,而基因编辑技术的发展和应用则为人类提供改造和利用这些昆虫的能力。基因编辑技术包括诱导突变技术(Muller, 1927; Auerbach and Robson, 1946),转座子介导的基因编辑技术(Rubin and Spradling, 1982),锌指核酸酶(zinc finger nuclease, ZFN)技术(Kimetal., 1996),类转录激活因子效应物核酸酶(transcription activator-like effector nuclease, TALEN)技术(Lietal., 2011)以及目前炙手可热的成簇规律间隔短回文重复序列及其关联蛋白9[clustered regularly interspaced short palindromic repeats (CRISPR)/CRISPR-associated (Cas) protein 9, CRISPR/Cas9]技术。本文概述了基因编辑技术的原理及其在昆虫中的发展和应用,以期对昆虫基因功能的研究、经济性昆虫的改良、害虫的生物性防治等研究提供借鉴与参考。
1 基因编辑技术的发展和原理
人们对基因编辑的探索最早可以追溯至20世纪初(Muller, 1927; Auerbach and Robson, 1946),利用辐射以及化学物质诱导基因突变,但是这一方法只能产生随机突变,无法进行外源基因的插入以及在特定位点实现特定序列的编辑。早期的基因编辑技术主要是通过转座子转出并产生DNA双链断裂,进而以诱发DNA同源修复的方式向基因组中插入序列(Rubin and Spradling, 1982),但是这一方法效率低且实用性不高。除此之外,还有通过转座子转入介导的基因插入,例如P转座子、Hermes转座子、minos转座子、hobo转座子、mariner转座子和piggyBac(最初也被称为IFP2) 转座子。其中piggyBac转座子应用范围最广,适用性最强,其原理是依靠自身编码的转座酶,从TTAA位点切出或者转入,这一过程中允许转座子携带其他基因,也因此被广泛应用于生物基因编辑(Elicketal., 1996)。但是转座子插入位点的随机性较大,并且后续筛选步骤较为繁琐。
与同源重组技术相比,特异性的基因编辑技术可以更好地弥补转座子的不足。第一代ZFN技术应运而生,该技术将来自黄杆菌属细菌Flavobacteriumokeanokoites中的FokⅠ蛋白核酸切割域与来自真核生物转录因子的锌指DNA识别位点进行融合,使其可以识别不同基因序列,进行DNA切割并产生双链断裂。其中的Cys2-His2锌指蛋白域是真核生物中最常见的DNA结合元件,每一个锌指结构都包含约30个氨基酸,存在于α-螺旋上的部分氨基酸则可以通过DNA的大沟与3个碱基结合,并识别DNA序列(Gajetal., 2013)。借助于一段序列保守的连接蛋白,Gaj等(2013)成功构建了由多个锌指组成的DNA结合蛋白,最高可以识别并结合18个碱基长度的DNA,但是该技术设计过程复杂,实验操作成本较高。
随后发展出的第二代人工核酸内切酶——TALEN技术对作用位点的特异性结合作用更高,大大降低了错配率的发生。该技术原理与ZFN技术相似,只是其DNA识别结构域来自植物致病菌的转录因子的DNA识别域。TALE蛋白的DNA结合域由多个3~35个氨基酸的重复序列构成,其特异性取决于两个非保守的氨基酸(Gajetal., 2013)。与锌指蛋白相比,TALE蛋白不需要额外插入DNA识别域之间的连接蛋白,因此可以大大简化蛋白构建流程,但是仍然需要繁琐的基因合成工作。
第三代基于CRISPR/Cas9技术的基因组编辑系统起初是细菌用来抵御病毒入侵以及切割基因组中的插入病毒序列的防御系统,仅需通过一段100 bp碱基长度的引导RNA (small guide RNA, sgRNA)进行定位引导,其中有20 bp可以特异性识别并结合基因组的靶位点,使Cas9蛋白结合在基因组的特定位置并进行切割,产生核苷酸双链断裂(double-strand break, DSB) (Jineketal., 2012)。在DNA断裂位点,细胞可以通过同源介导的修复(homology-directed repair, HDR)或者非同源末端连接(non-homologous end joining, NHEJ)的方式进行DNA修复。NHEJ是在相关DSB识别蛋白、DNA连接蛋白的作用下,两段断裂的DNA被连接到一起,形成完整的DNA链。而HDR的方式可以利用同源染色体或者是携带同源序列的外源基因序列作为修复模板进行修复(Iliakisetal., 2004)。通过HDR的修复方式,人们也可以在基因组的特定位置插入所需的基因序列,使用NHEJ的方式可能会造成断裂位置碱基的插入或缺失,从而影响基因功能。2013年,张锋团队使用CRISPR/Cas9技术实现了在哺乳动物细胞中的基因编辑(Congetal., 2013)。第三代基因组编辑技术方便快捷且成本低廉,因此迅速被世界各地的实验室广泛应用,并衍生出一系列基因编辑工具。目前,CRISPR/Cas9基因编辑系统在双翅目(Gratzetal., 2013; Kistleretal., 2015)、膜翅目(Kohnoetal., 2016)、半翅目(Heuetal., 2020)、鳞翅目(Wangetal., 2013; Bietal., 2016; Changetal., 2017)和直翅目(Lietal., 2016)昆虫的基因功能研究中均有报道,实现了对基因功能的验证以及分子机制的解析。
2 基因编辑技术在模式昆虫果蝇中的研究与应用
为了更方便地对各种昆虫的基因功能进行研究,研究者将CRISPR/Cas9系统引入到模式昆虫中,开发并优化该系统的使用方法(表1)。
果蝇作为一种模式生物,研究历史悠久,具有生长周期短,易于饲养,遗传操作背景强,研究手段丰富等优点。20世纪80年代开展了果蝇体内有关基因编辑的研究。1983年,Engles在果蝇体内发现P转座子(Engels, 1983),随后这一转座子被用于果蝇的转基因编辑,至今仍发挥重要的研究作用。Bibicova等(2002)通过ZFN技术诱导果蝇染色体断裂,并在特定位点产生NHEJ修复带来的突变。Beumer等(2006)使用ZFN技术实现了对特定核苷酸DSB位点的HDR,从而得到携带标记DNA序列的果蝇后代。
随着第三代基因编辑系统的兴起,多个研究团队相继报道了CRISPR/Cas9基因编辑技术在黑腹果蝇Drosophilamelanogaster体内的应用。Gratz等(2013)向果蝇胚胎中注射两个质粒,分别表达Cas9和sgRNA,以期实现特定位点的突变,然而他们发现该方法获得的编辑效率不高,只有5.9%的果蝇发生了NHEJ突变;当他们将两个sgRNA以及一小段供体单链核苷酸一起注射后,会导致两段sgRNA中间的基因序列被敲除,并且能够实现外源序列的插入。Ren等(2013)和Sebo等(2014)分别开发了一种高效的基因编辑系统,通过直接向生殖细胞特异性表达Cas9蛋白的转基因果蝇胚胎中注射sgRNA表达载体得到突变后代,避免了体细胞突变。Sebo等(2014)通过sgRNA靶向插入的egfp和mcherry荧光蛋白来检测这套系统的工作效率。而Ren等(2013)以果蝇本身的white基因为靶点,除了检测基因突变效率,还对sgRNA脱靶效应进行了分析,并开发了相应的sgRNA设计程序(www.flyrnai.org/crispr),评估了不同启动子驱动sgRNA表达对突变效变效率的作用,发现全身性、全时间表达的Ⅲ型启动子U6B的效果最好,有接近100%的突变效率。在此基础上,Ren等(2014a)通过对Cas9蛋白进行改造,得到了只能切割单链的Cas9内切酶,在两条sgRNA的引导下才可以切割出DSB,大大降低了脱靶效应的副作用;之后他们又针对GC含量、注射浓度等多方面因素进行梯度实验,优化出一套成熟的基因编辑方案,并且通过注射多个sgRNA表达载体,可以一次性诱导多个基因同时突变(Renetal., 2014b)。
使用CRISPR/Cas9技术产生突变的果蝇往往需要通过复杂且大规模的基因组提取与PCR来进行筛选,因此,开发出更易于筛选的基因编辑技术也十分重要。Kane等(2017)开发出一套CRISPR共筛选系统,同时注射表达靶向目的基因的gRNA载体和表达靶向ebony基因的gRNA载体, 当ebony基因失效之后,果蝇体色会变成黑色。研究者发现,在ebony发生突变的果蝇中,有高达61%的果蝇发生了靶向基因突变,说明ebony突变与靶向基因突变之间存在较强的相关性。随后他们对使用HDR的方法产生突变体果蝇进行测试,也发现在ebony突变的果蝇中,高达18%的果蝇的目的基因发生了同源修复。
果蝇基因组中许多基因与人类基因同源,通过对果蝇细胞生物学、发育生物学和神经生物学等多个领域的研究发现其表型与人类疾病有许多的相似之处。Sun等(2021)通过CRISPR/Cas9技术在果蝇体内诱导了HP1c突变,用以研究HP1c在果蝇肠道中与肿瘤之间的关系。因此,利用基因编辑技术在果蝇体内开展基因功能研究有助于揭示人类疾病作用的神经通路,寻找调控疾病发生的关键作用靶标,为方便快捷地构建人类疾病模型提供一定的借鉴作用。
3 在医学媒介蚊虫中的研究和应用
蚊分布很广,种类很多,雌性蚊通常以动物血液为食,在吸食血液的过程中作为媒介传播多种蚊媒病,如疟疾、登革热、寨卡病毒感染等疾病。因此开发针对蚊子的基因编辑技术有利于研究和改造蚊,为防治多种蚊媒疾病提供合适的工具(表1)。

表1 已报道的CRISPR/Cas9系统在模式昆虫果蝇和医学媒介蚊虫中的研究与应用Table 1 Research and application of the CRISPR/Cas9 system reported in model insect Drosophilaand medical vector mosquitoes
对埃及伊蚊基因编辑的研究最早可以追溯至20世纪90年代。Coates和Lobo等的两项工作,均使用转座子介导黑腹果蝇D.melanogaster的cinnabar基因插入并导致蚊眼睛颜色的变化(Coatesetal., 1998; Loboetal., 2002)。随后的3项研究分别使用ZFN技术实现在埃及伊蚊体内对气味受体共受体(odorant receptor co-receptor, orco)、神经肽Y样受体1(neuropeptide Y-like receptor 1, npylr1)和味觉受体3(gustatory receptor 3, Gr3)基因的突变和功能丧失(DeGennaroetal., 2013; Lieschetal., 2013; McMenimanetal., 2014)。除此之外,Aryan等(2013)使用TALEN技术实现对埃及伊蚊kmo基因的编辑,获得白眼的后代。这些进展虽然可以提供在蚊子体内进行基因编辑的手段,但仍然存在一定的局限性,难以方便、快捷且精确地进行基因定点编辑。
Kistler等(2015)通过CRISPR/Cas9技术实现对埃及伊蚊基因组的编辑。通过共同注射浓度为40 ng/μL的sgRNA和Cas9 mRNA或Cas9蛋白,得到带有目的基因突变的埃及伊蚊后代,其中Cas9蛋白组的突变效率比mRNA组的突变效率高出约4倍左右。该团队同时注射200 nt左右长度的单链脱氧核糖核苷酸,试图获得通过HDR产生的目的位点的核苷酸插入,但是最终G1代中只有0.65%发生同源修复,有18.9%通过NHEJ修复途径发生碱基插入或缺失,剩下80.45%则为野生型。另外,有研究显示利用CRISPR/Cas9系统在埃及伊蚊体内实现了基因编辑,并且同时注射Ku70或者lig4基因的dsRNA序列抑制NHEJ的发生,提高了HDR效率(Basuetal., 2015; Halletal., 2015)。Itokawa等(2016)在致倦库蚊Culexquinquefasciatus体内注射Cas9蛋白编码RNA通过基因编辑诱导CYP9M10基因突变,使致倦库蚊对拟除虫菊酯的抗性显著降低。Li等(2017)在埃及伊蚊生殖细胞中构建稳定表达Cas9蛋白的品系,降低了构建突变体的工作量,提升了突变的准确性和效率以及HDR的修复效率,极大地方便了CRISPR/Cas9系统的应用。上述研究也表明该系统的突变效率受到基因靶点、蚊品种以及sgRNA结合位点的影响。
2018年Duverney团队开发了受体介导的卵巢分子转运技术(receptor-mediated ovary transduction of cargo, ReMOT),在Cas9蛋白上连接一段肽链(P2C),可以介导Cas9蛋白从埃及伊蚊的血淋巴转移到卵巢中,降低了对蚊的注射难度(Chaverra-Rodriguezetal., 2018);2020年,该团队再次将这一技术引入斯氏按蚊,扩充这一技术的应用范围(Maciasetal., 2020)。该技术成功地解决蚊虫卵小且需要在较短时间内注射的难题,实现在蚊体内对基因的高效编辑。
Burt(2003)最早提出基因驱动(gene drive)的概念,是一种将特定性状在种群中快速扩散的系统。该技术可以利用B染色体、转座子或核酸内切酶法等多种途径将一种特定的外源基因在种群中传播(Burt and Crisanti, 2018)。随着基因编辑技术的兴起,CRISPR/Cas9系统介导的基因驱动技术能够对蚊基因组进行编辑,在控制蚊虫种群数量和蚊媒疾病传播等方面具有重要研究价值。Gantz等(2015)和Hammond等(2016)分别报道了最新的研究进展,通过分别向斯氏按蚊体和冈比亚按蚊内引入一段Cas9和sgRNA表达系统,使其在生殖细胞中同时表达Cas9蛋白与sgRNA,通过切割以及同源修复的方式,这一套系统会被复制到另一条同源染色体的相同位置,从而实现在种群中的快速扩增。该技术可以用于调节蚊种群的发生以达到多种目的,例如使种群内的性别比例失衡以降低种群繁殖能力,或是增强蚊虫抗病能力,减少疟疾传播风险。Simoni等(2020)利用基因驱动技术,发现并设计一个名为“性别扭转基因驱动”(sex-distorter gene drive, SGDG)的雄虫驱动系统,使冈比亚按蚊种群通过自然繁衍,在约18代后有95%的个体全部转变为雄虫,为蚊虫的防治提供了新思路。除了SGDG系统以外,Galizi等(2016)通过CRISPR/Cas9系统在雄性冈比亚按蚊减数分裂过程中破坏X染色体结构,在不破坏雄蚊繁殖能力的情况下,使雌蚊数量显著减少,实现对种群性别比例的调控,从而降低雌性按蚊的数量。
4 在农业害虫中的研究进展
基因编辑技术同样可以应用于农业昆虫功能基因组的研究(表2),基因编辑工具的开发除了能够加速对靶标基因的研究效率,还能有针对性地解析农业昆虫中重要分子靶标的功能,研究农业害虫灾变机制等,为害虫防治提供新思路。
Li等(2016)利用CRISPR/Cas9系统针对飞蝗气味受体共受体基因Orco开展了基因编辑研究,结果显示在飞蝗卵内同时注射Cas9的mRNA与gRNA,G0代突变效率高达71.7%;通过对G1代的检测结果显示,突变体G0代中有88.1%的个体都产生了可遗传突变。在此基础上,Guo等(2020)又利用这一技术体系敲除蝗虫气味受体基因OR35,结果显示OR35-/-突变体降低4-乙烯基苯甲醚对蝗虫的触角的电生理反应和行为吸引,明确信息素4-乙烯基苯甲醚对蝗虫聚集行为的影响,为飞蝗的防治提供新策略。此外,基因编辑技术在鳞翅目昆虫研究中也取得了相应的进展。Bi等(2016)的研究发现,向斜纹夜蛾Spodopteralitura胚胎中注射表达Cas9蛋白的mRNA和调控斜纹夜蛾胚胎发育Slabd-A基因的sgRNA序列,观察到幼虫虫体分节异常和表皮色素沉积异位的表型,证明Slabd-A基因的确发生突变,通过进一步探索实验发现在一定范围内sgRNA浓度越高,胚胎孵化率越低,但是突变效率会随之升高。2019年,该团队又利用这项技术敲除斜纹夜蛾ebony基因以研究色素沉积的机制(Bietal., 2019),发现色素沉积在鳞翅目昆虫化蛹过程中具有调控作用,为鳞翅目害虫基因功能研究提供新的标记基因。Chang等(2017)通过CRISPR/Cas9系统敲除雄性棉铃虫Helicoverpaarmigera感受性信息素次要组分的气味受体基因HarmOR16,导致其可与未成熟的雌性交配,阐明棉铃虫次要性信息素成分作为性信息素拮抗剂参与调控棉铃虫的最优交配时机。Wang等(2018)利用CRISPR/Cas9技术在棉铃虫体内敲除解毒酶基因簇CYP6AE,使用杀虫剂处理后显著降低棉铃虫的存活率。Liu等(2020)利用CRISPR/Cas9技术同时引入两个基因的sgRNA进行双敲除试验,证实小菜蛾Plutellaxylostella两个气味受体蛋白共同作用识别异硫氰酸酯类化合物,解析小菜蛾识别十字花科寄主植物的分子机制。最新的一项研究揭示基因编辑技术在半翅目昆虫烟粉虱中取得突破性进展,Heu等(2020)利用ReMOT control技术,对Cas9蛋白进行修饰,融合一段卵巢靶向配体肽链,与sgRNA混合后直接向雌性烟粉虱体内注射,最终得到基因编辑后的子代,为解决烟粉虱胚胎小、注射难度大等技术难题提供新的方法。
5 在有益昆虫利用上的研究与应用
鳞翅目家蚕Bombyxmori具有良好的经济价值,已经有多个研究团队利用基因编辑技术对家蚕的基因功能进行研究。Wang等(2013)首次在家蚕中成功地应用了CRISPR/Cas9系统,将表达Cas9和sgRNA的mRNA共同注射到家蚕胚胎中,成功突变靶基因BmBLOS2,由于该基因调控家蚕幼虫表皮中尿酸盐颗粒的形成,因此突变后导致家蚕幼虫表皮变为透明色。通过该方法得到G0代产生嵌合体的突变效率高达90%以上,并且该基因突变品系可以实现稳定遗传,在G1代也可以观察到全身变透明的转基因家蚕幼虫;此外,他们还通过同时注射两条sgRNA的方法,获得了大片段敲除的家蚕突变体。Zhu等(2015)发现在家蚕细胞中敲低NHEJ相关因子Ku70,Ku80,LigIV,XRCC4和XLF可以提高HDR的效率,并成功将EGFP基因序列敲入BmTUDOR-SN基因。Zeng等(2016)进一步优化CRISPR/Cas9系统在家蚕中的应用,研究发现家蚕U6启动子在体外和体内均能有效表达N20NGG型sgRNAs从而进行基因组编辑。相比于GN19NGG和GGN18NGG型的sgRNA设计位点,N20NGG型靶点在基因组中的匹配范围更广。Ma等(2017)在Cas9蛋白启动子上游添加HR3增强子将敲除效率提高了3.5倍,并且发现另外两种Cas9蛋白的同系物,即金黄色葡萄球菌Staphylococcusaureus的SaCas9和氨基酸球菌属Acidaminococcus的AsCpf1,它们也可以在家蚕细胞中发挥切割DNA的作用。
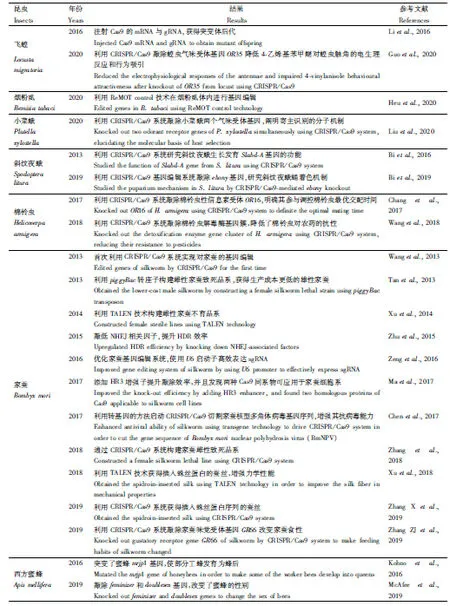
表2 基因编辑技术在害虫防治和益虫利用上的应用Table 2 Application of gene editing technology in pest insects and beneficial insects
昆虫性别决定机制复杂多样,家蚕作为鳞翅目模式昆虫是研究ZW型染色体昆虫性别决定较好的材料;此外,雄性家蚕具有更高的经济价值,因此构建雌性致死的家蚕品系也有助于降低工业养殖的成本。Tan等(2013)利用转基因技术构建piggyBac转座子介导的家蚕雌性致死品系,以获得生产成本更低的雄性家蚕, 这一技术同样有望被应用于害虫的防治工作中。Xu等(2014)结合转基因技术和TALEN技术构建出雌性不育的家蚕品系,这一表型仅在雌性中发生,而不影响雄性的正常发育。随后,Xu等(2017)利用CRISPR/Cas9技术敲除一系列基因,阐述这些基因对家蚕性别的影响,为后续家蚕性别筛选工作提供良好的基础。Zhang等(2018)首先利用TALEN技术构建nanos启动子驱动的雌性特异表达的Cas9品系,并将其与靶向家蚕胚胎致死基因tra2的转基因sgRNA表达品系进行杂交,通过CRISPR/Cas9系统获得雌性致死而雄性存活的家蚕后代。黄勇平和谭安江团队利用多种基因编辑技术构建家蚕性别调控体系(Tanetal., 2013; Xuetal., 2014, 2017; Zhangetal., 2018),这些研究为阐明家蚕性别决定的调控机制提供有力的证据。
基因编辑技术也应用在家蚕抗病毒和提高蚕丝质量等方面。Chen等(2017)利用piggyBac质粒,将IE1控制的Cas9蛋白和U6启动子控制的sgRNA导入家蚕基因组,并以家蚕核型多角体病毒(Bombyxmorinuclear polyhydrosis virus, BmNPV)的early-1(ie1)和me53基因为靶标,成功切割病毒基因组序列,极大地增强家蚕的抗病毒能力,为蚕病防治提供新的手段。Xu等(2018)使用TALEN技术将蚕丝蛋白重链基因FibH替换为蛛丝蛋白基因MaSp1。Zhang X等(2019)利用CRISPR/Cas9技术向家蚕中表达蚕丝蛋白基因FibH或FiBL内含子区域插入蛛丝蛋白基因MaSp1/MiSp1的序列,这些研究使蚕丝纤维的力学性能得到极大的改善,抗张力强度几乎与天然蜘蛛丝纤维相当,并且转基因能在后代中稳定遗传。
此外,Zhang ZJ等(2019)利用CRISPR/Cas9技术实现在家蚕体内对味觉受体基因GR66的敲除,得到的家蚕突变体改变其对桑叶的偏好性,可以进食多种食物,如水果或谷物种子。这项研究成果一旦应用于生产中,将助力家蚕养殖行业的快速发展。
基因编辑技术在经济昆虫蜜蜂中也被成功应用。Kohno等(2016)通过向西方蜜蜂Apismellifera胚胎中注射表达Cas9蛋白的mRNA和sgRNA,突变工蜂的mrjp1基因,在注射了57个胚胎之后得到6头发育为蜂后的雌蜂,并有1头蜂后可以产生雄性突变后代,为进一步研究蜜蜂的社会行为奠定基础。McAfee等(2019)使用CRISPR/Cas9技术敲除蜜蜂2个关键基因feminizer和doublesex使得其性别发生改变。Liu等(2019)使用CRISPR/Cas9技术对蜜蜂寄生性锥虫Lotmariapassim进行基因编辑,并通过HDR修复的方式插入目的基因,成功使后代携带上荧光标记或是获得潮霉素抗性。因此,利用CRISPR/Cas9技术研究基因功能也有助于解析蜜蜂与寄生虫之间的互作机制。
6 小结与展望
昆虫基因突变最早通过高能射线辐射、化学物质诱变产生随机突变,但是效率较低且无法控制后果;随后,研究者也使用过特异性的转座子介导DNA断裂从而启动HDR修复的方式,然而实用性和效率依然不尽人意。随着人类对蛋白质结构与功能的了解,通过将不同DNA识别域和FokI蛋白进行融合得到有特异性的DNA切割蛋白这一想法成为可能,ZFN和TALEN技术也应运而生,其中TALEN技术更易操作。但是鉴于这两种技术在蛋白构建上的高成本,因而很快被新发展起来的CRISPR/Cas9技术逐渐取代。
由于CRISPR/Cas9技术设计简单,深受广大科研工作者的青睐,该技术经过加工改造之后衍生出来更多的基因编辑工具,例如dCas9, CRISPRi, xCas9和Cas13a等系统,极大地丰富了调控和改造基因的手段。目前,CRISPR/Cas9基因编辑技术在昆虫体内的研究主要分成以下几个方向:(1)对基因编辑系统的优化,增加其编辑效率以及降低脱靶效应;(2)基于该系统进行新型基因调控工具的开发;(3)对工业生产、农业生产、害虫防治等方面的转基因昆虫品系构建;(4)重要基因的体内功能研究。
CRISPR/Cas9系统在昆虫中的应用仍然有较多亟待解决的问题,例如脱靶效应是基因编辑技术中无法绕过的难题。目前,一些研究通过优化sgRNA碱基偏好性和序列长度以降低脱靶效应,并且已经取得显著成效。Ren等(2014b)在模式昆虫果蝇中对影响CRISPR/Cas9系统特异性和效率的sgRNA参数进行系统的研究,发现当sgRNA与基因组DNA有3个及以上的核苷酸不匹配时,不会发生脱靶效应。此外,该研究团队还证明,在果蝇中CRISPR/Cas9系统的突变效率与sgRNA中6个前间区序列邻近基序(protospacer adjacent motif, PAM) 近端核苷酸的GC含量存在强烈的正相关,对提高CRISPR/Cas9系统在其他昆虫中的效率有一定的借鉴作用。除了对sgRNA进行优化,也可以针对Cas9蛋白进行优化,如通过修饰PAM识别位点,扩充Cas9蛋白的潜在识别位点(Kleinstiveretal., 2015)或是直接使Cas9蛋白变得更具有特异性(Slaymakeretal., 2016)。最近的研究显示,利用噬菌体辅助的连续进化(phage-assisted continuous evolution, PACE)方式得到一个SpCas9变体,即xCas9蛋白,可以识别广泛的PAM序列(包括NG,GAA和GAT),并且脱靶效应更低(Huetal., 2018)。这些发现扩大了CRISPR系统的DNA靶向范围以实现更高效的编辑。
基于dCas9蛋白开发的一系列遗传学工具具有各自的特点。dCas9是突变掉Cas9蛋白内切酶活性位点的DNA结合蛋白,不具有切割活性,只能结合DNA。dCas9蛋白结合在DNA上,可以直接影响RNA聚合酶的正常转录(Bikardetal., 2013)。对dCas9进一步改造并融合其他效应蛋白后可以实现对特定基因的CRISPR干扰(CRISPR interference, CRISPRi)或CRISPR激活(CRISPR activation, CRISPRa),以及对特定的染色质区域进行修饰(Brockenetal., 2017)。目前,这些dCas9相关技术已经在昆虫中得到应用,例如在果蝇体内开发了dCas9-VPR转录激活系统(Linetal., 2015; Ewen-Campenetal., 2017),最初需要两个sgRNA同时表达才能激活目的基因转录,增加了操作的复杂性和成本,随后,Jia等(2018)对其进行优化并得到了更为高效便捷的flySAM系统,即利用自剪切肽T2A将dCas9-VP64和MCP-p65-HSF1融合,并将该融合蛋白与sgRNA整合为一个载体,这样仅需一次遗传杂交,就可以激活一个甚至同时激活多个基因的表达,并且比VPR系统效率更高。
然而,随着CRISPR/Cas9系统被研究得越来越透彻,在系统优化过程中,边际效应也逐渐明显,因此利用各种手段直接寻找新型基因编辑工具也成为一大研究热点。例如Cas13a蛋白可以通过靶向RNA从而实现RNA编辑(Abudayyehetal., 2016),避免对生物基因组的破坏,对许多领域的研究具有非常广阔的应用前景。随着基因编辑技术研究手段的不断深入,相信越来越多CRISPR/Cas家族成员的功能将被揭示,这些新技术的发展对昆虫的基因功能、病虫害防治、经济性昆虫改良等方面的研究具有举足轻重的作用。

