1株传染性法氏囊病病毒的分离鉴定及VP2基因序列分析
何献铭,任广彩,叶俊贤,兰 虹,刘郁夫,2,熊 挺,杨泽坤,徐 婷,陈瑞爱,,
(1.华南农业大学兽医学院,广州 510642;2.岭南现代农业科学与技术广东省实验室肇庆分中心,肇庆 526238;3.肇庆大华农生物药品有限公司,肇庆 526238;4.华农(肇庆)生物产业技术研究院有限公司,肇庆 526238)
传染性法氏囊病(infectious bursal disease,IBD)是由传染性法氏囊病病毒(Infectious bursal disease virus,IBDV)引起的一种急性、高度接触性免疫抑制疾病,其临床症状表现为畏寒、精神沉郁、采食量减少、饮水增多、排出白色稀粪等;剖解病变表现为肾脏肿大出血、尿酸盐沉积、呈花斑状,腺胃与肌胃交界处出血,胸肌和腿肌出血,法氏囊萎缩出血、呈“紫葡萄”样[1]。长期免疫选择压力的作用导致IBDV变异株和超强毒株(vvIBDV)的出现,使之流行情况越来越复杂,防控越来越困难,造成重大经济损失[2]。
IBDV属双股RNA病毒科禽双RNA病毒属,其基因组由A、B 2个片段组成,编码VP1、VP2、VP3、VP4和VP5 5种病毒蛋白[3],其中A片段编码的VP2蛋白是主要的宿主保护性抗原,可诱导产生保护性中和抗体,并具有血清型特异性[4-5]。韩玉婷等[6]研究发现,IBDV各毒株间的变异主要集中在VP2区域的第206-350位氨基酸残基之间,被称为高变区(highlyvariableregion,HVR)。血清Ⅰ型IBDV根据毒力差异分为经典株(cIBDV)、超强毒株(vvIBDV)、致弱株(atvIBDV)和变异株(vIBDV)四大类[4]。cIBDV具有富含丝氨酸的七肽区(SWSASGS)及279D和284A 2个特征性氨基酸,它们决定了病毒的毒力;vvIBDV在保留cIBDV特征的基础上具有222A、256I、294I和299S 4个特征性氨基酸;而弱毒株则缺乏七肽区,且2个决定毒力的特征性氨基酸也发生了变化,即D279N和A284T[7]。本研究以从广西壮族自治区某养鸡场分离到的IBDV毒株为研究主体,RT-PCR扩增分离株的VP2基因序列,并进行测序和流行变异分析,最后再通过SPF鸡致病性试验研究该毒株的致病力,以期为IBDV的分子流行病学研究和临床防控措施提供参考。
1 材料与方法
1.1 材料
病料来源于广西某养殖场的法氏囊有出血及炎性渗出物等病变的病鸡。SPF鸡胚和SPF鸡均购自新兴大华农SPF实验动物中心。DF1细胞(编号:ATCC®43209TM)由华南农业大学兽医学院分子免疫实验室保存;IBDV标准抗原和标准阳性血清购自中国兽医药品监察所;4%多聚甲醛组织固定液购自Biosharp公司;TRIzol®Reagent(15596-026)购自Invitrogen公司;凝胶回收试剂盒购自Omega公司;无水乙醇、氯仿等生物化学试剂均购自浙江宁波萃英化学技术有限公司。
1.2 病毒分离与鉴定
1.2.1 病料处理 随机取法氏囊组织用研钵磨成匀浆后,加入1 mL灭菌生理盐水制成悬液,-80 ℃反复冻融3次,离心取上清液,经0.22 μm滤膜过滤除菌后按100 μL/枚经绒毛尿囊膜接种9 d 龄鸡胚。
1.2.2 IBDV PCR鉴定及其他外源病原体检测 收获鸡胚尿囊液,按照TRIzol®Reagent说明书提取病毒RNA,提取的RNA样品按照PrimeScriptTMRT MasterMix说明书反转录合成cDNA。 以cDNA为模板PCR鉴定IBDV,同时进行其他外源病原体检测,PCR产物进行1.2%琼脂糖凝胶电泳检测。检测的其他病原体包括DNA病毒传染性喉气管炎病毒(Infectious laryngotracheitis virus,ILTV)和鸡传染性贫血病毒(Chicken anemia virus,CIAV),RNA病毒传染性支气管炎病毒(Infectious bronchitis virus,IBV)、禽流感病毒(Avian influenza virus,AIV)、禽网状内皮组织增殖病毒(Reticuloendotheliosis virus,REV)、呼肠孤病毒(Reovirus,REOV)和新城疫病毒(Newcastle disease virus,NDV),还有鸡滑液囊支原体(Mycoplasmasynoviae,MS)和鸡毒支原体(Mycoplasmagallisepticum,MG)。引物序列信息见表1,引物均由生工生物工程(上海)股份有限公司合成。
1.2.3 琼脂扩散试验 用生理盐水配制含1.0%琼脂糖的溶液,加热溶化后倒入灭菌平皿中,冷却凝固。用打孔器在平皿上打孔,挑出孔内琼脂,酒精灯加热封底。以微量移液器吸取IBDV标准阳性血清加入中间孔,外周孔依次加入IBDV阳性抗原对照、PBS阴性对照及待检鸡胚尿囊液,37 ℃温箱中放置24 h后观察结果。

表1 引物信息
1.3 鸡胚传代培养与鸡胚半数感染量(EID50)测定
取法氏囊病料研磨液上清按100 μL/枚经尿囊腔接种5枚9日龄鸡胚,于37 ℃孵育,每12 h照蛋检查一次,弃去24 h内死亡的鸡胚。24 h后死亡的鸡胚在无菌条件下剖解,观察鸡胚有无病变。收集尿囊液,连续传代培养。收获第10代鸡胚尿囊液,用生理盐水将病毒作10倍倍比稀释,分别接种鸡胚,0.1 mL/胚,同时设正常对照,共6组,每组5胚。37 ℃孵育,鸡胚死亡后置于4 ℃冰箱过夜,收集尿囊液进行RT-PCR检测,同时观察鸡胚病变情况,根据Reed-Muench法计算分离病毒的EID50。
1.4 DF-1细胞的适应培养与细胞半数组织培养感染量(TCID50)的测定
将收获的第10代鸡胚尿囊液感染DF1细胞,观察72 h,若无明显细胞病变,则将细胞培养物-80 ℃反复冻融3次后,继续盲传。若出现细胞病变,则取DF-1细胞汇合度达60%且均匀贴壁的96孔板,按10-1至10-10倍比稀释病毒液,逐列加入96孔板中,并设置2列正常细胞作为对照,逐日观察5~7 d并记录结果,按Reed-Muench法计算分离病毒的TCID50。
1.5 分离株VP2基因序列测定与分析
取1.2.2获得的分离株VP2基因的PCR产物,采用凝胶回收试剂盒进行产物纯化。纯化后产物由生工生物工程(上海)股份有限公司进行DNA序列测定。采用MegAlign软件比对序列相似性。应用Mega 7.0软件以Neighbor-Joining法构建该分离株与其他参考毒株的VP2基因的遗传进化树,Bootstrap值重复1 000次。
1.6 SPF鸡致病性试验
1.6.1 动物回归试验 将20只8日龄SPF鸡随机分为2组:对照组和感染组,每组10只。感染组经点眼、滴鼻途径接种IBDV第10代鸡胚尿囊液,0.5 mL/只,对照组以同样途径接种等量生理盐水,隔离饲养。 定期观察2周,记录发病、死亡情况和剖检变化,并从发病鸡的组织器官中进行病毒分离。
1.6.2 法氏囊指数测定 对攻毒感染2周后未死亡的SPF鸡进行集体剖杀,并称量体重和法氏囊重量。囊重比=(法氏囊重/体重)×1 000。囊指数(BBIX)=试验组鸡囊重比/空白对照组鸡囊重比,当BBIX<0.7时,判为法氏囊萎缩;当BBIX>0.7时,判为法氏囊正常。采集各病变的组织器官包括法氏囊、胸腺、肝脏、肾脏,固定于4%多聚甲醛中,制备成石蜡切片后进行苏木精-伊红染色,在光学显微镜下观察病理组织学变化,并采集图片。
1.6.3 法氏囊病毒拷贝数测定 将40只8日龄 SPF 鸡随机分为2组:对照组和感染组,每组20只。攻毒方法同1.6.1。攻毒后分别在感染后1、5、8、14 d,每组随机剖杀5只,快速采集法氏囊,置于-80 ℃保存。按照1.2.1方法对法氏囊进行处理后,提取RNA、反转录获得cDNA。参照何秀苗等[8]方法对法氏囊中IBDV拷贝数进行定量检测。构建VP2基因标准质粒pMD18T-VP2,引物序列为:qPCR-VP2-F:5′-ACCGGCACCGACAACCT-TA-3′;qPCR-VP2-R:5′-CCCTGCCTGACCACC-ACTT-3′,建立基于IBDV-VP2基因的实时荧光定量RT-PCR标准曲线。
2 结 果
2.1 IBDV PCR鉴定结果及外源病原体检测
鸡胚尿囊液经PCR/RT-PCR 检测显示,可扩增出大小为714 bp的IBDV 特异性目的条带,且经检测ILTV、CIAV、IBV、AIV、REV、REOV、NDV、MS和MG均为阴性(图1)。

M,Trans2K DNA Marker;1,IBDV;2,A型AIV;3,H5亚型AIV;4,H9亚型AIV;5,IBV (740 bp);6,IBV(290 bp);7,NDV;8,REOV;9,REV;10,MS;11,MG;12,CIAV;13,ILTVM,Trans2K DNA Marker;1,IBDV;2,Avian influenza A virus;3,H5 subtype AIV;4,H9 subtype AIV;5,IBV (740 bp);6,IBV (290 bp);7,NDV;8,REOV;9,REV;10,MS;11,MG;12,CIAV;13,ILTV图1 病原体PCR/RT-PCR检测结果Fig.1 PCR/RT-PCR results of pathogens
2.2 琼脂扩散试验
琼脂扩散试验结果显示,IBDV抗原阳性对照、分离株感染鸡胚的尿囊液与抗IBDV阳性血清之间均形成一条明显的白色沉淀线,PBS阴性对照与IBDV阳性血清之间无沉淀线(图2)。
2.3 鸡胚传代培养与EID50测定
鸡胚接种病毒滤液上清,盲传3~4代后,可在48~36 h后致死鸡胚,死胚的尿囊膜增厚,膜上出现白色斑点,鸡胚出现出血、水肿、发育停滞;尤其头部和四肢末端出血严重,肝脏发黄、出现多处出血,有针尖状坏死。表明通过SPF鸡胚成功分离到1株IBDV毒株,命名为GX20210126。收获第10代尿囊液,测得鸡胚EID50为10-3.8/0.1 mL。
2.4 DF1细胞病变与TCID50测定
以第10代鸡胚尿囊液感染DF1细胞,24 h内即发生病变, 细胞圆缩、脱落、间隙变宽(图3), 同时测得病毒的TCID50为10-3.5/0.1 mL。

1,阳性对照;2,阴性对照;3、4,F10代鸡胚尿囊液;5,IBDV阳性血清1,Positive control;2,Negative control;3 and 4,F10 generation chicken embryo allantoic fluid;5,IBDV positive serum图2 病毒分离株琼脂扩散试验结果Fig.2 Agar diffusion test results of virus isolate
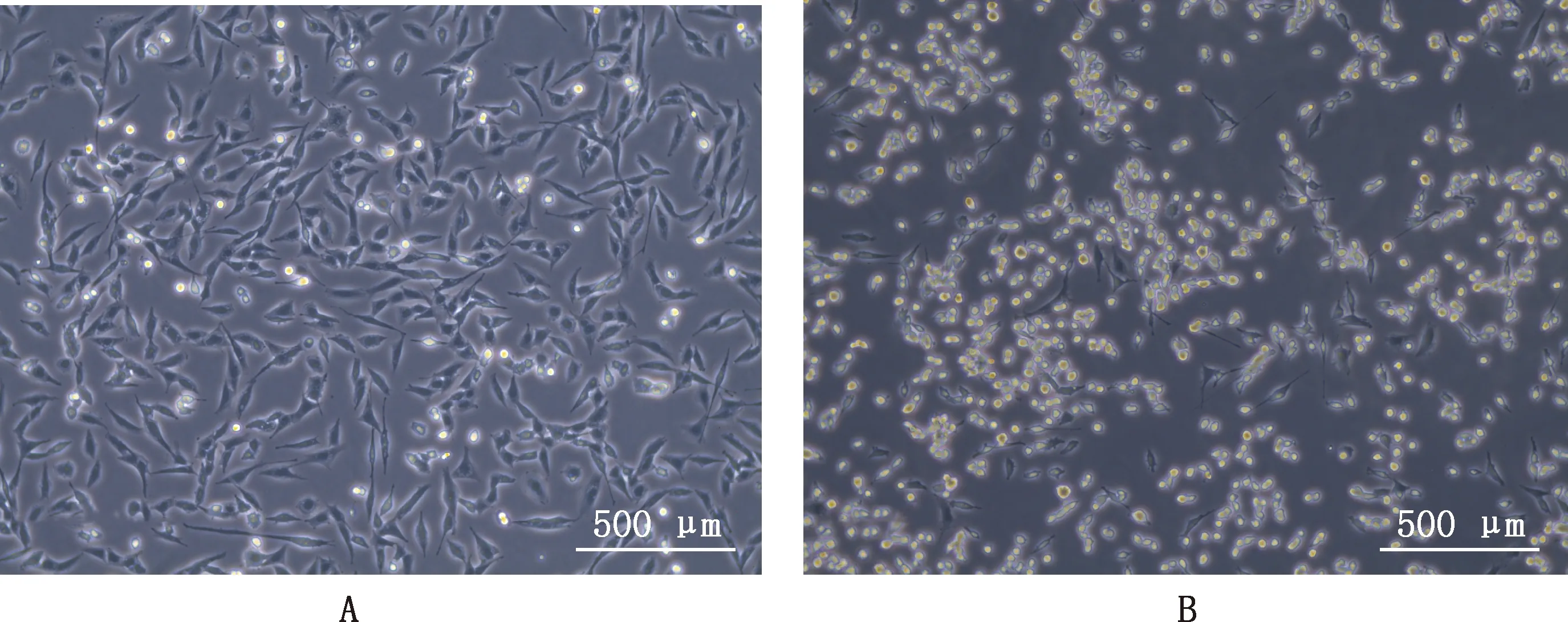
A,对照组;B,试验组A,Control group;B,Experimental group图3 感染IBDV后DF1细胞病变情况(100×)Fig.3 Cytopathic effect of DF1 cells after infection with IBDV (100×)
2.5 分离株VP2基因核苷酸和氨基酸序列测定及比对分析
2.5.1VP2基因核苷酸序列测定及比对分析 对分离株GX20210126的VP2基因进行序列测定,获得了其核苷酸序列(1 450 bp)。将获得的序列与国内外IBDV参考毒株进行比对分析,结果显示,相似性均在81.2%~98.8%之间。 GX20210126分离株与标准超强毒株UK661的相似性最高,为98.8%;与变异毒株、弱毒株的相似性则较低。根据GX20210126分离毒株序列分析可知,其含有SpeⅠ、TaqⅠ和SspⅠ位点,但无BstNⅠ、StyⅠ和SacⅠ位点,初步判断其含有IBDV强毒株特征,而非弱毒株和经典毒株。
2.5.2VP2基因推导的氨基酸序列及比对分析 根据测定的GX20210126株VP2基因核苷酸序列推导出其氨基酸序列并与参考毒株序列进行比对分析,结果发现,相似性均在86.8%~99.6%之间,GX20210126株与HK46、GX、OKYM、UK661、SD10LY01和HuB-1等标准超强毒株的相似性最高,为99.6%(图4)。
GX20210126分离毒株有七肽区。其vVP2内毒力相关位点的特征性氨基酸为222A、249Q、254G、256I、284A、294I、299S,符合vvIBDV的特征;而279N符合弱毒株特征。D279N与近年来国内IBDV毒株氨基酸位点进化趋势相一致,且符合广西IBDV进化地域特点。GX20210126分离株的VP2高变区特征氨基酸位点具体信息见表2。
2.5.3 遗传进化树分析 将GX20210126株与其他IBDV毒株VP2氨基酸序列构建遗传进化树,结果显示,GX20210126株偏向于vvIBDV毒株分支,与超强毒株亲缘关系最近,属于超强毒株进化谱系(图5)。

图4 GX20210126分离毒株与参考毒株VP2氨基酸序列相似性比对Fig.4 Similarity alignment of VP2 amino acid sequence between GX20210126 isolate and reference strains
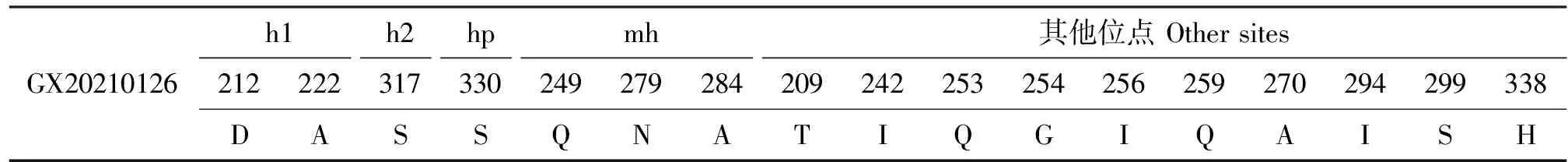
表2 vVP2特征氨基酸位点

图5 基于IBDV VP2氨基酸序列的遗传进化树Fig.5 Phylogenetic tree based on IBDV VP2 amino acid sequence
2.6 SPF鸡致病性试验
2.6.1 动物回归试验 将第10代鸡胚尿囊液以点眼滴鼻的途径接种8日龄SPF鸡,鸡群出现羽毛蓬松、精神萎靡、食欲减退或废绝、拉白绿色水样粪便等表观症状。观察2周后,未发现鸡死亡,剖检发现鸡的法氏囊萎缩,肾脏尿酸盐沉积,肝脏出血,胸肌和腿肌有片状出血或出血点。
2.6.2 法氏囊指数测定 由表3可知,BBIX为0.244。攻毒组鸡法氏囊严重萎缩,部分法氏囊有出血,成胶状样与对照组结果相比差异极显著,且可从发病鸡法氏囊中重新分离到IBDV。
2.6.3 病理组织学检查 感染组SPF鸡的法氏囊、胸腺、肝脏、肾脏出现了明显的病理变化。法氏囊滤泡萎缩变小,皮质变薄,皮髓质淋巴细胞大量减少,滤泡间质结缔组织增生,伴少量淋巴细胞浸润(图6A′);胸腺皮质含大量小淋巴细胞,髓质小范围见出血,髓质还见较多淋巴细胞损伤,核固缩深染(图6B′);肝脏血管及小叶内可见多处炎性细胞灶性浸润(图6C′);肾脏可见局部肾小管间质较多炎性细胞灶性浸润,较多肾小管上皮损伤,上皮细胞排列疏松,胞核固缩深染,胞浆嗜酸性增强(图6D′)。 对照组SPF鸡法氏囊、胸腺、肝脏、肾脏的组织结构正常,排列整齐,未见明显病理变化(图6A~6D)。
2.6.4 法氏囊病毒拷贝数测定结果 由图7可知,法氏囊中IBDV拷贝数在感染后第5天达到最高,为34 911拷贝/μL。

表3 IBDV攻毒后囊重比测定结果
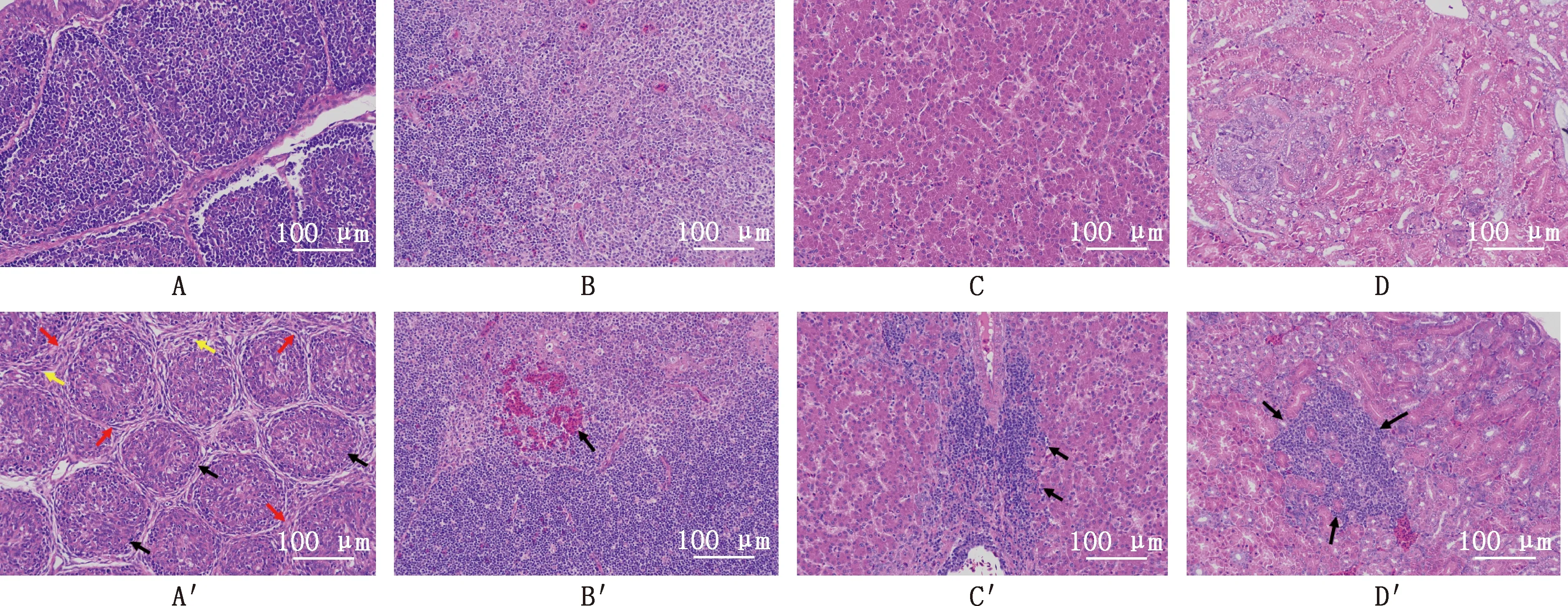
A~D,分别为对照组的法氏囊、胸腺、肝脏和肾脏;A′~D′,分别为感染组的法氏囊、胸腺、肝脏和肾脏A-D,Bursa,thymus,liver and kidney of control group,respectively;A′-D′,Bursa,thymus,liver and kidney of infection group,respectively图6 SPF鸡感染GX20210126株后的病理变化(HE,200×)Fig.6 Pathological changes of SPF chickens infected with GX20210126 strain (HE,200×)
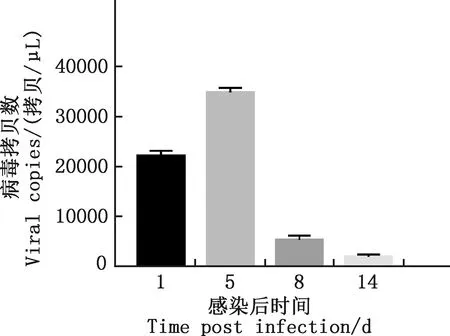
图7 法氏囊中IBDV拷贝数变化Fig.7 Change of IBDV copy number in bursa
3 讨 论
本研究对IBDV流行毒株进行分离鉴定、VP2基因序列分析及SPF鸡致病性试验。VP2基因核苷酸序列分析显示本研究分离株GX20210126与国际标准超强毒株UK661高度相似,核苷酸序列相似性为98.8%。目前,对于IBDV的关键毒力特征尚无明确定论。前人研究表明,IBDV经典毒株含BstNⅠ位点(CCWGG)和StyⅠ位点(CCWWGG),弱毒株无SpeⅠ位点(ACTAGT),强毒株含有TaqⅠ位点(TCGA)和SspⅠ位点(AATATT)[9-10]。本研究分离株GX20210126株含有SspⅠ和TaqⅠ酶切位点,且不具有经典毒株、弱毒株特征性酶切位点。一般认为IBDV的293-294位氨基酸突变具有分型意义,可根据SspⅠ(AATATT、NI)、SacⅠ (GAGCTC、EL)酶切位点来鉴定是否为vvIBDV。Juneja等[11]认同此观点,但Banda等[12]则不认同,因为有一些在临床上并不表现超强毒株症状的毒株却含有SspⅠ酶切位点。因此,GX20210126株是否属于超强毒株还需进一步证实。
VP2氨基酸序列分析显示,GX20210126株与国际标准超强毒株UK661亲缘关系较近,氨基酸较相似性为99.6%。本试验测得的GX20210126株氨基酸序列具备了vvIBDV VP2高变区中的以下几个特征:①GX20210126株高变区内2个大亲水区的氨基酸序列未发生改变,说明抗原性未发生变异。②GX20210126株249、253、254、256、284位氨基酸位点分别为Q、 Q、 G、 I、 A, 均符合超强毒株的特征,这些氨基酸位点联合作用影响病毒毒力[13]。③GX20210126株222、294和299位氨基酸位点分别为A、I和S,这3个氨基酸可使得超强毒株的亲和性发生变化,从而导致毒力大大增强[14-15]。祁小乐等[16]研究也表明,VP2的222位氨基酸对体外复制效率有影响。 ④GX20210126株具有七肽区(326-332位氨基酸残基)保守的326SWSASGS332序列,七肽区是否保守对毒力强弱的影响尚存争议。⑤沈巍巍等[2]研究表明,广西梧州地区氨基酸近年来的变化具有地域特点,如D279N和R338H,GX20210126株符合这个变化趋势。⑥GX20210126株与国际标准超强毒株UK661的VP2序列比对,仅有2处氨基酸位点发生改变,即D279N、I272T。其中D279N的变化位点位于小亲水区(mh),且被普遍认为与毒株毒力及细胞适应性有关[17-19],但其多与253、284等位点联合作用[20-21],单独位点的改变是否影响毒株特性仍有待进一步研究。I272T引起的生物学意义尚不清楚,需进一步探讨。
除此之外,本研究的毒力试验和动物试验证实了GX20210126株能使鸡群发生明显的感染症状和病变,法氏囊严重萎缩,发病率为100%,但未发生鸡死亡。其原因可能是病毒滴度较低(TCID50为10-3.5),272、279位氨基酸的改变,或B片段对IBDV毒力的影响,或其他原因造成的。综上所述,在VP2基因的核苷酸和氨基酸水平,该分离株的分子特征均偏向为超强毒株,但毒株毒力和发病模型建立仍需更多详细数据进行比较分析。
近年来,IBD免疫失败的现象不断增多,除了疫苗运输保存不当、疫苗接种不规范、免疫程序不合理等人为因素之外[22-23],IBDV变异和毒力增强可能是免疫无效的原因之一[24]。
4 结 论
本研究分离到的IBDV GX20210126株显示超强毒株的VP2基因序列特征,不属于经典毒株和变异株,与欧洲标准超强毒株UK661相似性最高,核苷酸序列相似性为98.8%,氨基酸序列相似性为99.6%,仅有D279N、I272T 2处氨基酸位点发生改变,这些位点的改变可能影响病毒毒力和细胞适应性,与中国IBDV毒株进化有关。

