激素受体状态对Her-2阳性乳腺癌新辅助化疗效果的影响
杨青中 吕艳丽 穆为民 李 毅
北京市顺义区妇幼保健院 北京儿童医院顺义妇儿医院乳腺中心,北京 101300
乳腺癌是女性常见的恶性肿瘤之一,据统计2020年其新增患病数达到226万,首次超越肺癌成为“全球第一大癌”[1]。Her-2阳性即Her-2基因有扩增或Her-2过表达,此类型乳腺癌约占所有类型乳腺癌的20%~25%,Her-2过表达常提示肿瘤分级高、增长快、侵袭性强、易发生全身转移,患者预后较差[2]。2017年的St.Gallen国际乳腺癌会议提出Ⅱ/Ⅲ期三阴性乳腺癌和Her-2阳性乳腺癌优先选择新辅助化疗[3]。新辅助化疗可以使肿瘤降期,提高手术切除率,增加保乳机会[4];新辅助化疗后若能达到病理完全缓解(pCR),可提高患者远期生存率[5]。有关激素受体(HR)状态与Her-2阳性乳腺癌新辅助化疗疗效相关性的报道显示HR阴性较阳性患者新辅助化疗后更容易达到pCR[6]。然而,在各种临床特征的亚组内部,HR状态对新辅助化疗效果的影响却鲜有报道。本研究回顾性分析141例Her-2阳性乳腺癌患者新辅助化疗的结局,旨在探讨HR状态在不同临床特征的亚组中对新辅助化疗效果的影响。
1 资料与方法
1.1 一般资料
本研究收集北京儿童医院顺义妇儿医院2011年1月至2018年12月接受新辅助化疗的141例Her-2阳性乳腺癌患者资料并进行回顾性分析。纳入标准:①患者治疗前均通过空芯针穿刺活检,明确病理诊断为浸润性导管癌。②肿瘤临床分期(TNM分期)Ⅰ、Ⅱ和Ⅲ期。③通过免疫组化(IHC)检测Her-2(+++)、Her-2(++)者通过荧光原位杂交(FISH)检测确定为Her-2基因有扩增[7];雌激素受体(ER)和孕激素受体(PR)免疫组化检测的阳性阈值≥1%,二者任何一项阳性即为HR阳性,二者均为阴性为HR阴性[8]。④接受新辅助化疗并签署知情同意书。排除标准:①未按预定计划完成新辅助治疗;②双乳腺癌;③合并其他恶性肿瘤;④既往曾有乳腺癌手术史;⑤男性乳腺癌;⑥新辅助化疗前曾接受过其他治疗。
1.2 方法
所有患者采用新辅助化疗方案:联合抗Her-2治疗者采用TCbH方案:多西他赛(江苏恒瑞医药股份有限公司,国药准字 H20020543,规格:20 mg/支)75 mg/m2,卡铂(齐鲁制药有限公司,国药准字H20020180,规格:100 mg/支)AUC6,曲妥珠单抗(Genentech Inc.,进口药品注册证号 S20181016,规格:440 mg/瓶)首剂8 mg/kg,之后6 mg/kg,第1天静脉滴注,每21天重复;未联合抗Her-2治疗者(患者拒绝使用)采用AT方案:多西他赛75 mg/m2,表柔比星[辉瑞制药(无锡)有限公司,国药准字 H20000496,规 格:10 mg/支 ]75 mg/m2,第1天静脉滴注,每21天重复。新辅助化疗前及每两周期治疗后均行动态增强MRI检查,依据RECIST(response evaluaition criteria in solid tumors)标准 1.1版[9]进行临床疗效评价。对连续两次评效稳定(SD)或一次评效进展(PD)的患者给予更改治疗方案。联合抗Her-2治疗者改为NH方案:长春瑞滨(江苏豪森药业集团有限公司,国药准字 H19990278,规格:10 mg/支)25 mg/m2,第1、8天静脉滴注,曲妥珠单抗2 mg/kg,第1、8、15天静脉滴注,每21天重复。未联合抗Her-2治疗者改为NP方案:长春瑞滨 25 mg/m2,第1、8天静脉滴注,卡铂AUC2 ,第1、8、15天静脉滴注,每21天重复。化疗总疗程6~8疗程。
新辅助化疗最末周期结束后2~3周行手术治疗。手术方式采用乳房全切术或保乳术,新辅助化疗前穿刺或前哨淋巴结活检存在腋窝淋巴结转移者需行腋窝淋巴结清扫术,前哨淋巴结活检为阴性者保留腋窝。
采用Miller-Payne病理评价系统对比新辅助化疗前穿刺标本与术后组织病理标本进行疗效评价[10]。定义pCR为乳腺内和腋窝淋巴结均无浸润性病灶(ypT0/isypN0)[11]。
1.3 观察指标及评价标准
以50岁为分界点,划分为老年组和年轻组两组;以肿瘤直径≤2 cm,> 2~5 cm和> 5 cm为分界点分为三组;以淋巴结阳性或阴性分为两组;以Ki-67的30%表达分数为分界点分为两组;以是否进行了抗Her-2治疗分为两组。分别在上述各种分组的亚组内部比较不同HR状态下pCR与非病理完全缓解(non-pCR)的构成比;比较总体病例不同HR状态下pCR与non-pCR的构成比。
1.4 统计学方法
采用SPSS 18.0统计学软件进行数据处理,分类变量描述其构成比,pCR与non-pCR两组临床病理指标比较采用两个独立样本的Pearsonχ2检验或Fisher确切概率法。以P< 0.05为差异有统计学意义。
2 结果
2.1 一般资料
入组病例均为Her-2阳性乳腺癌患者,共141例,患病年龄27~76岁,平均(51.69±9.99)岁。其中HR阳性(ER/PR阳性)85例,HR阴性56例;联合曲妥珠单抗新辅助化疗69例,未联合曲妥珠单抗患者72例;新辅助化疗后行保乳手术42例,行全乳房切除手术99例。入组患者的临床病理特征见表1。
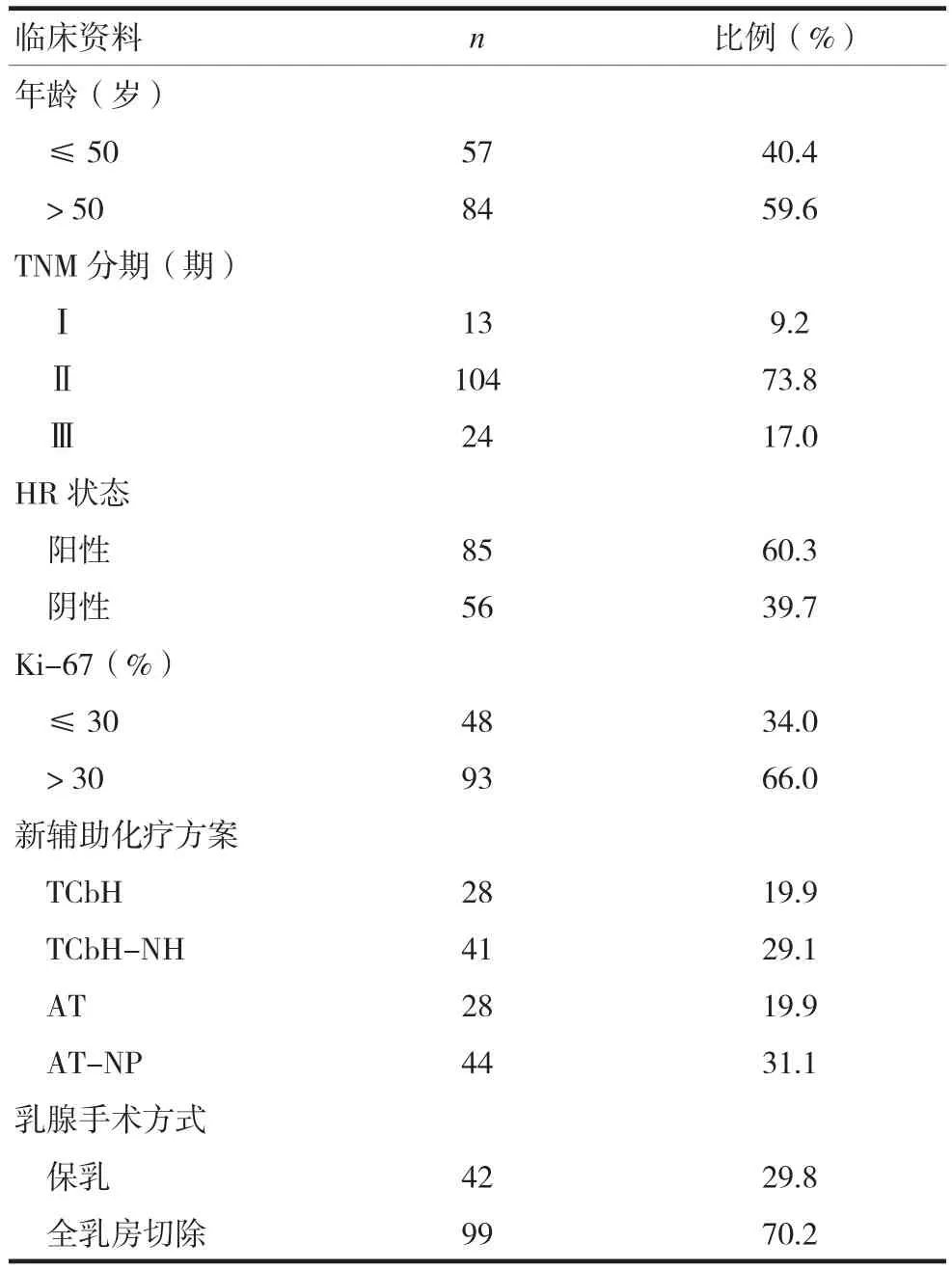
表1 入组患者的临床病理特征
2.2 HR状态在各亚组中的分布情况
总体上,HR阴性患者的比例为39.7%(56/141),HR阳 性 患 者 的 比 例 为 60.3%(85/141)。根据年龄、肿瘤T分期、LN情况、Ki-67指数、是否抗Her-2治疗将患者分成不同的亚组,每个亚组中HR状态分布情况见表2。根据年龄分成的两个亚组激素受体状态分布不同,>50岁组中HR阴性患者的比例较≤50岁组高,差异有统计学意义(P=0.017)。根据其他临床病理特征分成的亚组中HR状态分布的差异无统计学意义(P> 0.05)。

表2 HR状态在各亚组中的分布状况
2.3 HR状态在各亚组中对新辅助化疗效果的影响
入组141例Her-2阳性乳腺癌患者新辅助化疗后均可行疗效评价,总体pCR率为44.0%(62/141)。总体上,HR阴性的患者较HR阳性患者更容易在新辅助化疗后达到pCR(P=0.011)。亚组分析中,在年龄≤50岁、肿瘤 T分期≤ 2 cm、LN阴性、Ki-67≤30%、应用抗Her-2治疗的亚组,HR阴性的患者较HR阳性患者更容易在新辅助化疗后达到pCR(P=0.005、0.032、0.045、0.017、0.003)。见表3。
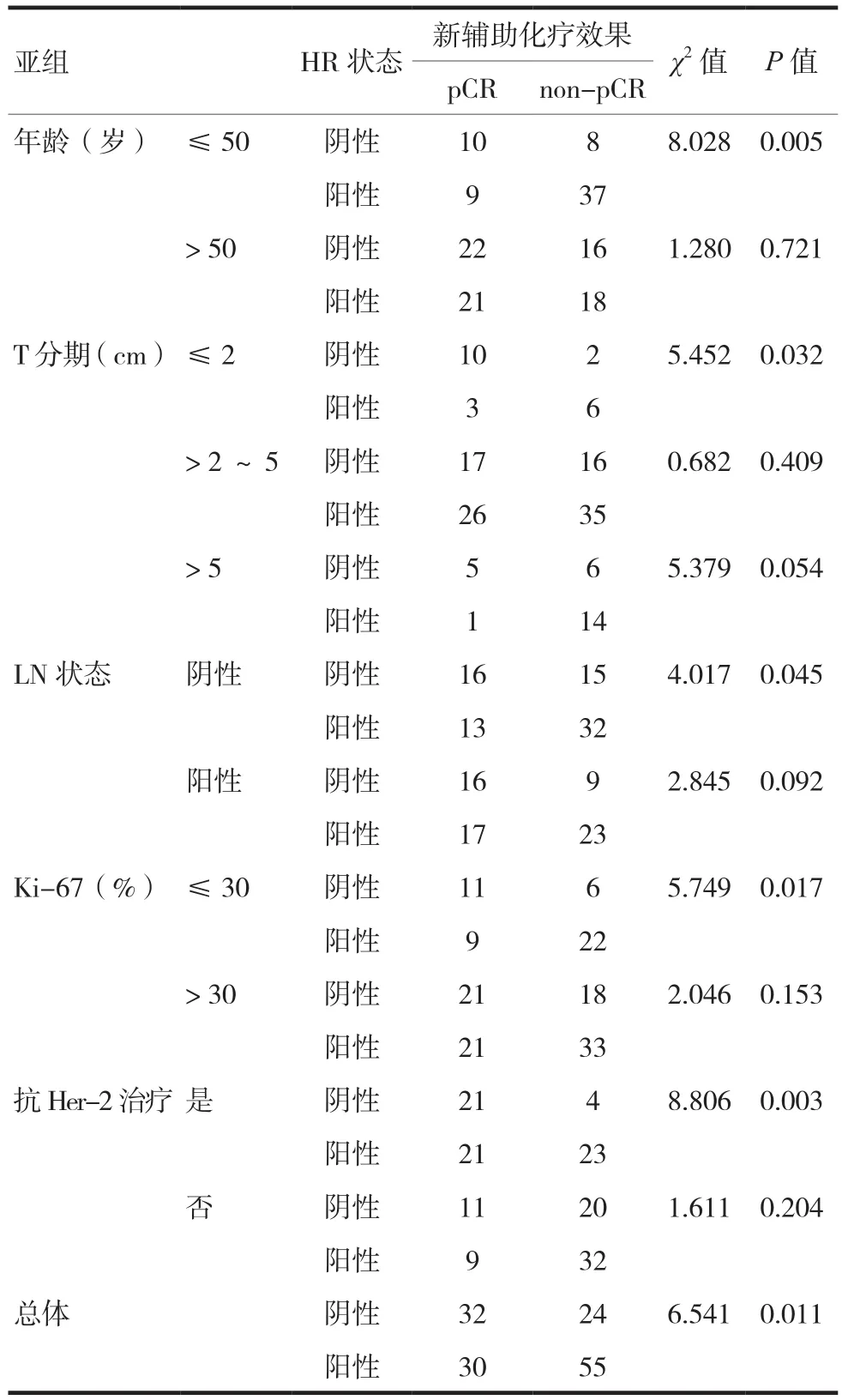
表3 HR状态在各亚组中对新辅助化疗效果的影响
3 讨论
Her-2阳性乳腺癌存在着临床及生物学异质性,不同患者从相同治疗中获益程度也不尽相同。HR状态的差异是影响新辅助化疗效果的一项重要因素。本研究结果总体显示Her-2阳性乳腺癌HR阴性较HR阳性患者更容易在新辅助化疗后达到pCR(P=0.011)。国内外很早就有关于HR状态与新辅助化疗疗效的相关性的研究报道,无论是单纯的细胞毒药物化疗[12-13],还是包含抗 Her-2靶向治疗[14],HR阴性的乳腺癌患者能在新辅助化疗后达到更高的临床缓解率。有关雌激素受体表达影响术前化疗效果的基础研究国内已有报道,浙江大学医学院附属邵逸夫医院课题组通过大量临床乳腺癌标本分析,证实乳腺癌患者肿瘤组织中ER表达情况与患者对多种术前化疗方案的敏感性密切相关;在国内外首次利用雌激素受体基因转染建立了同源性ER+/ER-乳腺癌细胞系,发现并证实雌激素受体能介导乳腺癌细胞对多种化疗药物耐药[15]。然而在各种临床特征的亚组内部,HR状态对新辅助化疗效果的影响却鲜有报道。
本研究分析了激素受体状态在不同亚组中的分布情况,结果发现相对于年长患者(> 50岁),年轻患者(≤50岁)中HR阳性比例偏高、HR阴性比例偏低。本研究认为与年轻患者体内雌激素水平较高、年长患者体内雌激素水平低有关。这与国外学者报道不同,Dutra等[16]在分析不同年龄组乳腺癌患者HR表达情况,发现年轻乳腺癌患者在雌激素受体及孕激素受体阳性表达较低,但随着年龄增加,乳腺癌雌激素受体阳性构成比呈增加趋势。
对于Her-2阳性乳腺癌的新辅助化疗,本研究显示总体上HR阴性的患者更容易获得pCR。然而在根据患者的临床病理特征分成的不同亚组中,并非所有亚组的HR阴性患者都具有这种优势。本研究中,只有在年龄≤50岁、肿瘤T分期≤2 cm、LN阴性、Ki-67≤30%、应用抗Her-2治疗的亚组,HR阴性的患者较HR阳性患者才更容易在新辅助化疗后达到pCR。
年龄亚组的统计显示只有≤50岁组HR阴性的患者较HR阳性患者在新辅助化疗后达到更高的pCR比例,且差异有统计学意义(P=0.017)。分析原因,年龄≤50岁的亚组中患者大部分为绝经前,体内雌激素水平较高,HR阳性患者在新辅助化疗中受到激素所致的不利影响较大,而HR阴性患者与之相反,因此获得相对较高的pCR率。
肿瘤T分期亚组的统计显示T≤2 cm的肿瘤,HR阴性的患者较HR阳性患者在新辅助化疗后达到更高的pCR率。从肿瘤负荷的角度分析,肿瘤分期越晚,肿瘤负荷越高,同样方案新辅助化疗后越难以达到pCR,这种情况下,HR阴性及阳性患者的pCR率普遍降低,如果个体化增加新辅助治疗的周期数,有可能大幅度提高患者尤其是高肿瘤负荷患者的pCR的比例。同样的情况也出现在LN状态分组、Ki-67分组中。
本研究发现在应用抗Her-2治疗的亚组中,HR阴性的患者较HR阳性患者在新辅助化疗后达到更高的pCR率(P=0.003)。这可能与HR阳性乳腺癌的激素受体介导曲妥珠单抗耐药机制有关[17]。在Her-2和ER均阳性的乳腺癌中,随着肿瘤细胞ER表达的增加,曲妥珠单抗的疗效逐渐降低,提示曲妥珠单抗耐药可能与Her-2和ER之间的相互作用以及激活新的信号通路有关[18-19],但具体机制尚不明确。
除了样本量少,本研究还存在其他不足之处,患者在行新辅助化疗后未重新检测HR状况。在后续研究中,在扩大样本量的同时,重新检测新辅助化疗后的ER及PR的表达情况,可能更有助于阐述HR状态对新辅助化疗效果影响的作用机制。
综上所述,本研究显示对于Her-2阳性乳腺癌,HR状态是影响新辅助化疗效果的重要因素,HR阴性的患者较HR阳性患者更容易在新辅助化疗后达到pCR,尤其是在肿瘤负荷低、同时应用抗Her-2治疗的年轻患者中,这种优势更明显,为指导临床个体化治疗提供参考。

