斑马鱼食源性肠炎模型及其免疫细胞成像分析方法的建立
黎 明 谢家元, 赵旭阳 李晓敏, 王 锐 单俊玮 程莹寅 张婉婷 吴 南, * 夏晓勤, *
(1. 大连海洋大学水产与生命学院, 大连 116023; 2. 中国科学院水生生物研究所, 武汉 430072; 3. 中国科学院大学现代农业科学学院, 北京 100049; 4. 武汉轻工大学动物科学与营养工程学院, 武汉 430000)
水产养殖是一个未来全球优质蛋白供应的重要途径, 鱼类的生长和健康直接影响到水产养殖的可持续发展, 然而食源性肠炎是引起鱼类疾病和生长抑制的重要限制性因素[1—3]。豆粕等植物蛋白源作为替代鱼粉的典型代表, 会引起鱼类豆粕诱导型肠炎(Soybean meal induced enteritis, SBMIE), 目前已在鱼虾中被报道[4,5]。由于目前水产养殖品种较为分散, 研究系统性不够, 导致目前还比较缺乏豆粕诱导型肠炎, 以及缺乏基于细胞层面研究肠黏膜免疫细胞对豆粕胁迫的应答机制。
斑马鱼(Danio rerio), 属于鲤科鱼类, 是水产模式动物, 可发生典型SBMIE[6,7]的症状, 已日渐引起水产养殖界的重视。国内外相关鱼类营养学、免疫学和肠道微生物学家[8,9]用斑马鱼来研究养殖鱼类食源性肠炎[8]。在斑马鱼的肠道免疫阶段发育过程中, 固有免疫细胞在受精卵出膜1d后就能被检测到[10,11], 而3周之后才出现比较成熟的适应性免疫细胞。这就为斑马鱼幼鱼用来分阶段研究肠道固有免疫和适应性免疫提供了可行性。最新的研究发现, 斑马鱼在SBMIE的早期阶段, 中性粒细胞和巨噬细胞参与炎症反应[12—14]。而在可自愈的草鱼SBMIE炎症平台期, 自身免疫相关的Th17反应为主[14],同时, B淋巴细胞也积极参与抗感染; 在自愈期, 调节性T细胞(Treg)反应为主, 同时天然免疫球蛋白IgM、IL10等抗炎因子也对于食源性肠炎的炎症恢复都起到重要作用[15]。在斑马鱼转基因品系方面,目前报道荧光标记的固有免疫细胞包括: 中性粒细胞品系Tg(yz:DsRED2)[16]、Tg(BACmpo:GFP)[8]、巨噬细胞有Tg(mpeg1:EGFP)[17]和Tg(coro1a:DsRed)[18];适应性免疫细胞包括: 淋巴细胞系细胞Tg(rag2:DsRed)[19]和T淋巴细胞Tg(lck:eEFP)[20]等, 这些转基因细胞标记品系, 被广泛地用来进行疾病建模的免疫效应分析[8,21]。因此, 采用转基因斑马鱼品系幼鱼, 在肠道固有免疫和适应性免疫各自的发育阶段, 进行成像分析SBMIE的免疫细胞学效应是可行的。
目前用斑马鱼幼鱼成像来进行肠炎研究, 还存在一些问题。一方面, 短期浸泡引起的全身黏膜反应可能会削弱肠道局部的免疫激活效应[22], 而浸泡引起的巨噬细胞反应主要集中在因吞咽而起作用的前肠[13,23], 而非食源性刺激的主要免疫反应部位——后肠; 另一方面, 现有的报道多为急性炎症反应(表现为固有免疫细胞的聚集), 而对肠黏膜免疫系统中适应性免疫细胞的研究相对缺乏; 此外, SBMIE的病理表型出现肠黏膜中隐窝深度变浅、固有层增宽等[1,6], 而目前斑马鱼幼鱼的仅有研究集中在幼鱼的分子水平[14,24], 缺乏SBMIE对肠道组织病理水平的探索。因此, 本研究通过运用荧光标记斑马鱼品系, 通过成像的方式, 在固有免疫发育阶段和适应性免疫发育阶段, 分别建立斑马鱼豆粕诱导的食源性肠炎模型, 揭示了中性粒细胞、巨噬细胞及淋巴细胞(包括未成熟的淋巴细胞和成熟的T淋巴细胞)在肠黏膜中对豆粕饲料的免疫应答机制, 旨在提供一种快速、可视化的水产动物的食源性肠炎模型及相关功能饲料添加剂的在体研发平台。
1 材料与方法
1.1 实验饲料
参照NRC(1993)的鱼类营养标准和Bravo-Tello等[7]的饲料配方, 实验以鱼粉(秘鲁进口鱼粉)和豆粕(膨化豆粕, 美国进口大豆)作为饲料蛋白源, 鱼油作为饲料脂肪源(表1), 建立豆粕诱导的食源性肠炎模型。实验以50%的豆粕蛋白添加量替代鱼粉蛋白添加量, 设计了两组不同的饲料, 每组含39%的粗蛋白及9%的脂肪, 其中微晶纤维素为填充剂, 维生素预混料和矿物盐预混料按1%的计量添加, FM表示非炎性饲料, 50SBM表示炎性饲料。在2 mm直径的双螺杆制粒机(广州华工光机电科技有限公司)中制成颗粒饲料, 并在55—60℃烘箱中烘干, 后用小型粉碎机进行粉碎, 先过60目分样筛,将过60目分样筛后的饲料再过80目分样筛, 留下80目分样筛上面的饲料, 放置在4℃冰箱分管保存待用。
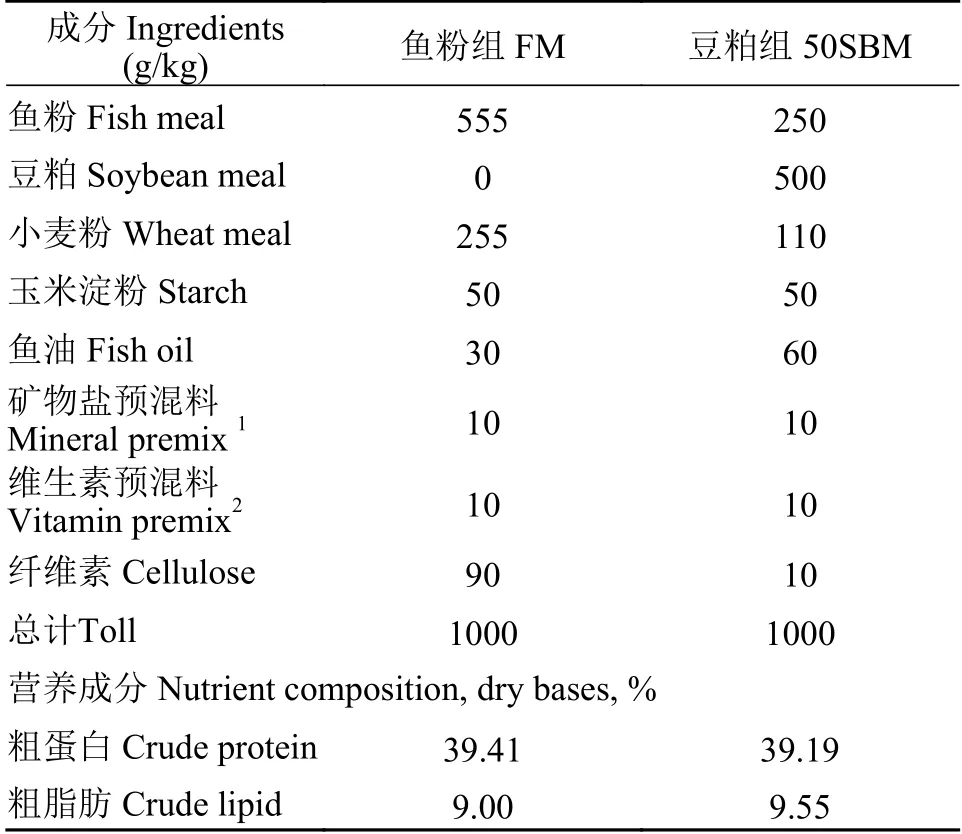
表1 斑马鱼SBMIE建模所用饲料配方Tab. 1 Feed formulations for zebrafish SBMIE modeling
1.2 实验鱼和养殖条件
本实验所用的Tg(lyz:DsRED2)nz50Tg、Tg(mpeg1:EGFP)ihb20Tg、Tg(lck:eGFP)cz2Tg和Tg(rag2:DsRed)zf411Tg四种转基因斑马鱼, 均购自国家斑马鱼资源中心(China Zebrafish Resource Center, http://zfish.cn/)。斑马鱼的饲养及繁育在中国科学院水生生物研究所水体生物信息课题组的斑马鱼室内循环水系统中进行, 养殖水温控制在(28±0.5)℃, 照明周期为光照14h, 黑暗10h, 斑马鱼养殖系统的环境为pH 6.8—8.0, 盐度0.25‰—0.50‰, 溶氧5—8 mg/L, 总氨氮<0.02 mg/L, 其他条件参考国家斑马鱼中心。
1.3 转基因纯合子筛选
从国家斑马鱼资源中心购回的4种荧光标记斑马鱼品系, 通过自交及与AB野生型斑马鱼侧交, 在产卵后孵化至17d后(17 dpf), 用MS-222工作液麻醉斑马鱼后在体式荧光显微镜(MZ10F, 德国Leica)下挑选荧光鱼及统计荧光鱼比例, 筛选出Tg(lyz:DsRED2)nz50Tg、Tg(mpeg1:EGFP)ihb20Tg、Tg(lck:eGFP)cz2Tg和Tg(rag2:DsRed)zf411Tg四种荧光鱼。将Tg(lyz:DsRED2)nz50Tg和Tg(mpeg1:EGFP)ihb20Tg品系杂交, 获得Tg(lyz:DsRED2);Tg(mpeg1:EGFP)双荧光标记品系, 用于固有免疫阶段的成像研究。
1.4 SBMIE建模策略及饲养
用含亚甲基蓝的0.3× Danieau’s solution(egg water, 受精卵培养液)[25]收集鱼卵, 将其放入分装至12 cm的玻璃培养皿中, 约100粒/皿左右, 放入光照培养箱[(28±1)℃, 光照14h, 黑暗10h]中孵化, 每天早晚换含亚甲基蓝的培养液2次, 并挑出死卵, 3d后(3 dpf)换成不含亚甲基蓝的培养液。孵化至5d后(5 dpf), 分装入直径150 mm的无菌培养皿中, 每50尾/皿, 实验分二组:鱼粉组(FM)和豆粕组(50SBM)。固有免疫细胞成像用鱼的饲养: 从6—9 dpf分别投喂FM或50SBM饲料共4d, 其中每天投喂3次(9:00—9:30、14:00—14:30、19:00—19:30), 投喂0.5h后换培养液; 适应性免疫细胞成像用鱼的饲养:从5—17 dpf投喂Larval AP100(美国Zeigler公司)的标准幼鱼饲料, 然后从18—27 dpf分别投喂FM或50SBM共10d, 后进行固定及荧光成像; 具体投喂策略如图1A所示, 成像区域如图1B所示。

图1 斑马鱼幼鱼豆粕诱导的肠炎建模策略 (AP100: 标准饲料, FM: 对照饲料, 50SBM: 炎性饲料)Fig. 1 Strategies for modeling enteritis induced by soybean meal in zebrafish (AP100: the basal diet, FM: the control diet, 50SBM: the inflammatory diet)
1.5 斑马鱼的活体固定及免疫细胞成像
用无菌水配置25×100 mL的MS-222储液(Tricaine Powder 400 mg, dd H2O 97.9 mL, 1 mol/L Tris-HCl, pH = 9.0, 2.1 mL), 过0.45 μm的滤膜(Milipore)除菌后放入4℃保存, 其工作液用dd H2O稀释到1×;用PBS溶液, 配置1%(w/v)的低熔点琼脂糖, 室温放置。取每个组饲养结束后的20尾左右的鱼苗用MS-222工作液麻醉, 后将麻醉好的鱼苗放入共聚焦培养小皿中, 用1%低熔点琼脂糖进行正侧面固定, 平行贴附于共聚焦小皿底部。用激光共聚焦显微镜(SP8, Leica, 德国)在10×镜下同时对红色荧光、绿色荧光和明场3个通道, 进行幼鱼肠道组织区域扫描成像。
1.6 苏木素-伊红染色(HE)
取相应不同组处理的27 dpf后的斑马鱼鱼苗,放入4%的多聚甲醛固定液中固定; 每个组取3条,进行脱水: 75%酒精处理4h, 85%酒精处理2h,90%酒精处理2h, 95%酒精处理1h, 无水乙醇Ⅰ处理30min, 无水乙醇Ⅱ处理30min; 脱水后放入乙醇∶甲苯(1∶1)5—10min, 二甲苯Ⅰ 5—10min, 二甲苯Ⅱ5—10min进行透明; 后续进行透蜡包埋, 用切片机进行斑马鱼后肠区域连续切片, 厚度为4 μm; 将切片依次放入二甲苯Ⅰ处理20min, 二甲苯Ⅱ处理20min, 无水乙醇Ⅰ处理5min, 无水乙醇Ⅱ处理5min, 75%酒精处理5min, 进行脱蜡; 然后按照苏木素-伊红染色试剂盒(碧云天)的说明书, 对切片进行苏木素-伊红染色。
1.7 RNA提取及荧光定量分析
饲喂FM或50SBM组饲料的斑马鱼, 在9 dpf (固有免疫分析)或27 dpf (适应性免疫分析), 取大约15尾/管, 用1 mL RNAlater®RNA Stabilization Solution试剂进行固定, 使用TRIzol法提取混合样品的RNA, 通过HiScript®II Q Select RT Super Mix for qPCR with gDNA wiper(R223-01)反转录成cDNA,并以此作为模板; 利用Hieff®qPCR SYBR®Green Master Mix (11202ES03/08/06)试剂在Bio-Rad CFX96TMReal-Time PCR仪上完成荧光定量PCR(qPCR), 荧光定量PCR采用20 μL反应体系: Hieff®qPCR SYBR®Green Master Mix 10 μL, Primer F(10 μmol/L) 0.4 μL, Primer R (10 μmol/L) 0.4 μL,cDNA 2.0 μL, H2O 7.2 μL; 荧光定量PCR反应条件采用两步法: 95℃ 5min, 95℃ 10s、60℃ 30s (40×)读板, 65—95℃ 绘制溶解曲线。检测基因的qPCR引物序列见表2。
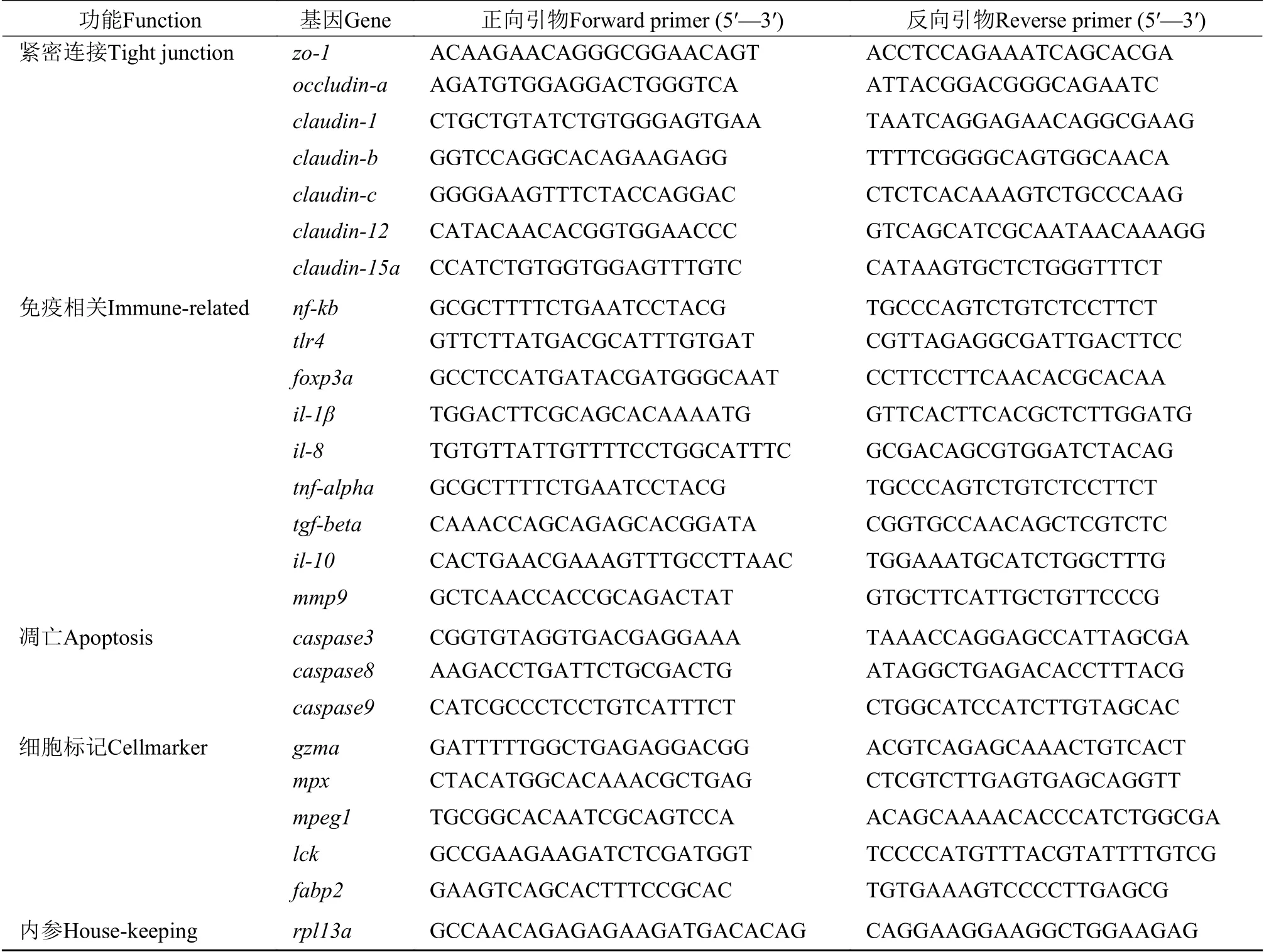
表2 实时荧光定量PCR引物序列Tab. 2 Primers used in quantitative real-time
1.8 数据处理及统计分析
幼鱼成像的显微镜照片用Leica Application Suite X(LAS X:3.4.2.18368)软件进行不同通道下的图片处理和荧光细胞数目统计, 细胞的统计参考Hedrera等[6]和Langenau等[20]的方法。随后用Graph Pad Prism 7.0软件进行数据分析; HE染色后的切片用多光谱成像显微切割系统(奥林巴斯荧光显微镜& PE)对其进行观察, 并用明场进行10×、40×镜下拍照采图, 后期用ImageJ (1.47v)进行处理。本实验中所有基因的表达水平以rpl13a为内参基因, 每个样本的平均Ct值与内参基因的平均Ct值进行归一化处理, 采用2-ΔΔCt法分析不同基因的表达相对于对照组的变化倍数, 用Graph Pad Prism 7.0软件进行数据可视化。实验所得数据用Graph Pad Prism 7.0软件进行单因素方差分析和非配对t检验, 所有的数据均用平均值±标准差的方式表示。
2 结果
2.1 采用固有免疫细胞荧光标记指示斑马鱼肠炎模型的建立
在肠道组织发育的固有免疫阶段过程中, 采用Tg(lyz:DsRED2);Tg(mpeg1:EGFP)的转基因斑马鱼品系建立食源性肠炎模型(图2)。在9 dpf, 对中性粒细胞而言, 50%豆粕替代鱼粉使细胞均出现椭圆形、突触型的两种细胞形态(图2B′和图2F′), 细胞位置呈随机分布于中后肠(图2B和图2F); 巨噬细胞的形态在50%豆粕替代鱼粉后出现较多类似细胞突触形态(图2C′和图2G′)且随机分布于中后肠区域(图2C和图2G)。在5 dpf和9 dpf 两个时期, 对FM组和50SBM组荧光标记的细胞在中后肠区域出现的信号(图2-3I/J的红色框)进行了数量统计, 与FM组相比, 发现50SBM组中肠道中性粒细胞和巨噬细胞出现更多的聚集, 并且数量出现差异极显著(分别为P=0.005、P<0.001)。

图2 豆粕替代鱼粉对先天免疫细胞的影响Fig. 2 Effects of fishmeal substitution by soybean meal on innate immune cells
2.2 豆粕替代鱼粉对固有免疫阶段中相关基因mRNA表达的影响
在固有免疫阶段中, 对肠道急性炎症相关的基因进行qPCR检测(图3)。与FM组相比, 50%豆粕替代鱼粉后会使肠道il-1β、il-8和tnf-alpha基因表达上调, 其中il-1β和tnf-alpha基因具有差异显著(P<0.05); 同时, 核转录因子nf-kb基因的表达水平也显著上调(P<0.05; 图3A)。此外, 对参与固有免疫阶段中主要细胞的标记基因进行了qPCR检测。结果表明, 与FM组相比, 50%豆粕替代鱼粉后会使自然杀伤细胞的标记基因gzma(granzyme a,gzma)、中性粒细胞的标记基因mpx(myeloid-specific peroxidase, mpx)、巨噬细胞的标记基因mpeg1(macrophage expressed gene 1, mpeg1)显著上调(P<0.05)。
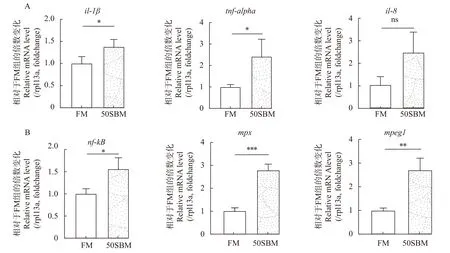
图3 豆粕替代鱼粉对固有免疫阶段中相关基因mRNA表达水平的影响Fig. 3 Effects of fishmeal substitution with soybean meal on mRNA expression levels of related genes in innate immune stage (Relative fold to FM group)
2.3 采用适应性免疫细胞荧光标记指示斑马鱼肠炎模型的建立
在肠道组织发育的适应性免疫阶段过程中, 采用Tg (rag2:DsRed)的荧光标记品系建立食源性肠炎模型(图4), 通道下红色指示的是rag2+淋巴细胞系。在17 dpf, 投喂基础饲料AP100后, 中后肠区域出现了rag2+淋巴细胞, 细胞形态大多呈椭圆形(图4B′)。在27 dpf, 一方面, FM组和50SBM组中都有相应rag2+的淋巴细胞出现, FM组中的细胞形态大部分呈现圆形(图4E′), 而在饲喂豆粕后,rag2+的淋巴细胞中有较多细胞呈现不规则的突触形(图4H′);另一方面, 对斑马鱼中后肠区域出现rag2+的淋巴细胞系数量进行定量统计分析发现(图4M), 与FM组相比, 豆粕饲料组的肠道区域中出现了更多rag2+红色荧光标记细胞的聚集, 且差异极显著(P<0.001)。
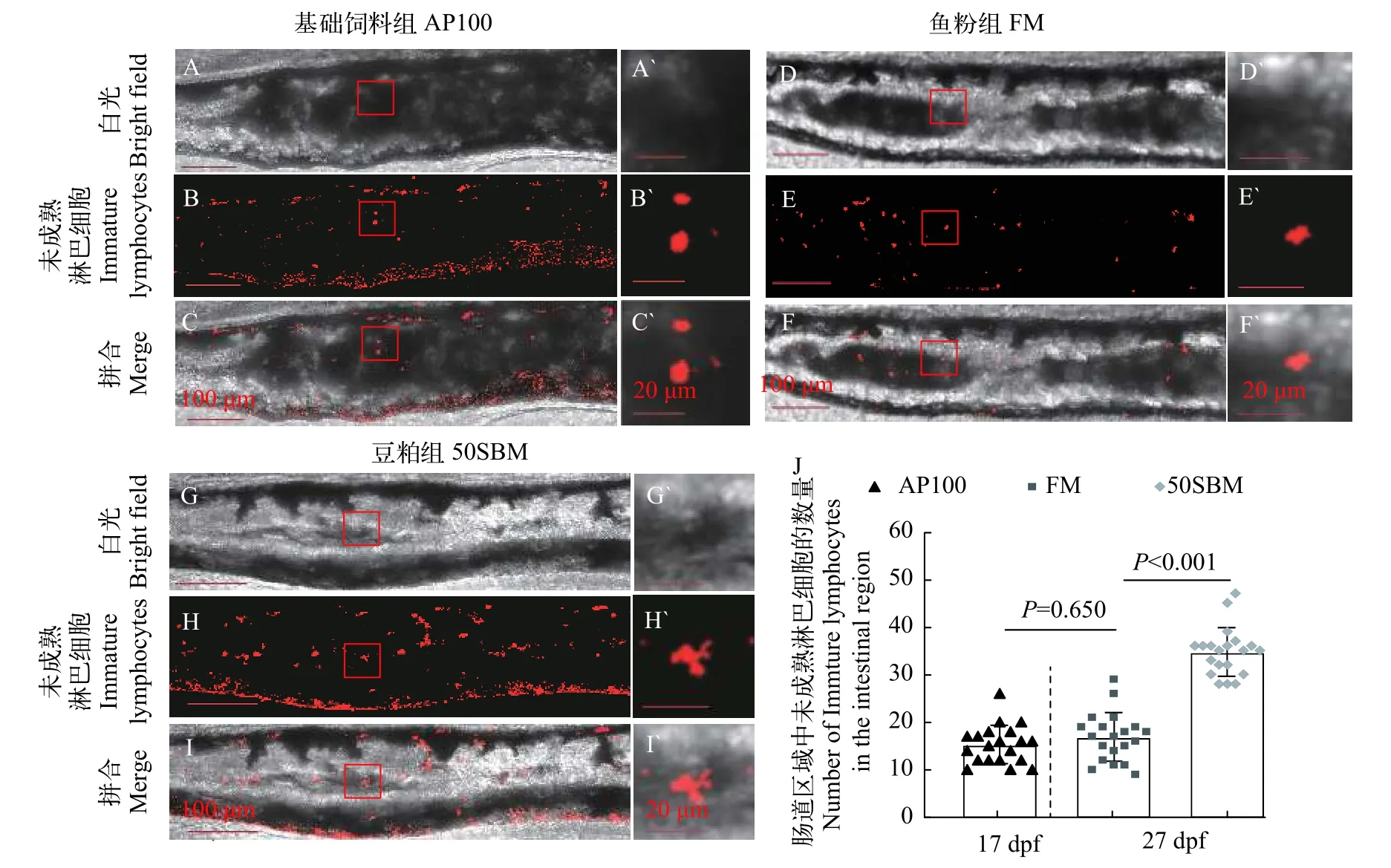
图4 豆粕替代鱼粉对肠道未成熟淋巴细胞的影响Fig. 4 Effects of fishmeal substitution with soybcan meal on immature lymphocytes in intestine
为了进一步研究T淋巴细胞在食源性肠炎过程中的细胞行为, 采用Tg (lck:lck-eGFP)荧光标记的斑马鱼品系在适应性免疫阶段进行食源性肠炎模型的构建(图5), 通道下绿色标记的是T淋巴细胞(图5B和5E)。在27 dpf时期, FM组和50SBM组的肠道中都出现绿色荧光标记的lck+淋巴细胞, 且细胞形态都呈不规则的突触形, 两组之间的细胞形态没有明显的差异(图5B′和5E′); 之后通过对肠道区域出现绿色荧光标记的lck+淋巴细胞进行定量的统计分析(图5G), 研究发现, 豆粕替代鱼粉能显著地引起T淋巴细胞在肠道区域的聚集(P<0.0001)。

图5 豆粕替代鱼粉对肠道成熟T淋巴细胞的影响Fig. 5 Effects of fishmeal substitution with soybean meal on mature T lymphocytes in intestine
2.4 食源性肠炎幼鱼模型的建立对适应性免疫阶段中肠道形态的影响
为了在病理水平观察SBMIE模型的建立对肠道组织形态的影响, 在27 dpf, 取FM组和50SBM组做肠道组织的石蜡切片并进行了HE染色(图6)。FM组肠道形态较为完整, 有比较明显的肠道绒毛高度(HVI)和隐窝深度, 固有层(LP)有一定的厚度,随着50%豆粕替代鱼粉后, 50SBM组后肠黏膜褶皱程度降低, 隐窝深度变浅, 固有层逐渐消失, 肠上皮细胞核的位置出现紊乱, 肠上皮层的杯状细胞(GC,HE染色后表现为上皮层的空泡)数量减少。对FM、50SBM组后肠组织中的肠绒毛高度进行统计, 结果表明, 与FM组相比, 50SBM组的肠绒毛高度极显著变短(P= 0.002)。
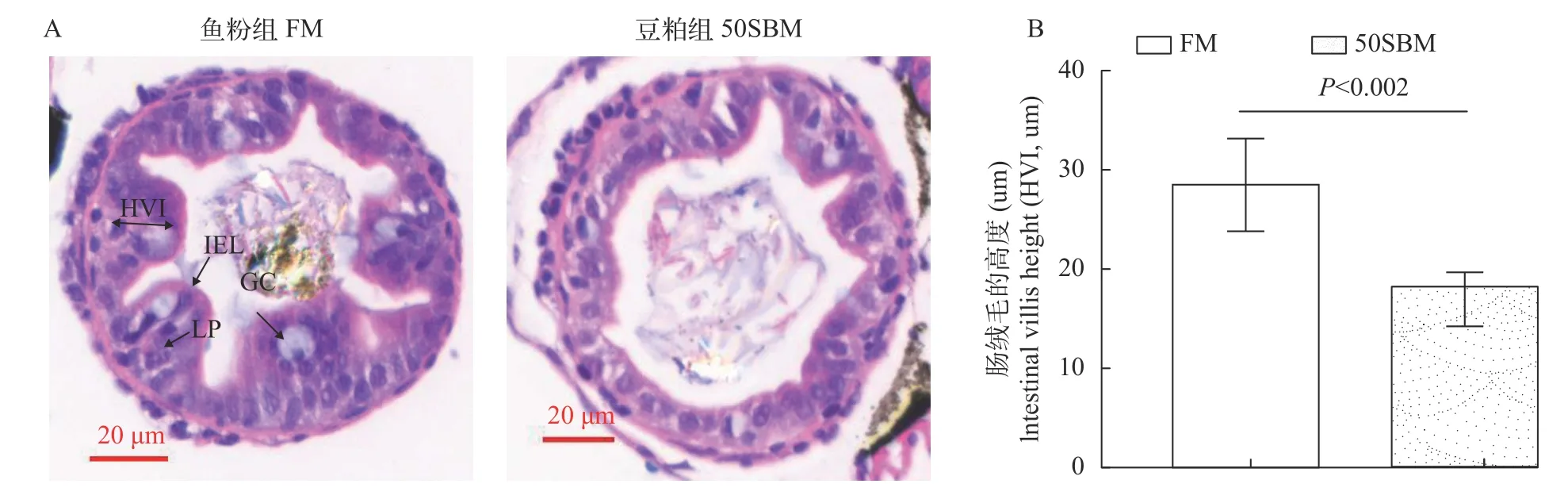
图6 豆粕替代鱼粉对斑马鱼幼鱼肠道形态的影响Fig. 6 Effects of fishmeal substitution with soybean meal on intestinal morphology of juvenile zebrafish
2.5 斑马鱼肠炎模型的建立对适应性免疫阶段中相关基因mRNA表达的影响
探究食源性肠炎模型对肠道肠黏膜屏障的影响, 我们对肠黏膜物理屏障相关基因的mRNA表达水平进行了qPCR检测, 其中包括肠道上皮紧密连接、凋亡相关基因的表达情况(图7A和7B)。一方面, 与FM相比, 50SBM组中紧密连接相关的zo-1、claudin b和claudin c均差异显著性上调表达(P<0.05), 而claudin 15a差异极显著下调表达(P<0.01),此外, 紧密连接相关的ocludin-a、claudin 1和claudin12也表达上调, 但都不具有统计学上的显著性差异(图7A)。另一方面, 我们还对引起肠道凋亡相关基因进行了检测, 与FM相比, 50SBM组中caspase 3和caspase8均表达上调, 其中caspase3上调表达具有显著性差异(P<0.05),caspase8无统计学上的显著差异; 此外, 我们进一步对肠道增殖标记基因检测, 肠道上皮细胞的标记基因fabp2(fatty acid-binding protein 2, fabp2)表达显著上调(P<0.05,图7E)。
在肠炎过程中, 肠道免疫屏障发挥了重要的调节功能。随后对肠黏膜免疫屏障相关基因表达进行了qPCR检测, 其中包括促炎/抑炎细胞因子、核转录因子和免疫细胞的标记maker基因的表达情况。与FM组相比, 50%豆粕替代鱼粉会使肠道促炎细胞因子il-1β、il-8和tnf-alpha, 抗炎细胞因子tgf-beta、il-10和mmp9, 炎症相关的核转录因子nfkb和免疫调节的核转录因子foxp3a及肠炎相关的tlr4均上调表达, 除il-8、tnf-alpha和tlr4无统计学上的差异显著外, 其余均具有显著性差异上调(P<0.05; 图7C和7D)。此外, 我们进一步对食源性肠炎过程中细胞的标记基因进行了检测, 结果表明gzma(granzyme a, gzma)、mpx、mpeg1和T淋巴细胞的标记基因lck(T cell-specific tyrosine kinase, lck)均显著上调表达(P< 0.05, 图7E)。

图7 豆粕替代鱼粉对适应性免疫阶段中相关基因mRNA表达的影响Fig. 7 Effects of fishmeal substitution with soybean meal on mRNA expression levels of related genes in adaptive immune stage
3 讨论
本研究针对水产养殖中常见的食源性肠炎, 采用在遗传学上已荧光标记免疫细胞的斑马鱼品系,建立了斑马鱼SBMIE幼鱼模型, 分别对固有免疫和适应性免疫细胞进行了成像和分子机理的分析。结果表明, 斑马鱼幼鱼即可发生类似成鱼的肠黏膜免疫调控来应对食源性肠炎的细胞学现象, 可对应到斑马鱼肠道免疫的发育的阶段性, 即在胚胎孵化3周之前, 肠道开始拥有固有免疫(Innate immunity),是机体肠道抵抗外源微生物入侵的第一道防线;3周之后开始出现比较成熟的适应性免疫(Adaptive immunity), 与固有性免疫一起构成较完整的肠黏膜免疫系统[10,11,26], 这一特点为斑马鱼用来分阶段研究肠道固有免疫和适应性免疫提供了便利。同时,斑马鱼又存在不同免疫细胞标记品系[16,17,19,20], 为探索SBMIE过程中免疫细胞的动态变化存在可能。
作为水产疾病的模型, 目前建立的斑马鱼幼鱼SBMIE模型, 很好地模拟了经济鱼SBMIE中肠黏膜屏障受到了破坏。对鱼类SBMIE的损伤机理研究表明, 抗营养因子, 主要为大豆蛋白7s和11S, 能够引起鱼类肠道强烈的过敏性炎症[28—30], 作为Th17细胞过敏反应的典型细胞因子IL17在草鱼SBMIE中是上调表达的, 是引起肠黏膜炎症的内因[15]。以上的诱因引起肠上皮中LP层肿胀及淋巴细胞浸润、隐窝变浅和分泌细胞减少, 因而最终表现为肠绒毛的结构发生萎缩。在对食源性肠炎研究最多的大西洋鲑(Salmo salar)中, SBMIE会造成肠固有层增宽、肠上皮层出现淋巴细胞浸润、后肠黏膜上皮层可以吸收的空泡排列紊乱[27]。与之类似的是, 我们的HE染色结果中与鱼粉组相比, 50%的豆粕替代鱼粉也会造成肠道绒毛褶皱高度显著降低,固有层增宽到与黏膜肌层平行, 肠上皮细胞核的位置出现紊乱, 杯状细胞数量减少, 隐窝深度的相对较浅并逐渐消失等肠黏膜屏障损伤的病理表现。这也和大菱鲆(Scophthalmus maximus)[31]、龙胆石斑鱼(Epinephelus lanceolatus)[32]和建鲤(Cyprinus carpio var.Jian)[33]等鱼类中豆粕替代鱼粉所造成的肠组织损伤结果呼应。
肠黏膜上皮细胞组成紧密连接形成黏膜的物理屏障, 紧密连接相关基因中, ZO-1通过连接肌动蛋白actin为紧密连接提供支撑, 并可以提供细胞内的信号传递; Ocludin和Claudins处于肠上皮细胞壁上, 直接调节细间距离, 对于通透性很重要[34]。在众多Claudin中, Claudin 1和Claudin c都是普遍表达在肠上皮细胞膜上的; Claudin b特异表达在隐窝的细胞膜上; 而Claudin 12和Claudin 15表达在肠上皮靠外的细胞膜顶端[35]。目前豆粕组的紧密连接基因表达分析结果表明, 大多数基因, 包括zo-1、claudin 1、claudin b和claudin c表达上调, 表明50%的豆粕替代鱼粉会干扰发育期幼鱼的中后肠上皮的紧密连接基因的表达, 这与HE染色结果中27 dpf幼鱼肠道切片中肠上皮组织损伤相呼应, 可能与豆粕诱导养殖鱼类肠道物理屏障损伤有一定的关系。而claudin15a在豆粕组的下调表达暗示肠内的钠离子回收功能降低[36]。在肠炎过程中, 肠上皮细胞不仅可以通过产生细胞因子(IL-7、IL-8等)来招募免疫细胞[37], 而且还会通过加快细胞凋亡[38]。在目前的结果中, 50SBM组凋亡相关基因表达水平上调, 前期研究发现豆粕中的大豆球蛋白等抗营养因子可引起Caco-2细胞死亡[39], 都表明豆粕替代50%的鱼粉会加速肠黏膜细胞凋亡, 同时肠上皮成熟基因fabp2也表达上调, 以上结果暗示了豆粕组肠道上皮层是在更加快速地进行更迭。
在植物性蛋白源引发的肠炎过程中, 肠黏膜免疫系统起到关键性的作用, 而目前在经济鱼中, 对SBMIE涉及的免疫细胞的应答研究还比较零散, 且大量集中在免疫细胞产生的细胞因子方面。在斑马鱼肠道炎症期间, 固有免疫细胞和适应性免疫细胞扮演重要角色, 其中包括巨噬细胞、中性粒细胞和T淋巴细胞等[8], 这些都是SBMIE过程中参与炎症反应的免疫细胞[14]。因而, 本研究系统对固有免疫细胞和适应性免疫细胞在SBMIE中的应答进行了分析, 并对细胞因子进行了探讨。具体来说, 一方面, 在肠黏膜固有免疫细胞中, 参与SBMIE免疫应答的主要为中性粒细胞和巨噬细胞[40]。因而本研究运用中性粒细胞和巨噬细胞的双标品系Tg(lyz:DsRED2);Tg(mpeg1:EGFP)来建立固有免疫阶段SBMIE模型可更加实时和综合定量固有免疫细胞的反应性, 研究发现两类细胞都显著增加, 但仅巨噬细胞的形态会改变, 暗示斑马鱼可在肠黏膜中招募固有免疫细胞[12,41]并改变细胞形态来应对急性炎症, 其中巨噬细胞免疫突触的形成可能暗示免疫状态改变, 即M0型向M1(TNF-alpha+标记, 促炎, 产生TNF-alpha)或M2(抑炎, TNF-alpha-)型功能转变[42]。高豆粕饲料投喂引起的中性粒细胞在肠道区域的招募, 这与斑马鱼中化学试剂诱导肠炎[43—45]和高豆粕饲料对斑马鱼肠巨噬细胞的影响相似[14]。同时, qPCR发现中性粒细胞标记基因—mpx和巨噬细胞的标记基因—mpeg1均表达上调, 进一步暗示了中性粒细胞和巨噬细胞参与了豆粕引起的急性炎症。此外, 从炎性细胞因子角度来看, 饲喂高豆粕饲料使il-1β、il-8、tnf-alpha及核转录因子nfkb上调表达, 说明50%的豆粕替代鱼粉引起了急性炎症反应不仅增加固有免疫细胞, 而且还会产生急性炎症细胞因子。以上结果表明, 在固有免疫发育阶段, 采用Tg(lyz:DsRED2);Tg(mpeg1:EGFP)的双荧光标品系进行斑马鱼食源性肠炎模型的构建可显示食源性肠炎的急性炎症反应过程。
另一方面, 从适应性免疫来说, 适应性免疫细胞在肠炎发生和自愈过程中参与了重要的调控作用[14,15]。核基因重组激活基因2(Recombination activating gene 2,rag2), 是编码参与V(D)J重组免疫球蛋白和T细胞受体基因的重组酶的组成部分, 是淋巴细胞发育不可或缺的重要因子, 仅在未成熟的T/B淋巴细胞中共同表达[19]; T细胞特异性酪氨酸激酶(T cell-specific tyrosine kinase, lck), 在成熟的T淋巴细胞和未成熟的T淋巴中均有表达[20]。通过Tg(rag2:DsRed)和Tg(lck:lck-eGFP)两种单荧光标记的斑马鱼幼鱼, 在适应性免疫阶段构建SBMIE模型, 本研究发现高豆粕投喂能引起肠道区域rag2+淋巴细胞和lck+淋巴细胞显著增加且lck+淋巴细胞数量高于rag2+淋巴细胞, 这一结果表明未成熟的T/B淋巴细胞和成熟的T淋巴细胞可能均参与了肠炎, 暗示SBMIE过程中与成熟的T淋巴细胞在肠道中的聚集有关。此外在饲喂豆粕饲料后,rag2+淋巴细胞出现了较多突触型的细胞形态, 而豆粕替代鱼粉与否对lck+淋巴细胞形态没有太大的差异,表明肠炎过程中未成熟的淋巴细胞可能通过改变形态来发挥功能; 而成熟的T淋巴细胞对投喂的饲料具有类似的反应, 可能通过增加数量来应对肠炎。这与Coronado等[14]在斑马鱼肠炎中研究的结果相类似。
从炎症因子的角度, SBMIE引起肠黏膜免疫的改变表现在LP层免疫细胞产生大量的促炎核转录因子(如NF-kb)、促炎细胞因子(IL-1β、IL-8和TNF-alpha等)[46], 同时机体通过促进免疫细胞分化(如CD4+T细胞向Th1、Th2、Th17和Treg类群)[47]和分泌抗炎细胞因子(TGF-β和IL-10等)[39]来缓解肠炎。如在大西洋鲑SBMIE中,il-17a、il-1β、ifnα、ifnγ、tcrγ、cd4α、cd8β和tgf-β等表达均上调[48]。与FM组相比, 本研究发现, 50%的豆粕替代鱼粉会使促炎细胞因子基因il-1β、il-8和tnf-alpha, 抗炎细胞因子基因tgf-β、il-10和mmp9, 炎症相关转录因子基因nf-kb和foxp3a, 此外还有肠炎相关受体基因tlr4的mRNA水平均表达上调, 说明50%的豆粕替代鱼粉会造成肠道炎症因子的表达, 引发肠炎; 而机体通过提高抗炎细胞因子基因(tgf-β和il-10等)及免疫调节相关的核转录因子基因foxp3a的表达, 来应对豆粕引发的肠炎, 促进炎症的缓解, 维持肠道免疫屏障稳定。以上表明, 在适应性免疫发育阶段, 采用Tg(rag2:DsRed)和Tg(lck:lck-eGFP)两种单荧光标品系进行斑马鱼食源性肠炎模型的构建, 可指示适应性免疫细胞参与肠炎的免疫效应。
综上所述, 采用饲料投喂的策略设计和斑马鱼免疫细胞荧光搭配成像的方式, 有效地模拟了水产养殖常见的食源性肠炎, 能够可视化呈现出各类免疫细胞在急性炎症和慢性炎症各阶段的细胞行为及动态变化, 并可在分子病理水平对炎症进行快速评价。本研究为水产动物的食源性肠炎提供了一个周期短、成本低、直观的分析模型, 将来可在此基础上进行功能饲料添加剂的研发。
致谢:
感谢国家斑马鱼资源中心的潘鲁媛高级工程师指导斑马鱼养殖, 中国水产科学研究院长江水产研究所蒋明副研究员帮助制作斑马鱼SBMIE建模饲料, 华中农业大学水产学院刘静霞教授指导幼鱼成像分析实验, 中国科学院水生生物研究所分析测实中心王光欣和周芳工程师协助共聚焦显微镜成像实验。

