氮化碳的制备及其缺陷调控材料综合教学实验设计
*李鑫奥 刘军民
(中山大学 材料科学与工程学院 广东 510006)
光催化的原理是利用光来照射半导体,当光子能量大于或等于能隙宽度时,其价带中的电子将被激发跃迁到导带,在价带上留下相对稳定的空穴,从而形成电子-空穴对。电子和空穴从内部向表面进行迁移,参与氧化还原反应[1]。
半导体氮化碳有六种晶型-α相氮化碳、β相氮化碳、c相氮化碳(立方相)、p相氮化碳(准立方相)以及g相氮化碳(类石墨相)[2]。而类石墨相氮化碳的结构为一种近似石墨烯的平面二维片层结构,且g-C3N4又分为两种,为三嗪环C3N3(g1-C3N4,图1a)和七嗪环C6N7为重复基本单元的氮化碳(CCN,图1b)。石墨相的氮化碳被证明为氮化碳所有当中相中最稳定的一种。在工业生产中使用尿素等前驱体进行高温裂解制备所得到的产物常为g1-C3N4。
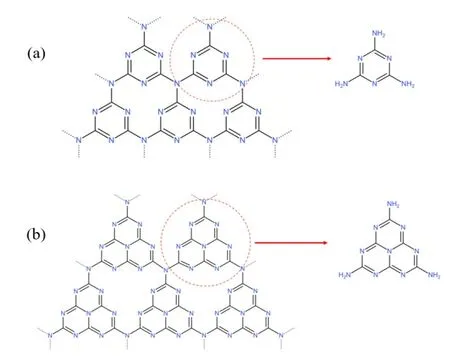
图1 (a)三嗪环石墨相氮化碳g1-C3N4和(b)七嗪环石墨相氮化碳CCN的基本结构
与传统的氮化碳g1-C3N4相比,CCN具有更好的π-π共轭,更窄的能隙,有效地促进光生载流子的产生,然而CCN仍只能吸收只占太阳光谱总能量的20%以下的光,因此众多科研人员仍不断优化其结构和改善其不足,并将其用于光催化领域。在本实验中,将制备CCN并通过缺陷调控获得吸光范围更宽的D-CCN,用于光催化分解水产氢。
石墨相氮化碳的制备方法分为固相反应法,水热反应法,化学沉积法及熔融盐反应法。固相反应法是指将含有三嗪环或七嗪环的有机物置于高温高压的环境下断裂重组得到石墨相氮化碳。但是反应条件苛刻、危险性高、耗能大、合成装置复杂。水热反应法是指溶于溶剂中的反应物,在液相的条件下进行反应的方法。相比于固相反应法,其反应物的分散性和传质作用更好,但是需使用的溶剂(如苯等)为有毒物质,且反应条件同样需要高压。化学沉积法是指在硅片或导电玻璃上合成石墨相氮化碳薄膜,操作复杂,不适合在教学实验中进行。熔融盐反应法是指在熔融盐为反应介质的条件下,反应物获得更好的传质作用,且工艺简单,无需高压条件,反应溶剂无毒无害,所制备的石墨相氮化碳具有成分均匀,结晶度高等特点。
本实验采用的是熔融盐反应法,该法可在实验室内安全有序的进行,无毒无腐蚀性试剂参与,是较好的教学实验方案。
1.实验部分
(1)实验试剂
氯化钾,氯化锂,三聚氰胺,Nafion,无水硫酸钠,无水乙醇,N,N-二甲基甲酰胺,磷酸盐缓冲液,丙酮,浓盐酸,硼氢化钠,氢氧化钠。均为分析纯,用时根据需要经过干燥纯化处理或直接使用。
(2)实验仪器
马弗炉,管式炉,电子天平,氙灯光源和真空干燥箱,气相色谱仪(浙江福立分析仪器9790Ⅱ),X射线衍射仪(德国布鲁克公司的D8 ADVANCE型,Cu靶激发的射线3kW为射线源),紫外-可见光谱仪(津岛的UV-3600型分光光度计)。
(3)实验过程
①CCN的制备
用电子天平称取3g三聚氰胺置于空气气氛的马弗炉中,在550℃下恒温加热4h,升温速率为5℃/min,在马弗炉中冷却至室温后取出。所烧得的黄色固体即为g1-C3N4,研磨得淡黄色粉末。
以氯化钾与氯化锂11:9的质量比,g1-C3N4与氯化物混合物1:10的质量比称混合后(0.4g的g1-C3N4,2.2g的氯化钾和1.8g的氯化锂),在氩气保护的450℃的管式炉中分别恒温煅烧4h,升温速率为5℃/min,烧制得到黄绿色固体,超声分散,抽滤烘干后得到浅绿色粉末状样品CCN。
②氮化碳缺陷化处理
取0.4g上述CCN样品,与0.08g的硼氢化钠在玛瑙研钵中研磨均匀,CCN:NaBH4=5:1,在通入氩气保护的管式炉中,在450℃下恒温煅烧30min,升温速率为5℃/min。将样品粉末溶于纯水中,加入1mol/L的盐酸调节pH至中性后,进行抽滤,并用纯水多次洗涤,以除去未反应的硼氢化钠。将抽滤后的样品放置在真空干燥箱中,在60℃下烘干12h。样品最终呈褐色粉末状,为D-CCN。
③样品的结构表征
本实验主要采用了X射线粉末衍射、固体紫外-可见漫反射或吸收光谱等表征手段来表征样品的晶态结构和能带结构。XRD为测试条件:工作电压40kV,扫描范围4°-60°。紫外-可见光谱仪的测试条件:以BaSO4作为参比,在室温下进行测试。
④电化学测试
首先采用滴涂法制作测试用的电极。取10mg的样品与20mL的Nafion(作为粘合剂)和无水乙醇进行混合,进行超声分散。取已洗净的FTO导电玻璃,用胶头滴管取1mL分散液均匀滴涂在导电玻璃的预留空间(1cm2)上,并静置待溶液自然挥发,重复上述操作滴涂三次。待滴涂完成后,用风筒的热风加热1min定型即可。
⑤光催化产氢测试
将10mg的样品与10mL三乙醇胺和水的混合液(1:9)以及36.7μL的20mmol/L的氯铂酸溶液进行超声混合,倒入反应器后通入氮气鼓气20min。打开光源(带滤光片)进行照射,每一个小时就用微量注射器取100μL气体进行色谱测试,探测生成的氢气量。最终通过每小时每克的产氢速度来对比不同操作下的材料的光催化综合性能。
2.结果与讨论
(1)g1-C3N4、CCN和D-CCN晶相结构
用熔融盐反应法制备的具有七嗪环基本单元的CCN和使用硼氢化钠进行掺杂的D-CCN的X射线衍射曲线见图2。图中可见两个主峰,其中在28°出现很强的衍射峰为晶体结构中层间π-π堆叠的衍射峰,对应其(002)晶面[3]。第二个主峰出现8°附近,为样品中平面分子内重复的七嗪基本单元的(100)晶面衍射峰,证明了七嗪环的存在[4]。经对比可知,g1-C3N4在经熔融盐反应法后制备的CCN仍具有较高的(002)峰强度,证明了在熔融盐处理后仍具较高的结晶度。而D-CCN的(002)峰相比于CCN下降,是因为氮化碳在经过高温处理后,会出现层间结构的破坏,从而导致其峰强下降。CCN和D-CCN的谱图中相比于g1-C3N4出现的(100)特征峰,证实了七嗪环的成功引入,而D-CCN相比于CCN的(100)峰强度略有下降是由于七嗪基本单元有部分被破坏,证明了缺陷的成功引入。
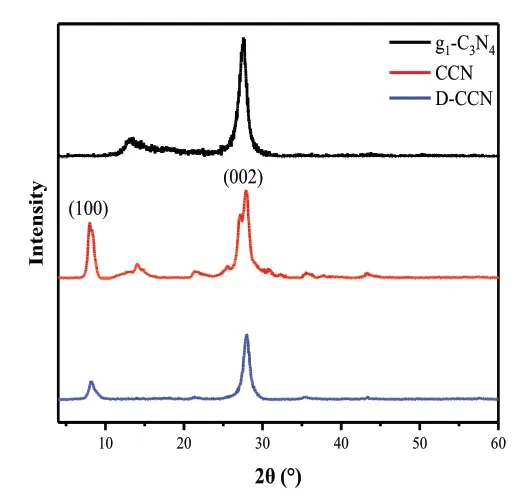
图2 g1-C3N4、CCN和D-CCN的XRD图
(2)g1-C3N4、CCN和D-CCN光吸收性能
为了探究g1-C3N4、CCN和D-CCN的光吸收性能,我们测试并获得了三者的紫外-可见吸收光谱图(图3a)。由图可知,在400-450nm吸收范围内,CCN仍具较大吸光强度,推测与其较强的层间π-π堆叠的衍射峰强度有关,π-π共轭可使激发光生载流子的能量变低;在可见光范围390-780nm内,D-CCN具有最大的吸光强度,CCN其次,g1-C3N4吸光最弱,由此可见缺陷的成功引入,使得材料在可见光范围内具有更好的光吸收性能,能够更加充分地利用可见光。
依据三者光吸收曲线,我们分别得到了g1-C3N4、CCN和D-CCN的Tauc plot曲线(图3b-图3d)。由切线可知,g1-C3N4、CCN以及D-CCN的能级带隙逐渐减小,与g1-C3N4比,CCN能级带隙的减小是由于其更好的π-π共轭作用,DCCN带隙的减小归功于缺陷的引入,并且D-CCN出现了很明显的乌尔巴赫拖尾。拖尾的出现表明半导体结构中出现了缺陷,包括引入的金属离子,晶格有序性的破坏等,而导致本征带隙中出现的中间带隙。从图3d中可以得到D-CCN的中间带隙值为Em=1.64eV,该中间带隙的出现可使材料获得更宽的光谱吸收能力。同时由于本征带隙和中间带隙之间存在能带差,使得产生的光生电子可以从较高能量的导带自发地迁移到中间带隙,可提高电荷的分离效率,改善材料的光催化性能。
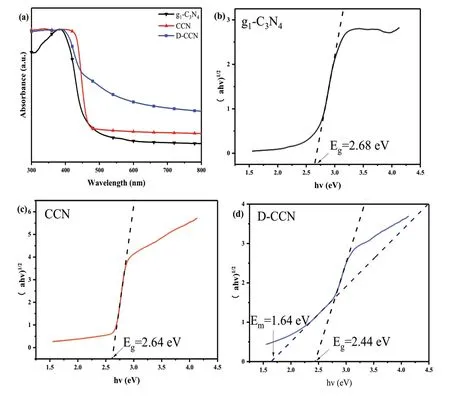
图3 (a)g1-C3N4、CCN和D-CCN的紫外可见漫反射光谱;(b)g1-C3N4;(c)CCN;及(d)D-CCN的Tauc plot曲线
(3)Pt/g1-C3N4、Pt/CCN和Pt/D-CCN的光催化分解水产氢性能
使用3wt%的Pt作为助催化剂,负载于g1-C3N4、CCN和D-CCN上,获得了Pt/g1-C3N4、Pt/CCN和Pt/D-CCN三种催化剂,用于可见光催化分解水产氢实验,结果如图4(a)所示。Pt/g1-C3N4产氢量几乎为0,光催化效率极低,而Pt/CCN的产氢速率有了质的提高,为1451μmol·g-1·h-1,且Pt/D-CCN的产氢效率更高,为2007μmol·g-1·h-1,证明了七嗪环的存在以及缺陷的引入能极大提高氮化碳的光催化产氢性能。图4(b)为CCN和D-CCN在不同单色光下(425nm、450nm和515nm)的产氢速率,我们可以看到在任何一种单色光下D-CCN都具有更好的产氢速率,且当光的波长上升至515nm后,CCN无法进行光催化制氢的反应,而D-CCN仍有较高的析氢活性。这也证实了局部缺陷化处理后的D-CCN拥有更窄的能带,可以吸收更大波长的光,有着更加优异的可见光催化性能。
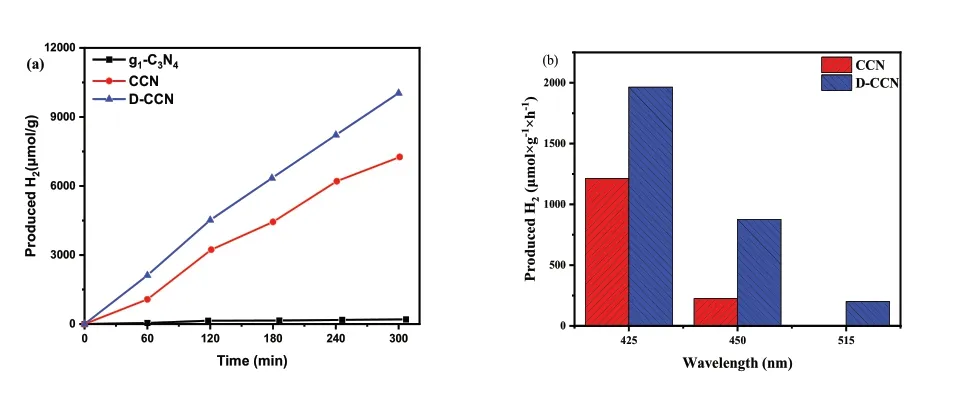
图4 (a)Pt/g1-C3N4、Pt/CCN和Pt/D-CCN在可见光下的光催化产氢速率;(b)Pt/CCN和Pt/D-CCN在不同单色光下(425nm、450nm和515nm)的光催化产氢速率
3.结语
本实验用熔融盐反应法制备得到七嗪基石墨相氮化碳CCN,且在引入缺陷后获得的石墨相氮化碳D-CCN拥有更强的可见光吸收能力,分离和迁移效率更高,具有更好的光催化性能。实验操作包括对材料进行高温处理以及电极的制备,这些操作有一定的专业性,可以提高学生的动手能力,拓展其知识面。同时实验设计需要使用XRD,电化学工作,和色谱等常用且重要的实验表征手段,可以让同学们学习了解其原理,并能在指导下进行操作,为往后的学习和未来的科研道路打下重要的基础。

