混合模式色谱介质的制备及其在蛋白分离纯化中的应用
*王仕杰 薛彦晓 靳海波 何广湘 潘天予 柏张傲 张荣月
(北京石油化工学院 新材料与化工学院/燃料清洁化及高效催化减排技术北京市重点实验室 北京 102617)
前言
近年来,生物技术发展迅猛,越来越多具有生物活性的蛋白质被研究和应用。蛋白质是一种具有特殊性质的生物大分子,它的特殊性体现在其结构复杂、难分离、易失活等方面。所以蛋白质的分离纯化与传统的化学分离有所不同,需要在分离纯化的过程中既要保证蛋白质的生物活性,同时又要考虑选择性,回收率以及成本问题,这些因素增加了蛋白质分离纯化的难度,成为了生物制品规模制备的瓶颈技术问题,为了提高该类制品的分离效率,各种蛋白分离纯化技术应运而生。
高效液相色谱因其出色的分离性能被广泛的用于复杂样品的分析[1]。其利用蛋白质与固定相之间的作用力使蛋白质得到分离,不同类型的固定相与蛋白质之间的相互作用是不同的,因此分离纯化效果也有所不同。传统的色谱固定相常为单一分离机理,然而在实际样品的分离纯化过程中,单一的色谱模式已经无法满足现今复杂样品分离分析的要求。而混合模式色谱(Mixed-mode Chromatography,MMC)与单一色谱模式相比体现出的独特优势,引发了研究者极大的兴趣。
MMC起源于“detergent”型疏水层析[2],最初只是研究介质中疏水和静电作用共同存在时对层析过程的影响。在20世纪80年代,Regnier[2]等首先提出了几种可以同时提供阴离子交换和疏水相互作用的MMC填料,并成功的应用于蛋白质的分离纯化。从此,MMC技术迅速发展。
目前已有多篇综述类文章涉及MMC在蛋白质分离纯化中的应用,其重点介绍了MMC用于分离纯化蛋白质的配基的选择原理和设计原则以及MMC在抗体和某些特殊蛋白分离中的应用[3-5]。近年来该项技术发展迅速,并且涌现了更多的应用领域,为了进一步对该项技术进行总结,本文将主要介绍混合模式色谱的分离机理、基质、配基以及不同组合模式的混合模式色谱的最新进展,并对MMC在抗体和病毒类疫苗中的应用前景进行展望。
1.混合模式色谱技术
MMC技术是指利用固定相与溶质之间存在着的多种相互作用力,使溶质实现更好分离的色谱技术[4]。与其他类型的色谱法相比,MMC技术的优势在于可以使目标物在较宽的离子强度范围内被吸附,通过电荷的排斥以及独特的选择性,可以减少许多预处理步骤,并且可以高效快速地结合目标物,又能简捷地实现目标物的解吸,从而减少分离时间,降低成本[5]。此外,相较于传统的单一作用机理的色谱模式,MMC具有更好的选择性[6]和更高的负载量[7],是对传统的单模式色谱很好的补充。
2.混合模式色谱固定相
MMC固定相通常由基质和功能团两部分构成,其中,MMC介质的性能是决定蛋白能否分离成功的关键。其影响因素主要包括:形状、粒径及其分布、孔径及其分布、配基密度等参数。从一定意义上说,MMC介质是整个层析过程的核心。
(1)混合模式色谱介质基质
对于MMC介质来说,选择合适的基质对于提高蛋白质的分离纯化效率具有重要意义。为了更好地使目标物与介质发生作用,理想的基质需要具备的基本条件[8]:①良好的多孔网络结构;②粒径均一;③良好的机械强度;④良好的化学稳定性;⑤可提供大量的吸附位点;⑥廉价易得。目前,混合模式固定相所用基质材料主要分为以下几种类型。
①天然多糖类
以琼脂糖为代表的天然多糖类介质,其特点主要是其表面含有丰富的羟基,便于化学衍生;琼脂糖由于具有开孔性基质骨架,生物分子可以自由进入;亲水性强,洗脱条件温和,不易对生物分子造成破坏失活;由于是多孔结构,比表面积大,蛋白动态结合载量高。虽然琼脂糖的生物相容性好,但机械强度低,为了提高其强度,可以对琼脂糖微球进行交联[8-9]。Cytiva公司开发的Capto Adhere是典型的疏水/强阴离子交换层析介质,其基质是由高度交联的琼脂糖制成,配基为N-苄基-N-甲基乙醇胺。该介质对于抗体具有良好的吸附能力,在高流速下仍然保持较好的传质性能[6]。
②无机物类
以多孔硅胶为代表的无机物类介质,除了具有很强的刚性,能够承受很高的压力之外,其表面还富含硅羟基,可以在其表面进行化学改性,但硅胶在碱性条件下不稳定,其适用pH范围较窄,该特点限制了其在蛋白分离纯化领域中的应用。为改善这一问题,目前主要通过对表面硅羟基化学修饰进行硅胶改性,以高反应活性的烷基化试剂将残余硅羟基反应掉,从而消除部分影响,提高蛋白质的回收率[10]。如郭志谋[11]等人使用硅胶基质合成了以辛基和氨基为配基的混合模式反相/阴离子交换固定相C8PN,成功的分离了人生长激素降解物。
③合成高聚物类
人工合成高聚物微球按聚合物基质种类不同,主要分为聚丙烯酰胺类、聚丙烯酸酯类、聚苯乙烯类等[12]。当前用于MMC填料的高聚物类基质主要以聚丙烯酸酯类为主,该类介质同时具有双键与环氧基两种功能基团,双键可以实现与其他功能单体的接枝化,另外,由于环氧基的反应活性高,可以在较温和的条件下实现基质的改性,获得具有多功能性的介质。杨帆[13]等以甲基丙烯酸环氧丙酯(GMA)为单体,乙二醇二甲基丙烯酸酯(EDMA)为交联剂,采用一步种子溶胀聚合法制备聚甲基丙烯酸环氧丙酯(PGMA/EDMA)聚合物微球。并以PGMA/EDMA聚合物微球为基质,采用“巯基-烯烃”点击反应,将马来酸酐键合到微球表面,制备成阳离子交换/疏水作用型MMC介质,实现了对蛋白质样品的有效分离。
以高聚物为基质的MMC介质,不仅克服了多糖类介质易受微生物侵蚀,机械强度弱的不足,又能实现良好的亲水性和生物相容性,适用于蛋白质的分离纯化。此外,聚合物表面具有丰富的可衍生基团,容易进行化学改性,是理想的MMC填料之一。
(2)混合模式色谱介质配基
混合模式配基的化学结构决定了MMC的作用类型,MMC配基通常具有两种或者两种以上的作用模式,例如离子交换、疏水相互作用、氢键作用等,且MMC配基密度较高,具有良好的耐盐吸附性能[14]。因此,在较宽的盐浓度范围内,MMC介质均能够保持较高的吸附容量,可以减少对料液的预处理,比如稀释、过滤、脱盐等,从而提高分离效率。
高性能的MMC配基根据其用途不同可进行按需设计,并通过实验来优化组合。通过改变流动相的组成和性质,进而表现出不同的分离模式,很多在单一色谱模式用到的功能基团都可作为MMC中的相应基团来进行恰当组合。表1列举了目前典型的用于蛋白质分离纯化的混合模式配基,并详细介绍了相应的配基结构和功能位点,这些配基通常是由脂肪族或芳香族基团作为疏水部分;氨基,羧基或磺酸基团作为离子交换部分;杂环基团也因其独特的疏水性和解离特性而成为良好的候选配基。在配基的筛选和设计时应考虑这些原则,确定配基的性能,同时要求配基的分子结构相对简单,容易合成和制备,且价格较低。通过分子动力学模拟,可在微观层面对配体与蛋白质之间的相互作用进行研究,可以更好的了解分离机理,从而设计和筛选合适的配基[15]。
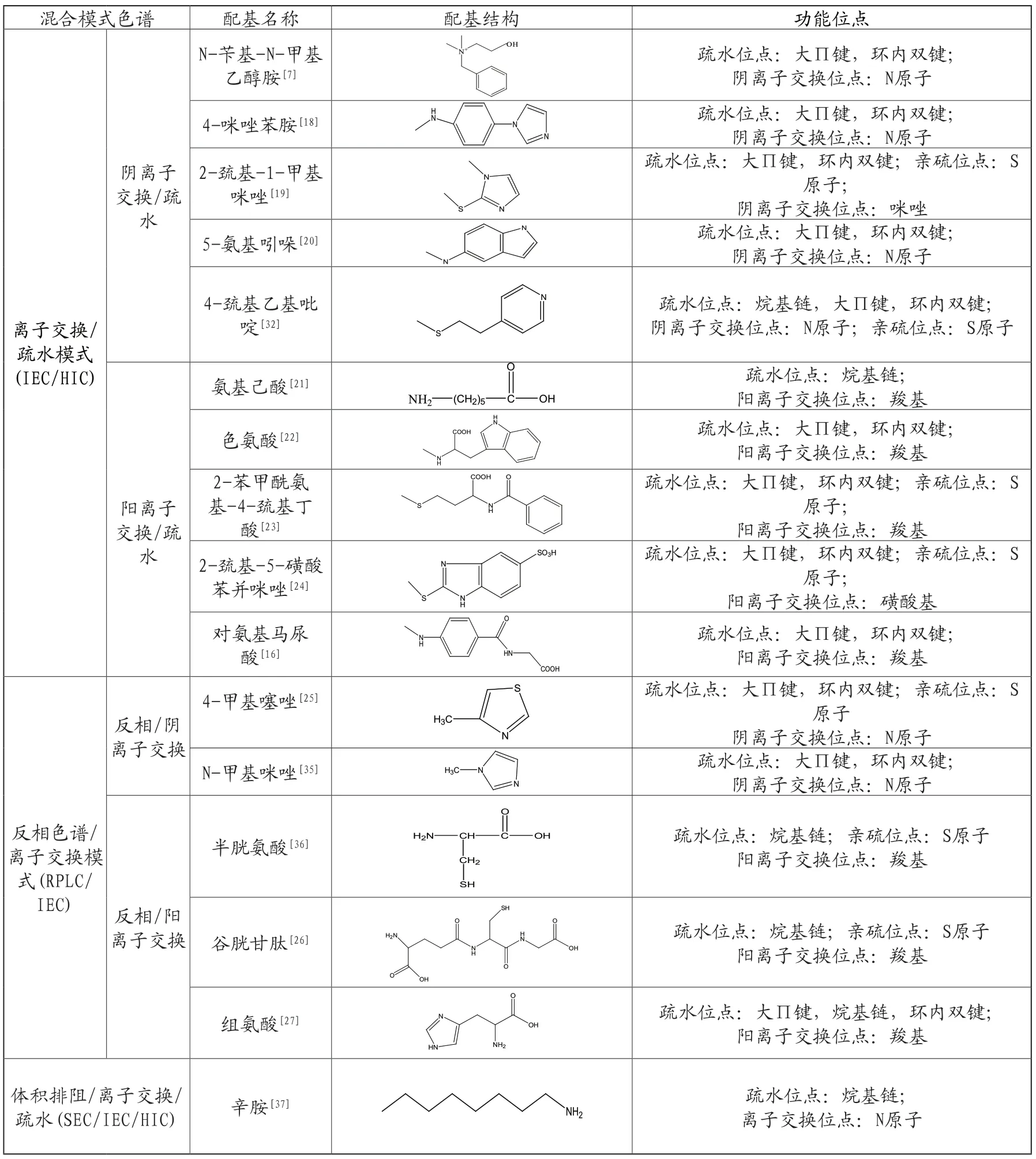
表1 典型混合模式配基
(3)混合模式色谱种类
目前应用于蛋白分离纯化的混合模式色谱类型主要有:离子交换/疏水模式(IEC/HIC)、反相色谱/离子交换模式(RPLC/IEC)、体积排阻/离子交换/疏水模式(SEC/IEC/HIC)等。这些不同类型的混合模式色谱具有良好的分离性能,显示出了广阔的应用前景。
①离子交换/疏水模式(IEC/HIC)
IEC和HIC是分离纯化生物大分子最常用的色谱模式,主要是因为其流动相大多为盐水体系,与生理条件较为接近,能更好地保持生物大分子的活性,因此,许多用于活性蛋白纯化的MMC配基是基于这两种作用类型设计的[4]。当溶液离子强度较低时,静电力起主要作用,目标蛋白与吸附剂之间发生离子交换实现吸附,随着离子强度的增大,静电作用逐渐被屏蔽,疏水作用增强,目标蛋白通过疏水结合被吸附。对目标蛋白的洗脱,则可通过调整目标蛋白与吸附剂之间的带电性,依靠静电排斥来实现。
根据介质所带电荷的不同,该类型MMC介质可以分为阳离子交换/疏水层析介质和阴离子交换/疏水层析介质。赵开楼[26]等以硅胶为基质,以磺酸基和苯甲基为配基合成了阳离子交换/疏水相互作用MMC固定相,该介质可分别用于在IEC和HIC模式下分离蛋白质,高盐浓度时可体现出HIC的分离机理,低盐浓度时可体现出IEC的分离机理,实验表明,模型蛋白在两种模式下的质量与活性回收率均高于96%,同时,测试了其在复杂样品中分离蛋白质的能力,成功地从鸡蛋清中分离出包括卵转铁蛋白、溶菌酶、卵清蛋白在内的多种活性蛋白。
于嫄[27]等通过活性聚合方法,制备了以GMA与EDMA共聚的超大孔聚合物微球(PGMA-EDMA),以该聚合物材料为基质,利用聚乙烯亚胺(PEI)和丁基缩水甘油醚(BGE)先后衍生微球的表面,制备成兼具阴离子交换与疏水相互作用的MMC介质。蛋白载量最高可达40mg/ml,回收率高于90%。该介质在大于2000cm/h的流速下依然能保持2MPa左右的柱背压,在高流速下实现了对人血清中抗体的纯化。
最常见的IEC/HIC型MMC介质同时兼有疏水和静电作用。MMC介质偶联离子交换基团的主要目的是促进洗脱,但在常规的吸附条件下,这些基团始终带有电荷,而配基持久带电会导致料液中的某些杂质与介质发生非专一的静电吸附,从而干扰目标产物的纯化[30]。为了解决这一问题,Burton[29]等提出了疏水电荷诱导色谱(HCIC)的概念。作为IEC/HIC型MMC的一种特殊形式,吸附剂的配基在不同条件下呈现不同的带电形态。蛋白的吸附过程只依赖疏水作用,通过调节洗脱液pH值,改变介质的带电性质,在温和的环境下,通过静电排斥就可以实现蛋白的分离。
目前典型的HCIC商品化介质是Pall公司生产的MEP HyperCel,它以4-巯基乙基吡啶(MEP)为配基,以纤维素材料为基质,其结构含有硫原子、吡啶杂环和疏水链,在中性条件下可以通过疏水作用和亲硫作用对蛋白质产生吸附[30]。
②反相色谱/离子交换模式(RPLC/IEC)
疏水和静电作用力是具有高度正交性的两种作用力,RPLC的分离原理是基于溶质与固定相间的疏水作用力,这种色谱较适用于分离非极性或极性较弱的溶质。若是给配基中引入离子交换基团,利用其静电作用则可以发挥离子交换色谱的优势,固定相能同时对极性或电离性的溶质有更充分的保留能力,RPLC/IEC就是利用这一特点,实现了单一反相模式下无法达到的分离效果[34]。
白泉[32]等通过非均相合成法将N-甲基咪唑键合到硅胶表面,制备了RPLC/IEC型MMC介质,由于咪唑环具有大П键,可利用其疏水性表现出反相色谱的特点,并且,由于引入了正电荷,固定相能表现出强阴离子交换的作用。通过对蛋白质在十八烷基硅烷键合硅胶柱(ODS)和MMC固定相上色谱行为的比较,发现在该模式下,碱性蛋白由于存在静电斥力而不保留,而对酸性蛋白却表现出了较好的选择性,且分离效果优于ODS柱。该介质可实现对蛋清中溶菌酶、卵白蛋白和卵转铁蛋白的分离纯化。
③体积排阻/离子交换/疏水模式(SEC/IEC/HIC)
理想的体积排阻色谱法主要根据溶质分子的体积来分离目标物,但在实际分离过程中,溶质的保留不可避免地会受到静电作用和疏水作用的影响[36]。
该类型混合模式介质多见报道的是Cytiva的Capto core系列,包括Capto core 700和Capto core 400两种介质。该系列介质采用核壳结构微球技术,微球壳层孔径小于核心孔径,同时壳层为惰性层而其核心被配基激活,惰性壳层可阻止大分子进入壳层孔道(Capto core 700排阻相对分子质量为700kDa,Capto core 400排阻相对分子质量为400kDa),以辛胺为配基的核心部分可使其具有离子交换和疏水相互作用复合模式,该介质实现了尺寸排阻和吸附层析的双重功能。较大分子在流穿部分被收集,而较小的杂质会与微球内部配基结合。微球的MMC配基,可使介质在较宽范围的pH值和盐浓度中与大多数杂质进行强有力的结合。用NaOH或其它溶剂进行洗脱,可将结合的杂质从微球上除去。相较于单一体积排阻模式,其流速更高,上样量可以提高10-100倍,操作灵活,适合工艺放大,主要应用于病毒等大分子的分离 纯化[37]。
3.MMC在蛋白分离纯化中的应用
随着现代生物技术的不断进步,利用细胞作为生物工厂来获取生物活性蛋白已成为发展的主要趋势。通过微生物发酵或细胞培养表达是获取蛋白质的第一步,而这一过程常伴有内毒素、聚集体和宿主细胞蛋白等多种杂质成分[38]。MMC技术由于其独特的分离机制和简便的操作步骤,在该领域受到了广泛的关注,并成功应用于抗体、疫苗等药用蛋白的分离纯化。
(1)MMC在抗体分离纯化中的应用
自1986年美国食品和药物管理局(US FDA)批准首个抗体药物以来,抗体工程技术在过去30多年中取得了跨越式的发展。作为一种特殊的蛋白质分子,抗体广泛应用于生物科学研究、生物科技和医疗领域,目前的抗体药物因其高度的特异性,副作用越来越小。因此,治疗性抗体已成为近年来新药研发的主要方向之一。截至2019年12月,美国FDA已批准了79种治疗性抗体的生产,但仍有上百种抗体药物在开 发中[36]。
经典的抗体分离工艺可分为捕获阶段和精纯阶段,其中抗体捕获阶段通常使用Protein A亲和层析,其对Ig G具有高度的特异性,一步纯化可得到90%以上纯度。但是,Protein A亲和层析也存在着诸如价格高昂,洗脱条件苛刻,只能与Fc片段相结合等问题[37],因此,开发具有与Protein A同等优势的层析工艺成为当下的研究热点之一。Follman等分别利用经典的抗体纯化工艺和使用包括MMC介质(IEC/HIC)在内的无Protein A亲和步骤的多步纯化工艺,对中国仓鼠卵巢细胞(CHO)表达的抗体进行了分离纯化,结果显示,在抗体回收率和纯度方面,不同类型介质的组合可以像传统方法一样有效,表明了低成本条件下MMC介质应用于抗体分离纯化的可能性。
Maria[38]等开发了一种从CHO细胞培养液中纯化单克隆抗体(mAb)的创新工艺:首先利用MMC介质HEA HyperCel捕获,Capto MMC进行中间纯化,最后使用Sartobind Q阴离子交换介质精制。该方法中两个混合模式步骤对单抗有较好的选择性,通过这些步骤除去了上清液中的主要杂质。最后,使用阴离子交换膜对残余的DNA和宿主细胞蛋白等杂质蛋白进行了去除。该工艺的总产率和单抗的纯度分别为88%和99.9%,杂质含量符合治疗型抗体的要求,与基于使用蛋白A捕获步骤的常规方法相当。
此外,对于某些基因工程抗体、抗体片段或者亲和力较弱的鼠抗、兔抗等Protein A分离性能较差的抗体,MMC也表现出了良好的分离效果。如林东强等以2-巯基-1-甲基咪唑为配基,将其与二乙烯基砜活化的琼脂糖基质偶联,制备了HCIC型混合模式层析介质,对鹅血浆进行预处理后,利用该HCIC色谱材料对血浆中的鹅免疫球蛋白IgY(ΔFc)进行分离。并且研究了在不同pH条件下IgY(ΔFc)的吸附情况,最终纯度为98.6%,产率为85.0%。Bangaru等利用MMC介质Capto MMC对大肠杆菌表达的Fab片段进行了分离,其总回收率达到了97%,纯度为73%。除此之外,该介质也被用于对鼠单抗和兔单抗的分离纯化,Arakawa等使用Capto MMC对人源胚胎肾细胞(HEK)表达的兔单抗和鼠单抗进行了分离纯化,在中性条件下,使用精氨酸协助洗脱,单抗收率分别为80%和90%。
MMC广泛应用于抗体的分离纯化,在此过程中,体现了其较好的选择性,具有载量高、操作简单、洗脱条件温和等优点[39]。但不可否认的是,MMC选择性与Protein A亲和层析相比仍有一定的差距,对于抗体与MMC之间结合的作用机理以及影响因素等,还不够明了。因此,如何提高MMC对于抗体的选择性,合理的设计分离过程,仍是目前的热点问题。
(2)MMC在病毒类疫苗分离纯化中的应用
迄今为止,由病毒引起的传染病仍然威胁着人类和动物的生命健康,疫苗作为预防和阻击病毒的有效方法,一时间再次成为全球科研人员关注的焦点。病毒类疫苗主要包括减毒病毒疫苗、灭活病毒疫苗、类病毒颗粒(VLP)等类型。当前,MMC技术已广泛应用于病毒或类病毒颗粒的分离纯化中,在规模化生产高纯度病毒原种和生产用于基因治疗的病毒载体方面拥有巨大潜力[40]。
与分离纯化抗体不同的是,病毒类疫苗分子量高,体积较大,在分离纯化过程中,难以进入介质内部,造成载量普遍较低,并且在狭窄的介质孔径内部易发生结构变化,造成其变性失活。目前,在病毒类疫苗的分离纯化中应用较广的为体积排阻型层析介质,该类型介质孔径在一定范围内分布,杂质蛋白等小分子物质进入孔内部,保留时间较长,而大尺寸病毒分子则被孔排除在外而直接流穿,利用该类型介质可以简便实现病毒类疫苗的分离纯化,并且操作条件温和,对疫苗的生物活性影响较小[41],但是,传统的用于纯化疫苗的常规分子筛层析介质由于上样量小和流速低的限制,产量和收率相对较低。MMC型介质Capto core 700,其上样量高、处理量大、缩短了工艺时间,尤其是在大分子蛋白的分离纯化方面,该介质以其独特的分离性能广受好评。Muddle等[42]通过以Capto core 700介质为核心的多步纯化方法,对减毒呼吸道合胞病毒(RSV)疫苗进行纯化。该纯化过程首先进行了澄清、浓缩以及用核酸内切酶进行降解等前处理步骤,然后使用MMC介质进行分离纯化,最后使用中空纤维切向流过滤技术进行病毒浓缩、去杂。结果表明Capto core 700在纯化该病毒时,去除了大约99%的残余Vero细胞宿主蛋白和约95%的残余Vero细胞DNA,病毒滴度没有明显下降,并且在大鼠体内进行了测试,所得疫苗显示出了针对RSV攻击的免疫原性和保护性。
还有许多学者设计了MMC与其他单模式色谱技术相结合的方法对整个病毒或VLP进行纯化,如Zhao等设计了以混合模式层析介质为主的多步层析纯化工艺,纯化由昆虫细胞培养的人肠道病毒71型(EV 71)类病毒颗粒。该工艺首先利用Capto core 700对EV 71型VLP样品进行初步纯化,目标物通过流穿模式被纯化分离。为避免初步纯化中的高盐影响,将初步分离得到的含有EV 71型VLP的流穿液通过Capto Adhere层析柱进行中度纯化,除了离子交换作用外,该介质还与目标生物分子之间存在疏水和氢键相互作用,有效地去除了宿主细胞蛋白和宿主细胞DNA,经洗脱后大部分杂质蛋白被去除。最后选用弱疏水性色谱层析介质Capto butyl对EV 71型VLP进行精度纯化,经过滤器滤菌过滤和ELISA试剂盒检测后,结果发现,采用多步色谱层析方法对EV71型VLP 纯化的回收率为31.52%,其纯度可达95%以上。
当前MMC介质在分离纯化病毒类疫苗中的应用日益广泛,显著提升了分离效率,降低了操作成本。但在实际应用过程中出现了回收率较低且纯度不高的问题,需要根据不同的病毒选择合适的分离介质,设计合理的纯化工艺,同时,目前适用于病毒体系的MMC介质种类较少,需要研发新型MMC介质,以满足不同尺寸病毒类疫苗分离纯化的需求。
4.展望
最大限度地减少下游分离纯化步骤,提高单元操作效率是实现生物产品规模制备的主要研究方向。采用常规单模式色谱法分离时,常需要对样品进行前处理,包括稀释、脱盐等操作,这些都会明显提高生产成本。对于解决上述问题,MMC技术体现出很大的优势。目前,大多数学者对于MMC技术的探索主要集中于应用研究,对于蛋白质与MMC介质之间的作用机理以及影响因素等研究较少。此外,在层析过程中,由于多种作用力共同存在,相互影响,也会造成MMC介质性能的变化。因此,利用先进的分子模拟技术,加强对其作用机理的探究,将是解决问题的关键。随着MMC技术的不断发展,相信在不久的将来,其应用领域必将更为广阔。

