PRRSV GP5 和M 抗原中和表位的融合表达与纯化以及间接ELISA 检测方法的建立
李雷斌,李晓霞,王睿男,周 智,刘玉良,赵柏林,孙 航,冯 冰,陈 玲,王传彬,李义平,孙 雨
(1.广西大学动物科学技术学院,广西南宁 530004;2.中国动物疫病预防控制中心,国家/OIE 猪繁殖与呼吸综合征参考实验室,北京 102600)
猪繁殖与呼吸综合征(porcine reproductive and respiratory syndrome,PRRS)是由猪繁殖与呼吸综合征病毒(porcine reproductive and respiratory syndrome virus,PRRSV)感染引起的一种急性、热性、高度接触性传染病。PRRSV 为动脉炎病毒科动脉炎病毒属的成员,是一种有囊膜、不分节段的单股正链RNA 病毒,病毒粒子直径为50~65 nm,表面含有纤突[1]。PRRSV 有美洲和欧洲2 个血清型,我国分离株主要为美洲型。PRRSV 宿主范围狭窄,主要感染家猪和野猪,可引起动物持续性感染,抗体依赖性增强并发生免疫抑制,导致猪抵抗力下降[2]。患病猪通常表现高热、呼吸困难、咳嗽、食欲减退、皮肤发绀,以及妊娠母猪流产、瘫痪,仔猪毛发粗乱、精神不振、站立不稳等临床症状。该病患病率可达100%,死亡率可达60%以上。PRRSV 可在猪原代肺泡巨噬细胞和猴肾细胞系及树突状细胞中建立感染[3]。PRRSV 于1987 年在美国被首次发现以来,迅速传遍世界各养猪国家,在猪群密集、流动频繁的地区更易流行,常造成严重经济损失。近几年,该病在国内呈现明显的高发趋势,对养猪业造成了重大损失,已成为严重威胁我国养猪业发展的重要传染病之一。
PRRSV 的基因组RNA 大小为15 kb,具有5'端帽子结构和3'端Poly(A)尾巴结构。该病毒的主要结构蛋白为GP2a、GP3、GP4、GP5、M、E(GP2b)、N(图1),其中GP5 和M 蛋白是PRRSV 的主要囊膜蛋白,它们的总含量占病毒蛋白的一半以上,在病毒粒子表面通过二硫键连接形成异源二聚体[4]。GP5 是一种含有糖基化位点的蛋白,参与细胞受体识别和病毒中和;M 是一种非糖基化蛋白,主要参与病毒的组装,可增强宿主对GP5 蛋白免疫反应,产生较强的中和抗体应答,有作为抗原检测靶标的优势。此外,GP5 和M 也是刺激机体产生中和抗体的主要蛋白,是基因工程疫苗研究的热点靶蛋白。
目前,检测PRRSV 常用的血清试验有免疫过氧化物酶单层试验(IPMA)[5]、间接荧光免疫抗体试验(IFA)[6]、中和试验(SN)、酶联免疫吸附试验(ELISA)等。IPMA 和IFA 是用于检测病毒感染后抗体是否表达的经典试验方法,然而两者主观性强,易受操作人员技术和知识水平影响,操作费力,不适合用于大规模样品的检测。SN 只能检测具有中和作用的抗体,不适用于早期病毒的检查。而ELISA 特异性强,敏感性高,易于操作。基于以上原因,本研究以目前国内流行的NADC30-Like PRRSV 毒株基因序列为扩增模板,全面分析了PRRSV 结构蛋白GP5 和M 的二级结构抗原指数、抗原性、亲水性、表面可及性以及潜在中和表位等参数,选取GP5 与M 蛋白的相应中和表位作为免疫原,通过构建带接头序列的GP5/M 中和表位融合表达质粒pET-32a-GP5/M,利用大肠杆菌表达系统表达可溶性GP5/M 蛋白,建立了检测猪体内PRRSV中和抗体的间接ELISA方法,为提高PRRSV 中和抗体检测和开发PRRSV GP5/M 亚单位疫苗奠定了技术基础。
1 材料与方法
1.1 质粒与表达菌株构建
NADC30-Like PRRSV 毒株,由中国动物疫病预防控制中心(国家/OIE 猪繁殖与呼吸综合征参考实验室)分离并保存。通过对PRRSV 结构蛋白GP5 和M 二级结构序列的抗原指数、抗原性、亲水性、表面可及性、可能中和位点等参数进行分析,分别选取了GP5 的47~61、143~156 和186~199 位氨基酸,M 蛋白的63~70、133~146 和156~169 位氨基酸作为免疫候选抗原,并进行序列密码子筛选优化、接头(linker)序列柔性连接,构建中和表位抗原表达质粒pET-32a-GP5/M。将构建好的上述质粒转化入BL21(DE3)感受态细胞,作为GP5/M 的表达菌株。
1.2 主要试剂
2×PCR mix buffer、DNA marker,购自Promega公司;胰蛋白胨、酵母提取物,购自OXOID 公司;氨苄青霉素、四环素、庆大霉素、X-gal、IPTG、His-tag 抗体、鼠单克隆抗体,购自碧云天生物技术有限公司;镍琼脂糖凝胶FF,购自北京韦氏博慧色谱科技有限公司;BCA 蛋白定量试剂盒,购自Beyotime 公司;快速质粒小提试剂盒(离心柱型),购自天根生化科技(北京)有限公司。本试验中的PRRSV 阳性对照血清、阴性对照血清、相应特异性质控血清与临床比对血清样本,均经过血清中和试验鉴定,并保存于中国动物疫病预防控制中心(国家/OIE 猪繁殖与呼吸综合征参考实验室)。
1.3 引物设计
设计1 对GP5/M 引物序列(M-F:5'-TAATACGACTCACTATAGGG-3';M-R:5'-GCTAGTTATTGCTCAGCGG-3'),由北京六合华大基因科技有限公司合成检测引物。
1.4 融合蛋白质粒表达
取4 μL pET-32a-GP5/M 转化BL21(DE3)感受态细胞,涂板;选取阳性质粒接种到5 mL 含50 μg/mL 氨苄青霉素LB 培养基中,37 ℃、220 r/min过夜培养;将活化菌液按1:100 的比例加到500 mL LB 培养基中(含50 μg/mL 氨苄青霉素)37 ℃震荡培养;当菌液OD600nm值为0.5~0.6 时,加入终浓度为0.75 mmol/L 的IPTG,16 ℃、180 r/min过夜诱导培养。
1.5 质粒提取及PCR 鉴定
取10 mL 菌液使用小提试剂盒提取质粒,具体步骤参照质粒小提试剂盒说明书。将提取质粒、菌液用于PCR 鉴定。PCR 扩增体系25.0 μL:2×TaqPCRMix 12.5 μL,ddH2O 8.5 μL,引物各1.0 μL,模板2.0 μL。PCR 反应程序:95 ℃预变性5 min;95 ℃变性30 s,55 ℃退火30 s,72 ℃延伸30 s,35 个循环;72 ℃延伸10 min。程序结束后,将PCR 产物进行琼脂糖凝胶电泳检测,剩余菌液用于离心纯化蛋白,将沉淀4 ℃保存。表达成功后,将其命名为融合GP5/M 表位抗原。
1.6 融合表位抗原SDS-PAGE 鉴定与纯化
取出4 ℃保存的沉淀,用10 mL Tris-base 进行重悬,超声破碎菌体;将裂解后的菌体在4 ℃条件下12 000 r/min 离心20 min,取50 μL 离心上清进行SDS-PAGE 电泳分析,考马斯亮蓝染色,鉴定融合GP5/M 表位抗原的表达;将表达后的融合GP5/M 表位抗原使用6×His 蛋白镍琼脂糖凝胶柱进行亲和层析纯化。
1.7 融合表位抗原质量浓度测定及Western Blotting 鉴定
使用BCA 蛋白质定量试剂盒检测GP5/M 浓度。BCA 标准品按表1 进行稀释制作标准曲线,OD560nm条件下测定融合GP5/M 表位抗原的浓度,具体步骤按说明书进行。取融合GP5/M 表位抗原与2×上样缓冲液各50 μL 混匀,放置金属浴100 ℃变性10 min;取30 μL 样品上样,12% 聚丙烯酰胺凝胶电泳,转PVDF 膜,脱脂奶4 ℃封闭过夜;按稀释度为1:2 000 孵育对照血清90 min,TBST洗涤5 次,每次7 min;孵育HRP 标记的抗猪二抗60 min,稀释度为1:20 000,DAB 显色试剂液显色。

表1 BCA 蛋白质量浓度标准稀释度
1.8 ELISA 检测方法的建立
1.8.1 抗原包被浓度确定 将融合GP5/M(原始质量浓度为0.25 mg/mL)表位抗原用pH9.6 碳酸盐包被液按1:20、1:50、1:100、1:200、1:300、1:600、1:1 200、1:3 000、1:6 000 进行稀释,100 μL/孔加到ELISA 酶标板中,37 ℃孵育2 h;用PBST洗涤5 次,5%的脱脂奶250 μL/孔37 ℃封闭2 h,洗涤步骤同上;加入按1:100 稀释的阳性对照(PRRSV 阳性血清)和阴性对照(SPF 猪血清)各两孔,37 ℃孵育1 h;用PBST 洗涤,加入按1:20 000 稀释的HRP 标记的抗HRP 标记的抗猪二抗(100 μL/孔),孵育30 min;PBST 洗涤,加显色液(100 μL/孔)室温显色5 min 后加终止液(100 μL/孔),测阳性对照和阴性对照OD450nm值;选取P/N(阳性平均值/阴性平均值)最优值作为最佳的包被浓度。
1.8.2 封闭及稀释条件确定 按已经确定的抗原包被浓度包被ELISA 酶标板,摸索确定封闭液(5%脱脂奶、1%鱼明胶、1%BSA)和稀释液(5%脱脂奶、1%鱼明胶、0.67%BSA),以棋盘滴定的方式进行3 次重复试验。
1.8.3 血清样本和HRP 标记抗猪二抗最佳稀释倍数确定 按上述摸索好的步骤进行试验,将对照血清样本和HRP 标记抗猪二抗稀释度分别设置为1:20、1:50、1:100、1:200、1:500,各设两个阴阳对照,OD450nm条件下进行检测。选取P/N最优值作为最佳对照血清样本和HRP 抗猪标记二抗稀释倍数。
1.8.4 血清样本与HRP 标记二抗及底物反应时间确定 在ELISA 酶标板中加入阴阳对照各两孔,将PRRSV 阳性对照血清、阴性对照血清和HRP 标记二抗的孵育时间分别设置为30、45、60 min,底物显色时间分别设置为5、10、15 min,测OD450nm值,选取P/N最优值确定最佳的PRRSV 阳性对照血清、阴性对照血清和HRP 标记二抗及底物孵育时间。
1.9 ELISA 阴阳性临界值确定
将本实验室保存的400 份经血清中和试验检测为阴性的猪血清进行间接ELISA 检测,计算该400 份血清的平均值(X)和标准偏差(SD)。当OD450nm≥X+3SD 判为阳性,OD450nm<X+3SD 判为阴性。
1.10 试验验证
1.10.1 特异性试验 利用建立的间接ELISA 方法对猪瘟病毒、O 型口蹄疫病毒、A 型口蹄疫病毒、猪伪狂犬病病毒、猪细小病毒、猪肺炎支原体等其他猪病病原的阳性质控血清进行检测,观察PRRSV 与其他病原有无交叉反应。
1.10.2 敏感性试验 将已知的PRRSV 阳性血清进行倍比稀释,采用建立的间接ELISA 方法进行检测,同时采用血清中和试验作对比,得出阳性临界值时的最大稀释度。
1.10.3 重复性试验 采用建立的间接ELISA 方法对10 份猪血清在同批次板和不同批次板上分别进行检测,平行测定5 次,计算批内、批间变异系数(CV)。
1.10.4 符合性试验 采用建立的间接ELISA 方法与血清中和试验,对420 份临床血清进行平行检测,计算符合率。
2 结果与分析
2.1 融合表位抗原模式及PCR 鉴定
分别取2 μL 质粒和菌液进行PCR 鉴定,用水作为阴性对照。结果(图2~3)显示:菌液和质粒均出现特异性扩增条带,条带位于融合表位抗原相对分子质量大小位置,说明质粒构建成功。
2.2 SDS-PAGE 鉴定
使用IPTG 对融合表位抗原菌液诱导表达后进行破碎离心处理,对上清进行SDS-PAGE 分析。结果(图4)显示:上清液有特异性条带出现,但含有很多杂带。这表明融合表位抗原没有纯化,存在较多杂蛋白。
2.3 纯化后抗原SDS-PAGE 分析
将离心上清通过镍柱纯化,收取纯化后的洗脱蛋白进行SDS-PAGE 分析。结果(图5)显示,融合表位抗原在相应分子质量大小处出现特异性条带且纯化效率较高。
2.4 BCA 蛋白质量浓度测定
用梯度稀释标准液测定蛋白质量浓度的结果(图6)显示:GP5/M 抗原原液OD560nm为0.377,代入公式,融合表位抗原质量浓度为0.28 mg/mL;将抗原稀释1 倍,测得OD560nm为0.326,融合表位抗原质量浓度为0.22 mg/mL。取两者的平均值,即融合表位抗原最终质量浓度为0.25 mg/mL。
2.5 融合表位抗原Western Blotting 分析
结果(图7)显示:未纯化的GP5/M 上清抗原、纯化的GP5/M 上清抗原和溶解的沉淀抗原均与阳性血清反应出现特异性条带。
2.6 表位抗原ELISA 检测方法建立
2.6.1 最佳包被质量浓度测定 结果(表2)显示,P/N最优值为12.445,此时抗原的质量浓度为50 ng/100 μL,因此将该质量浓度设定为最佳的抗原包被质量浓度。
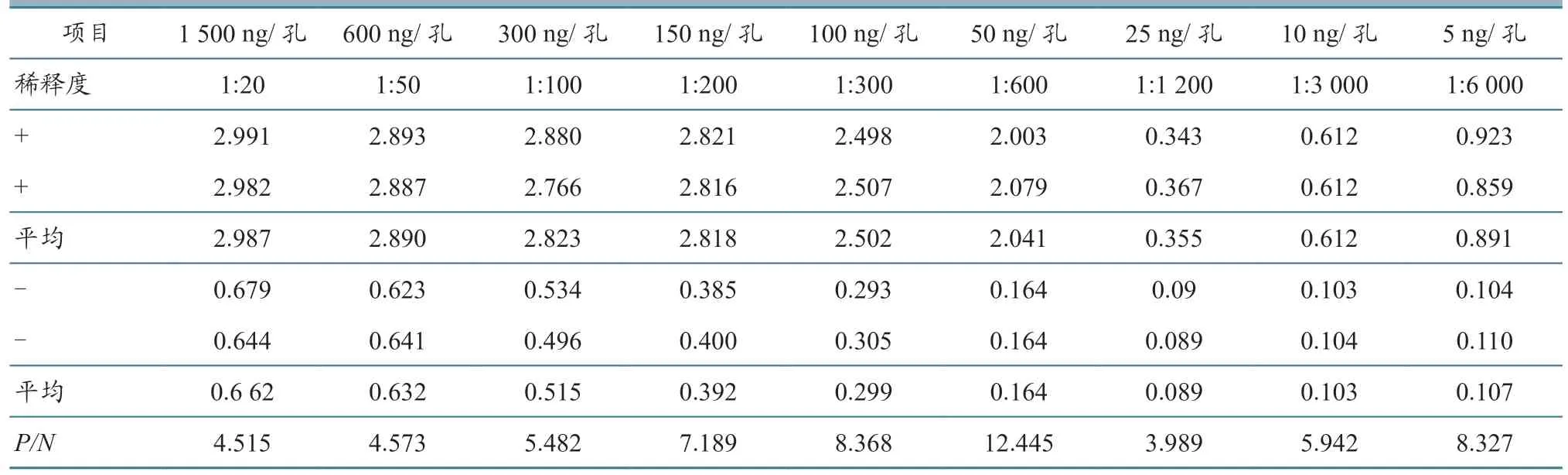
表2 抗原包被质量浓度测定结果
2.6.2 表位抗原封闭液及稀释液选择 结果(表3)显示,P/N最优值为6.348,即确定的封闭液为5%脱脂奶,稀释液也为5%脱脂奶。
2.6.3 PRRSV 血清样本稀释比例确定 结果(表4)显示:P/N最优值为7.524,即PRRSV 阳性对照血清、阴性对照血清的稀释比例为1:50。
2.6.4 HRP 标记二抗反应浓度确定 结果(表5)显示:将HRP 标记的抗猪二抗稀释后,P/N最优值为6.866,此时HRP 标记的抗猪二抗的稀释比例为1:10 000。

表5 HRP 标记二抗反应浓度确定结果
2.6.5 PRRSV 血清样本与HRP 标记二抗反应时间确定 结果显示(表6):P/N最优值为16.763,此时PRRSV 血清的反应时间为30 min,HRP 标记二抗的反应时间为45 min。

表6 PRRSV 对照血清样本和HRP 标记二抗不同反应时间测定结果(OD 值)
2.6.6 底物显色时间确定 结果(表7)显示:P/N最优值为15.515,即显色的最佳时间确定为5 min。

表7 底物显色时间确定结果(OD 值)
2.7 融合GP5/M 表位抗原ELISA 优化
经过条件摸索,最终确定ELISA 检测条件。包被:用pH9.6 碳酸盐缓冲液稀释融合GP5/M 表位抗原包被ELISA 检测板(50 ng/孔),每孔加入100 μL,37 ℃孵育2 h;封闭:取出酶标板,用PBST 洗涤5 次,最后一次拍干,每孔加入250 μL 5%脱脂奶,37 ℃封闭2 h;一抗孵育:出酶标板,用PBST 洗涤5 次,最后一次拍干,每孔加入100 μL 按1:50 稀释的标准阴性和阳性血清,每孔100 μL,置于37 ℃孵育30 min;酶标二抗孵育:取出酶标板,用PBST 洗涤5 次,最后一次拍干,加入1:10 000稀释的酶标抗HRP标记的抗猪二抗,每孔100 μL,置于37 ℃孵育45 min;显色:取出酶标板,用PBST 洗涤5 次,最后一次拍干,加入100 μL 底物显色液,在室温下显色5 min;终止反应:加入终止液,每孔100 μL,检测OD450nm值,记录结果。
2.8 ELISA 阴阳性临界值确定
采用建立的间接ELISA 检测方法,对400 份猪阴性血清进行检测,测定OD450nm值。400 份阴性血清平均值X为0.174,SD 为0.058,因此阴阳性临界值X+3SD=0.348。
2.9 验证试验
2.9.1 特异性试验 采用建立的间接ELISA 方法对6 种猪源病原(猪瘟病毒、O 型口蹄疫病毒、A型口蹄疫病毒、猪伪狂犬病病毒、猪细小病毒、猪肺炎支原体)阳性血清进行检测,其OD450nm值分别 为0.174、0.151、0.184、0.193、0.146、0.183,均小于临界值0.348,表明重组蛋白与这6 种病原的阳性血清均无交叉反应,该间接ELISA 方法具有良好的特异性。
2.9.2 敏感性试验 将血清中和试验鉴定的PRRSV 阳性对照血清从1:25 开始进行倍比稀释,采用重组蛋白作为包被抗原进行检测,稀释度为1:12 800 时仍呈阳性,表明该方法敏感性较好。
2.9.3 重复性试验 以不同效价血清稀释50 倍后做平行重复ELISA 检测。结果显示(表8):批内重复变异系数(CV)为2%~10%,批间重复变异系数(CV)小于15%。结果表明,建立的间接ELISA 检测方法具有良好的重复性。

表8 间接 ELISA 重复性试验结果
2.9.4 符合性试验 分别采用本研究建立的间接ELISA 检测方法与血清中和试验,对实验室保存的420 份临床血清样本进行检测。结果显示,该间接ELISA 方法检测的样本阳性率为52.86%,血清中和试验检测的样本阳性率为48.10%,总符合率为95.24%,符合性良好。
3 讨论
本研究成功表达了融合GP5/M 表位抗原。Western Blotting 和BCA 蛋白浓度测定结果表明,融合GP5/M表位抗原在原核系统中得到高效表达。为了快速检测PRRSV,利用融合GP5/M 表位抗原制备ELISA 酶标板。研究发现,包被ELISA 酶标板时,融合GP5/M 表位抗原按50 ng/孔作为包被浓度,临床血清和HRP 标记的抗猪二抗分别按1:50 和1:10 000 稀释,临床血清、HRP 标记的抗猪二抗、底物显色时间分别按30、45、5 min 时,测定的OD450nm值最高。将抗原稀释至5 ng/孔时,OD450nm值仍具有较高值,使用融合GP5/M 表位抗原作为包被抗原时,敏感性和特异性较高,说明其具有较高的现场应用潜力。
PRRSV 结构蛋白GP5 是一种糖基化膜蛋白,可以通过与宿主细胞受体相互作用而在病毒侵入过程中发挥作用[7]。结构蛋白M 是一种非糖基化膜蛋白,可增强GP5 的中和活性,二者通过二硫键相连形成的异二聚体是病毒感染过程中不可或缺的一部分。Van 等[8]研究发现,GP5/M 糖蛋白复合体可与唾液酸依赖的唾液酸黏附素受体结合,促进病毒与细胞受体的识别。Jiang 等[9]研究发现,GP5/M 融合蛋白的免疫应答水平明显高于M 蛋白。基于以上,本研究通过原核表达系统表达的融合GP5/M 表位抗原,具有较强的免疫原性,能更好地检测PRRSV 病毒血清。
自PRRSV 发现以来,结构蛋白一直是人们研究的热点。结构蛋白在病毒感染过程中起着非常重要的作用——参与宿主细胞受体的识别,增强病毒的感染能力,抑制宿主细胞正常的细胞免疫和体液免疫。其中,结构蛋白GP5 一直深受研究人员的青睐,主要原因是糖蛋白GP5 是PRRSV 含量最丰富的包膜糖蛋白,也是中和抗体的关键靶点[10]。Wang等[11]利用GP5 包被ELISA 酶标板,发现GP5 是一种良好的诊断抗原,包被的ELISA 具有较高的特异性,与其他猪病原体并无交叉反应。Du 等[12]研究发现,利用PRRSV GP5 制作的疫苗能够增强宿主细胞粘膜免疫应答反应。以上研究主要针对单一抗原进行了试验,只了解了一种抗原的特性。近年来,很多研究者通过将两种或者三种结构蛋白融合起来,研究融合蛋白的功能及特性。蒋文明等[13]通过串联表达PRRSV GP3、GP4、GP5 蛋白免疫小鼠,发现串联表达的病毒蛋白能够诱导产生更高水平的体液免疫应答反应。Jiang 等[14]发现,融合蛋白GP5/M 能与PRRSV 抗血清特异性反应,临床血清中融合蛋白GP5/M 的ELISA 抗体反应(OD630nm)与其特异性中和滴度之间没有显著相关性。本实验室通过分析PRRSV 结构蛋白GP5和M 的抗原性、亲水性等,选取了病毒结构蛋白GP5 和M 序列的优势位点使基因序列长度更小,剔除了病毒中产生免疫逃逸机制的位点序列,其亲水性、空间结构、免疫效果更佳,这些改变提高了其作为ELISA 抗原使用的灵敏度和特异性。此外,对融合GP5/M 中和表位抗原的认识,为今后研究以GP5/M 为对象研制亚单位疫苗奠定了基础。
近年来,国内外针对PRRSV 中和抗体检测的诊断技术研究较多。目前市场上销售的用于检测PRRSV 抗体的试剂盒主要为国外进口,价格十分昂贵,且不能准确检测动物体内的中和抗体水平,给基层PRRSV 抗体检测和监测工作的开展带来一定困难。本研究以高浓度可溶性的重组中和表位蛋白作为包被抗原,优化建立的间接ELISA 检测方法具有良好的特异性、敏感性与重复性,与其他几种猪源疫病病原的阳性血清无任何交叉反应。取阳性值较高的猪血清进行稀释后测定OD450nm值,同时与血清中和试验做对比,发现符合率达到95.24%,表明该方法具有较好的敏感性和重复性,进一步完善可成为成熟产品,适用于基层PRRSV免疫效果监测等实际工作,具有较强的应用价值和前景。

