星状病毒感染免疫应答机制的研究进展
汪 最 ,李 丽 ,刘 鹏 ,刘丽娜 ,汪 琛 ,杨文君 ,罗青平
(1.湖北省农业科学院畜牧兽医研究所,武汉 430064;2.农业农村部畜禽细菌病防治制剂创制重点实验室,武汉 430064)
星状病毒(Astrovirus,AstV)是一种小型、无囊膜RNA病毒,是婴儿、免疫缺陷人群和老年人发生肠胃炎的主要病因,同时也会导致哺乳动物和禽类患病。星状病毒可以通过口-粪、接触、受污染的食物或水传播[1]。人类患者通常会出现腹泻、呕吐、腹痛和发烧等症状,偶尔也有一些中枢神经系统并发症的报告,如急性弛缓性麻痹、脑膜炎和脑炎[2]。动物感染多数表现为肠胃炎、肾炎,少数鸡、鹅等[3]出现痛风症状,以及牛、貂、鹅等[3-4]神经症状。星状病毒可以跨物种传播且极易发生重组现象。因此研究星状病毒对临床和畜牧养殖业具有重大意义,然而目前为止其依然是研究最少的肠道RNA病毒[5],所以综述星状病毒感染的先天和适应性免疫应答以及星状病毒如何逃避免疫系统是很有必要的。
1 星状病毒感染
星状病毒主要经过粪口途径感染宿主,进入机体后与肠上皮细胞上的某个未知受体结合[6],并通过网格蛋白介导的内吞作用进入细胞[7]。病毒在核内体酸化和成熟的地方发生脱衣壳[7]。研究表明病毒与细胞表面结合的时间约为10 min,病毒脱壳大约需要130 min[7]。在病毒脱壳后,正链RNA会翻译出两个非结构蛋白ORF1a和ORF1b,而这两个多聚蛋白又会被裂解成转录和病毒复制所需的非结构蛋白[8]。负链RNA主要通过转录产生基因组和亚基因组RNA,其结构蛋白ORF2就是由亚基因组RNA编码表达[9]。有学者在双膜上观察到星状病毒粒子,提示这里可能是其复制和装配的场所。星状病毒完成装配后,子代病毒粒子会通过caspase激活的非裂解机制释放到细胞外[10],而这种机制可以通过eIF2α-ATF4-CHOP通路来激活[11](图1)。

图1 星状病毒感染、免疫逃逸以及宿主天然免疫应答模式图Fig.1 Patterns of astrovirus infection,immune escape and host innate immunity
尽管星状病毒被认为是胃肠型病原,但其病毒RNA已在多个非肠道器官和组织中检出(表1)。然而,通过原位分子杂交技术,发现这些组织均呈阴性,表明该病毒只在肠道内复制。原因可能是星状病毒需要通过衣壳蛋白改变肠上皮细胞屏障通透性,破坏肠道紧密连接,使表面受体暴露,从而达到侵入的目的,但仍然需要进一步的研究来证实这个初始结合步骤。
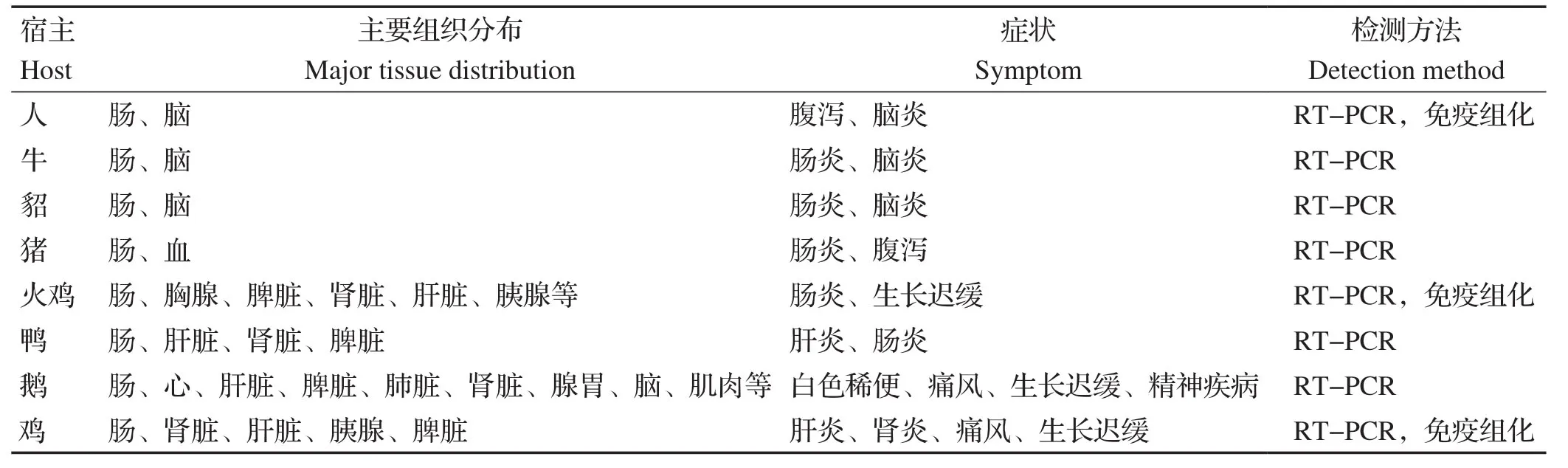
表1 星状病毒的组织分布Table 1 Tissue distribution of AstV
2 天然免疫对星状病毒感染的作用
2.1 诱导型一氧化氮合酶 天然免疫是抵御病原体入侵的第一道防线,可以高效、迅速抑制病毒感染并激活适应性免疫。诱导型一氧化氮合酶(inducible nitric oxide synthase,iNOS)长期以来被认为是天然免疫的关键介质[12]。它在抗癌、抗寄生虫、抗菌和抗病毒反应中都具有重要的作用。研究显示,星状病毒感染火鸡的肠上皮细胞、淋巴细胞和鸡巨噬细胞系HD11均会刺激诱导型一氧化氮合酶的表达及其随后免疫介质NO的增加[13]。使用iNOS抑制剂预处理后,再感染星状病毒,结果火鸡体内和体外的病毒滴度都显著上调[13]。相反,使用亚硝酸盐预处理的星状病毒去感染火鸡,则会显著降低其病毒复制能力[12]。这些数据表明iNOS可以通过产生NO来抑制星状病毒的复制,但NO是如何抑制星状病毒的复制还需要进一步研究。
2.2 Ⅰ型干扰素
2.2.1 抑制病毒复制 许多肠道病毒的复制和传播依赖于肠上皮细胞产生的调节免疫因子,特别是Ⅰ型干扰素。如轮状病毒利用肠上皮细胞产生的Ⅰ型干扰素促进病毒的早期复制。随着细胞培养体系和动物模型的建立,人们才逐步了解Ⅰ型干扰素在AstV感染期间的作用。Guix等[14]发现HAstV感染可以诱导轻微和延迟性的IFN-β上调,接着Marvin等[15]发现肠癌细胞系Caco2感染HAstV 24 hpi,IFN-β的转录和蛋白水平都发生上调,而用UV灭活的病毒和杆状病毒表达的衣壳蛋白刺激Caco2并没有这种现象,表明星状病毒的复制是诱导IFN-β产生的关键。为了确定IFN-I是否影响星状病毒的感染和复制,用HAstV分别感染外源IFN-α和IFN-β预处理的Caco2细胞,发现病毒RNA都显著降低,而用干扰素中和抗体预处理后,病毒 滴度增加了2.5倍[14-15]。通过抑制干扰素调控因子3(interferon regulatory factor 3,IRF3)上游激酶TBK1时,病毒RNA和传染性病毒颗粒增加了2倍[14]。这些结果均提示IFN-I在体外能抑制星状病毒的复制。研究还发现外源IFN-β预处理的Caco2细胞,感染星状病毒8 h和16 h时正链RNA合成受到明显抑制,而1 h和4 h没有观察到这种现象[15],表明IFN-I并不作用于星状病毒的粘附、侵袭阶段,而是通过阻碍正链RNA的合成来抑制星状病毒复制。此外,干扰素受体敲除小鼠IFNaR-/-与野生型小鼠分别感染MuAstV,发现野生组53 dpi粪便中已停止排毒,而敲除组53 dpi排毒量依然处于较高水平[15],这表明在体内IFN-I也能对星状病毒起到清除作用。与I型IFN信号通路类似,信号转换器和激活因子1(STAT1)在限制星状病毒感染方面同样发挥了作用,STAT1基因敲除小鼠(STAT1-/-)感染MuAstV 14 d后,脾脏和肠系淋巴结病毒载量是野生型小鼠的10倍[16]。猜测IFN-I免疫应答激活STAT1通路,进而激活了抗病毒蛋白转录,达到抑制星状病毒复制的目的。
2.2.2 保护屏障通透性 肠上皮细胞可以提供一个屏障,以调节溶质和病原体进出体内,如果调节不当,就可能导致机体腹泻,而星状病毒感染会增加肠上皮细胞的屏障通透性。研究发现体外IFN-β预处理Caco2细胞可以减少HAstV-1诱导产生的跨上皮电阻(transepithelial electrical resistance,TER),并降低惰性染料flux从细胞单层顶端向基底外侧的转运[15]。体内也发现了类似的结果,小鼠感染MuAstV 3 d后,服用 FITC标记的葡聚糖,3 h后测血清荧光强度,结果IFNaR-/-小鼠检测的荧光强度比正常小鼠组高[15]。这些数据表明Ⅰ型IFN体内体外均能对星状病毒引起的肠上皮屏障通透性变大问题起到缓解作用。
3 适应性免疫对星状病毒感染的作用
适应性免疫发生在天然免疫之后,是淋巴细胞在抗原的刺激下对抗原做出的特异性反应。适应性免疫反应包括两个部分:体液免疫和细胞免疫。适应性免疫在控 制星状病毒感染过程中起到重要作用。
3.1 体液免疫 体液免疫是通过产生特异性抗体来达到保护目的的免疫机制。血清学结果显示,绝大多数健康成年人体内都含有针对最流行HAstV血清型的抗体。这种特异性抗体可以通过母婴途径传播给初生儿,母源抗体会持续大概6至8个月[17]。这与早期人类志愿者的临床研究结果一致,大多数没有或仅有轻微临床症状的受试者在受试前体内已产生了抗星状病毒抗体。相反,表现出严重疾病的受试者受试前体内没有抗星状病毒抗体[18]。此外,体液免疫在动物体内也发挥了重要作用,研究发现雏鹅感染星状病毒后的康复血清可以有效中和星状病毒,血清中和效价达到1∶ 3200,而健康鹅血清未表现出任何中和活性[19]。同时,鸡群感染星状病毒后的康复血清也能与病毒发生中和反应,中和效价达到1∶6400[20]。星状病毒衣壳蛋白ORF2的特异性抗体在病毒中和反应中起到至关重要的作用[21]。虽然还不清楚其具体中和机制,但ORF2蛋白的免疫源性极好,免疫重组杆状病毒表达ORF2蛋白后,可有效刺激种鹅产生主动免疫、雏鹅产生被动免疫,攻毒保护率达到100%[22]。由于星状病毒可以跨种传播,宿主也可以产生特异性抗体对抗其他物种的星状病毒。例如,与火鸡密切接触的人会产生抗TAstV的抗体[23]。虽然特异性抗体可以与星状病毒发生中和反应,但星状病毒的血清型繁多,有必要进一步评估所有血清型之间是否存在交叉反应和交叉保护。
3.2 细胞免疫 研究发现,火鸡在感染TAstV-2 21 h后,可以检测到低水平的血清IgG和胆汁IgA,进一步研究发现抗体不能与抗原发生中和反应,且二次感染时也不能提供免疫保护[24]。此外,将感染组与对照组比,T细胞中CD4+/CD8+的比率在5、9和16 dpi时并未发生变化,这表明TAstV-2感染是一个较差的适应性免疫反应诱导因子[24]。与火鸡感染模型不同,小鼠感染模型发现细胞免疫是控制星状病毒感染的关键。Mombaerts等[25]使用MuAstV感染重组激活基因1(rag1)基因敲除小鼠(Rag1-/-),其缺乏成熟的B细胞和T细胞,与野生型小鼠比,Rag1-/-小鼠的粪便和肠道中具有更高的病毒载量,其肾脏、肝脏和肠系膜淋巴结均能检出星状病毒,而野生型小鼠这些器官的检测结果呈阴性,表明野生型小鼠感染和传播星状病毒受到B和T细胞的限制。此外,Molberg等[26]从星状病毒感染的组织学上正常肠组织中检测到了特异性CD4+和CD8+T细胞。所以,有理由推测T细胞在星状病毒感染的免疫反应中发挥重要作用。
越来越多的报道显示,星状病毒可以感染免疫缺陷患者肠道外组织。部分星状病毒分离株已被确定为免疫缺陷患者脑炎的潜在病因。有研究在死于脑炎儿童的中枢神经系统中发现了星状病毒,并认为是骨髓或造血干细胞移植后引起脑炎的病因[27]。此外,星状病毒也在严重免疫缺陷患者鼻咽分泌物、血清和血浆中检测到[28]。所以可以推测是免疫系统限制了星状病毒向其他组织传播,那么免疫系统是如何限制星状病毒向肠外组织的传播也许将成为未来研究的重要问题。
4 星状病毒感染对肠道菌群的影响
大量证据表明肠道病毒可以通过选择细菌或细菌产物来促进其感染。那么肠道菌群在星状病毒感染中扮演什么角色呢?研究发现儿童癌症患者中的星状病毒感染率很高,其中大多数(>89%)正在接受抗菌治疗[29]。此外,在一项对5岁以下患有急性和持续性腹泻的儿童的研究中也发现,未服用抗生素的患者,星状病毒的检出率较低[30]。由于其他因素影响,这些数据并不足以证明菌群在星状病毒感染过程中所起的作用。最近建立的小鼠星状病毒模型对于探索星状病毒与肠道菌群之间的因果关系机制至关重要。Valerie等[31]发现小鼠在感染星状病毒后0、9和21 d引起了肠道菌群组成和多样性的变化。在感染高峰期(第9 d),感染小鼠的肠道菌群多样性降到最低。同时,梭状芽孢杆菌XVⅢ的数量显著增加,直到病毒水平开始下降的第21 d其数量也保持在一个较高水平[31]。研究表明肠道菌群与宿主的免疫应答有密切关系,它能够刺激肠粘膜的杯状细胞分泌黏蛋白,保护黏液层的完整性以及维持肠道屏障功能,所以肠道菌群很可能通过刺激宿主的免疫应答来帮助宿主抵御星状病毒感染。然而,目前还不清楚星状病毒是如何导致肠道菌群发生变化,以及这种变化对宿主的免疫应答产生的影响。因此,以后肠道菌群、宿主和星状病毒三者 之间的相互作用将是研究的热点。
5 免疫逃逸
5.1 抑制补体系统识别 星状病毒可以通过阻止补体激活从而逃避免疫系统。补体系统是天然免疫的重要组成部分,可以识别并清除各种致病菌和病毒。补体系统有三条激活途径:经典激活(classical pathway,CP)、凝集素激活(lectin pathway,LP)和替代激活(alternative pathway,AP)。研究发现星状病毒的衣壳蛋白能够与关键引发分子C1q和MBL结合,抑制经典途径和凝集素途径,阻止下游信号通路激活[32]。由于补体的一个关键作用是引发炎症反应,而星状病毒不引起炎症反应,提示星状病毒抑制补体活化是逃避免疫系统和抑制炎症反应的关键因素。此外,Tam等[33]发现星状病毒感染后补体介导的NF-κB活化水平较低,这表明星状病毒具有逃避补体因子C3检测的方法。补体因子C3可以激活了IRF3的信号通路,从而大量产生IFN-β。这可能就是Guix和Marvin等在感染后期检测I型干扰素水平较低的原因。未来可以通过构建不与补体分子结合的星状病毒突变体去研究感染期间星状病毒抑制补体活化的机制。
5.2 降低巨噬细胞杀菌能力 星状病毒感染能够抑制免疫反应,使宿主更容易受到随后的感染。体外实验表明,星状病毒感染火鸡巨噬细胞降低了巨噬细胞的生存能力以及随后对大肠杆菌的胞内杀伤能力[34]。体内实验表明,从感染TAstV的火鸡中分离的巨噬细胞胞内杀菌能力变弱,同时巨噬细胞所介导的促炎性细胞因子IL-1 和IL-6活性降低,从而使宿主更容易受到继发性细菌感染[34]。此外,感染星状病毒的火鸡血清中能够诱导产生大量的免疫抑制细胞因子(transforming growth factoro β,TGF-β)[34],推测这可能是感染火鸡只出现轻微的组织学病变的原因。然而TGF-β对星状病毒复制的影响以及在免疫应答中的作用还有待研究。
5.3 利用泛素-蛋白酶体系统复制 泛素-蛋白酶体系统(ubiquitin-proteasome pathway,UPS)是细胞的主要降解系统。该系统的主要作用包括错误折叠/受损蛋白的降解以及调控与控制细胞周期进展、蛋白转运、转录、免疫反应和信号转导相关的蛋白水平。其主要由蛋白酶体和泛素蛋白组成。有证据表明蛋白酶体抑制剂能够显著降低了星状病毒病毒RNA和病毒衣壳蛋白合成[35];同样,化学抑制剂或RNAi对泛素蛋白的抑制也显著降低了子代病毒的产生以及衣壳蛋白合成[35]。UPS是星状病毒有效复制所必需的,最有可能参与合成星状病毒病毒gRNA和sgRNA[35]。但星状病毒是如何通过UPS来抑制宿主体内的抗病毒因子水平以及固有的抗病毒信号通路还需要进一步的研究。
6 研究展望
综上所述,虽然我们对星状病毒感染的免疫应答机制有了一定了解,但还需要进一步的研究来描述介导星状病毒感染免疫应答的细胞和分子因素。为了治疗和控制星状病毒引起的疾病,未来可以从以下几个方面研究:了解星状病毒抑制炎症反应的机制;干扰素如何保护肠道的屏障通透性以及掌握星状病毒不同血清型之间的交叉免疫保护情况。此外,近年来肠道菌群的抗病毒、抗癌作用成为了研究热点,充分了解星状病毒、宿主和肠道菌群三者之间的关系,有利于将来通过调节肠道菌群的结构来治疗甚至预防星状病毒感染。

