奶牛围产期脂肪肝的研究进展
赵程禹,邓清华,刘婷
(内蒙古民族大学动物科技学院,通辽 028001)
1 围产期奶牛脂肪肝发病机制
奶牛脂肪肝又称肥胖母牛综合征,最常见于围产期(妊娠前、后3周)母牛。该病为营养代谢紊乱障碍性疾病,可出现肝功能下降、子宫内膜炎、胎衣不下、生产瘫痪等症状,严重的可造成死亡;病症较轻者通常表现为产奶量下降、产犊间隔延长、产弱犊等状况。虽然目前采取科学的集约化养殖全方面提升了围产期奶牛的营养状况,大大缓解了发病症状,但其发病率依旧未能得到控制,治疗效果也不理想,其发病机制尚未明确[1]。
1.1 发病机理
目前大多数学者认为,奶牛脂肪肝是一种由多种因素引起的综合性脂质代谢紊乱性疾病,其中肝脏的脂质过量蓄积是其主要的导火索。处于围产期的奶牛,由于泌乳与自身营养的需求,促进体脂动员,使能量以非酯化脂肪酸(NEFA)的形式大量释放,一部分进入肝脏被氧化供能,另一部分重新合成甘油三酯通过极低密度脂蛋白排出体外[2]。但是对于哺乳动物来说,由于受到普遍存在的产后胰岛素抵抗和能量负平衡等诸多因素影响,释放的NEFA往往远超肝脏承受的最大值,造成脂肪沉积,引发肝功能障碍,降低三羧酸循环和脂蛋白的合成与分解,使机体进入恶性循环,引发脂肪肝。
1.2 发病因素
1.2.1 能量负平衡
能量负平衡是引发围产期奶牛脂肪肝疾病高发的主要因素,由于其经历妊娠-分娩-泌乳启动等生理应激环节及腹腔内胎儿占据的腹内空间逐渐增大,致使奶牛食欲稍有下降,降低了干物质采食量。能量需求量升高,导致营养达到负平衡状态,此时机体为了供给能量,NEFA从脂肪组织中释放出来,转移到肝脏。当达到肝脏存储一定限度时,就会形成酮体,继而出现酮体过度堆积,引发脂肪肝[3]。虽然这些是高产奶牛正常的适应性过程,但由于其对泌乳量的过度需求,临床上往往造成补给不足或短时间补给过量激发多种代谢和传染性疾病,影响奶牛的生产性能[4]。
1.2.2 脂肪组织动员
在能量负平衡的状态下,生命机体必然会启动相关的代谢机制维持机体正常运行,这些分娩期发生的代谢变化称为“衡态调节”,其意义在于使内源性(组织动员的)和外源性(氧化吸收的)营养物质重新分配满足机体需求。
“衡态调节”中通过体脂代谢弥补因糖异生作用而造成的能量亏损是机体重要的调节途径,但过多的体脂代谢使得肝脏摄取NEFA过量。NEFA的代谢主要是通过肝脏内的三羧酸循环代谢和以极低密度脂蛋白(VLDL)形式运出肝脏[5]。肝内三羧酸循环代谢消耗的过程是:NEFA进入肝脏后首先在乙酰辅酶A合成酶作用下经过β-氧化活化为乙酰辅酶A,一部分被彻底氧化释放能量和二氧化碳,二氧化碳随呼吸排出体外;另一部分被部分氧化形成酮体,被周围肝外组织所消耗一部分;还有一部分NEFA在肝脏则以甘油三酯(TG)、磷脂和胆固醇脂的形式合成脂蛋白被肝外组织利用。由于反刍动物肝脏内缺乏足量的脂蛋白脂酶和肝脂酶,NEFA主要靠肝脏内线粒体的β-氧化作用代谢,因此TG在肝脏中大量蓄积形成脂肪肝。但因为奶牛处于特殊的围产期能量负平衡生理阶段,这一途径往往并不能满足生理所需,进而导致NEFA沉积,形成脂肪肝。
1.2.3 激素调节
处于产犊和泌乳高峰的奶牛对葡萄糖的需求量增加,但此时奶牛能量摄入减少,通常葡萄糖摄入量并不能满足机体需求。相反此期间由于催乳素的分泌克服了能量供应不足的影响,使产乳量持续增加,长此以往,会导致机体胰岛素和胰高血糖素水平较低,影响肝脏中脂肪组织的分解[6]。近些年又有研究发现,激素中雌激素、皮质醇、生长激素等也会影响脂肪肝的形成,甚至奶牛分娩期间激素的变化也对其有一定的影响作用[7]。
1.2.4 管理因素
奶牛围产期的饲养管理直接影响奶牛营养和健康状况,管理不当则存在脂肪肝发生的潜在风险。围产期日粮的突然改变或过量饲喂高精料会引起瘤胃酸中毒,从而促进生酮作用,使促炎性细胞因子和内毒素增高进而导致脂肪肝疾病的发生[8]。
另外,围产期奶牛的饲喂舍空间狭小、空气不流通、高温高湿、卫生条件差以及户外活动空间不足、运动量少会引起动物机体释放儿茶酚胺,导致过多脂肪组织的释放而沉积形成脂肪肝[9]。
1.2.5 遗传因素
影响脂肪肝发生的主要遗传因素为调节肝脏和脂肪组织中糖类或脂类代谢以及采食量这三方面基因的突变,尤其是那些参与肝脂形成的基因,增加脂肪分解作用的基因以及减少肝脂中β-氧化、脂质包装和分泌的基因突变性更大[10]。到目前为止,关于肝脏甘油三酯(TG)和脂质含量的遗传力估计值尚未得出有效数据,但对于相关的酮病和真胃变位的遗传力估计值分别为0.32[11]和0.24[12],这或许表明奶牛脂肪肝也同样存在遗传基础[13]。有研究者在用1,3-丁二醇结合限饲诱导的脂肪肝模型中,发现处于围产期的肥胖奶牛发病率更高,这主要是源于围产期处于特殊的能量负平衡阶段[14],而能量负平衡主要是由于营养代谢失衡所导致,其中高产奶牛最为显著。关于其发病因素是否由自身遗传差异所决定仍有待研究。
2 奶牛围产期脂肪肝的诊治
2.1 诊断方法
脂肪肝根据其病程长短可分为轻度、中度、重度三类(表1)。肝脏穿刺组织活检可作出确切诊断,但该法对奶牛损害极大,近年来已被血清学检测和超声方法等新兴技术所取代[15]。
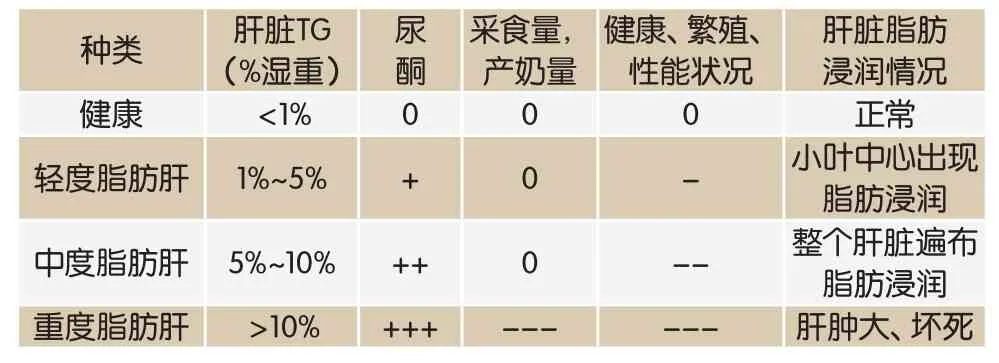
表1 奶牛脂肪肝分类
2.1.1 肝组织取样镜检
选取奶牛第11~12肋间部位采用超声波诊断检测确定肝脏位置、大小、形态及重要血管。穿刺途径的选择原则为距离病灶路径最短,无重要血管、神经及内脏的部位。穿刺前应进行常规的消毒和麻醉处理,如果穿刺次数较多,可以肌注凝血酶原[16]。具体步骤为:将穿刺组织从穿刺针缓慢转移到固定液,保证细胞间未受到挤压,在HE染色中镜检观察肝细胞结构排列是否整齐,肝小叶轮廓是否清晰,如肝小叶可见大量脂滴(LD)可作为判断奶牛脂肪肝的重要依据[17]。在组织学检查中,脂肪肝的特征为肝小叶中央区域存在大的LD,周边区域有较小的LD。轻度脂肪肝奶牛TG的累积仅限于肝静脉附近的肝小叶中央部分,中度和重度脂肪肝TG浸润延伸至肝小叶中段及门静脉[3]。
2.1.2 血液生化指标及肝功能检测
为避免肝组织活检带来的不利影响,国内外学者根据患牛血液生化指标及肝功能检验来诊断奶牛脂肪肝[18]。通过检测病牛血糖、血液NEFA、血液β-羟丁酸 (BHBA)浓度及肝损伤特异性酶活性等指标变化来预测脂肪肝的发生[19]。目前已报道的诊断指标有很多,包括谷氨酸脱氢酶(Glutamate dehydrogenase,GDH)、天门冬氨酸氨基转移酶(Aspartate aminotransferase,AST)、鸟氨酸氨基甲酰转移酶(Ornithine carbamoyl transferase,OCT)、总胆红素(Total bilirubin,TBIL)、NEFA、总胆固醇(TC)、谷氨酸(Glu)、胰高血糖素、甘油三酯(T A G)、游离脂肪酸(FFA)、胰岛素(Insulin,INS)及载脂蛋白等[18]。也有学者认为监测奶牛泌乳早期甲状腺机能的状态可辅助诊断奶牛脂肪肝[18]。Reid等人研究提出奶牛血清中游离脂肪酸、血糖和天门冬氨酸氨基转移酶的浓度按照一定的公式可用于诊断奶牛脂肪肝,即Y=0.510.003N EFA+2.84Glu0.0528AST,当Y<0时为重度脂肪肝,当0 2.1.3 蛋白质组学诊断 蛋白质组学(Proteomics)是以蛋白质为研究对象的科学,可以通过比较健康个体与患病个体血浆中蛋白质成分的差异,筛选差异蛋白质,从而发现疾病的潜在标志物。目前,通过该方法筛选脂肪肝的潜在标志物已成为一个研究热点。其中定量蛋白质组学是将一个基因组表达的全部蛋白质,或复杂的混合样品中所有的蛋白质进行鉴定和定量,可采用iTRAQ技术进行定量。该技术可以同时定量比较4种不同样本中的蛋白质,可用于研究疾病发展过程,或者细胞培养等不同状态下蛋白质表达量的变化,目前在比较蛋白质组学的研究中应用较广泛[20]。有学者通过比较脂肪肝奶牛与健康奶牛的血浆蛋白质谱,也发现了几十种潜在的蛋白标志物,并认为丙酰辅酶A羧化酶和乳酸脱氢酶与奶牛肝脂沉积密切相关[18]。 “围产期”奶牛要经历从妊娠、分娩到泌乳的体内营养代谢和生理应激的最大刺激阶段。在此期间,由于胎儿的生长发育和产后泌乳量的大量需求,奶牛往往会出现能量负平衡状况,影响其自身健康。此时过多饲喂或限饲都会造成机体的亚健康,目前尚未找到特效治疗药物。所以奶牛围产期合理科学的饲养调控是减少脂肪肝疾病损失的最有效措施。 2.2.1 营养调控 通过上述脂肪肝发病因素可以知道,围产期奶牛采食量下降使得机体能量缺乏,但是盲目提高精饲料占比会加剧机体内脂肪组织动员迟缓而造成脂质淤积引发脂肪肝疾病。鉴于围产期奶牛干物质摄入量高峰晚于血糖需求高峰,可以在围产期给予奶牛科学合理的饲喂方式与饲料配比,进而降低发病率。 目前养殖业存在的主要饲喂误区有以下几方面:一是日粮组分不平衡,长期营养摄入不平衡会导致机体内丙氨酸生成量减少影响糖异生途径;二是日粮品质不佳,低质饲料中往往存在大量β-羟丁酸,会降低奶牛采食量,影响机体能量摄入。而为了增加奶牛的营养改用高精饲料,则会严重减弱瘤胃机能,导致瘤胃内微生物死亡,可造成瘤胃内酸中毒和细菌性毒血症,进而诱发脂肪肝[13]。这种由低能饲料向高能饲料的转变就是导致围产期奶牛营养应激的主要因素[21]。 最新研究发现,日粮中添加生物素有利于改善泌乳初期奶牛的生产性能。生物素可改善奶牛肢蹄健康,提高泌乳性能,但生物素对围产期奶牛能量和代谢蛋白平衡状况影响的研究尚少。根据西北农林科技大学团队研究发现,补饲生物素可显著提高奶牛产后第14天血糖浓度及产后第5周产奶量[21]。这一研究仍需后期大量试验加以验证。 2.2.2 基因调控 研究发现,转基因兔过表达载脂蛋白E后,肝脏中极低密度脂蛋白(VLDL)的合成量显著增加。随着载脂蛋白E表达量的提升,VLDL的分泌量也随之增加[22]。Tsukamoto等人通过将人的载脂蛋白E基因转入apoE缺乏的小鼠体内后,肝脏VLDL的合成量增加了4~5倍[23]。Chen指出,载脂蛋白B、载脂蛋白E、可溶性低密度脂蛋白受体、微粒体脂质转运蛋白等均具有调节肝脏脂肪转运的功能。将这些蛋白质的外源基因引入实验动物后都能够促进肝脏内VLDL的合成和分泌,降低肝脏脂肪含量,相比之下,apoE基因对肝脏脂肪转运的促进效果最显著[24]。微粒体甘油三酯转运蛋白MTP在脂肪肝形成过程中是生脂及脂肪沉积中的重要影响蛋白,对MTP的生物学特性、神经内分泌因子和代谢产物对MTP调节的研究,可以通过分子机制上的差异,改良品种及筛选优良性状,预防脂类代谢疾病[25]。 2.2.3 遗传育种 随着分子遗传育种技术的发展,针对类似脂肪肝疾病这种低遗传力的性状,可以通过分子标记辅助育种技术提升奶牛群体的脂肪肝抗病性,培育优质抗病品种,减少奶牛脂肪肝的发生。首先要做的就是对奶牛脂肪肝抗病性状的遗传关系进行研究,找到影响脂肪肝抗病性状的分子标记和候选基因,之后应用于分子标记辅助育种。因此在分子生物学层面研究奶牛脂肪肝的发病机理,并进一步确定有效的治疗策略至关重要[26]。2.2 防治措施

