肝移植术门静脉开放10min内血钾变化及危险因素
栾佳萍 董河 刘爱杰 祝琳 徐庆国
[摘要] 目的 观察肝移植术门静脉开放后10 min内血钾变化趋势,并探讨门静脉开放后发生高钾血症的相关危险因素。方法 收集2019年5—12月于我院行肝移植术100例病人的临床资料,分别于麻醉诱导后(T0)、无肝期末(T1)、门静脉开放即刻(T2)、门静脉开放后20 s(T3)、门静脉开放后40 s(T4)、门静脉开放后1 min(T5)、门静脉开放后2 min(T6)、门静脉开放后5 min(T7)、门静脉开放后10 min(T8)采集动脉血测定血钾浓度,比较门静脉开放前后血钾变化。以门静脉开放后血钾浓度≥5.5 mmol/L病人为高钾组,门静脉开放后血钾浓度<5.5 mmol/L病人为非高钾组。单因素分析高钾组和非高钾组间血钾的差异,Logistic回归模型分析发生高钾血症的相关危险因素。结果 门静脉开放后10 min内血钾浓度呈先升高后降低的趋势。Logistic回归分析显示,冷缺血时间(OR=1.148,P<0.05)、无肝期末血钾(OR=9.759,P<0.05)、供体脂肪肝(OR=1.253,P<0.05)为门静脉开放后10 min内发生高钾血症的独立危险因素。结论 肝移植术新肝期门静脉开放后10 min内血钾浓度起伏大,易导致剧烈血流动力学参数波动,应早期有效预防,减少高钾血症的发生。
[关键词] 肝移植;高钾血症;危险因素;冷缺血;组织供者
[中图分类号] R614.2
[文献标志码] A
[文章编号] 2096-5532(2022)01-0105-05
doi:10.11712/jms.2096-5532.2022.58.026
肝移植术是目前临床上治疗终末期肝病的首选治疗方式[1],围术期血流动力学波动大,特别是在门静脉开放后的短时间内,血钾浓度会发生剧烈变化,导致高钾血症、恶性心律失常、心脏停搏、再灌注后综合征等不良事件的发生[2],因此动态严密监测血钾对维持内环境稳定至关重要。我们在临床工作中观察到,门静脉开放后瞬间升高的血钾会在几分钟内降低甚至发生低钾血症。相关研究针对新肝期血钾监测时间间隔较长,血钾升高和降低的时间点也并不精确[3-4]。本研究拟观察门静脉开放后10 min内血钾变化趋势,并探讨门静脉开放后发生高钾血症的危险因素,为临床预测新肝期血钾异常提供依据。现将结果报告如下。
1 资料和方法
1.1 研究对象
收集2019年5—12月在我院行肝移植术病人100例的临床资料,美国麻醉医师协会分级标准(ASA)分级为Ⅲ或Ⅳ级。纳入标准:①病人行经典原位肝移植术;②病人年龄>18岁;③供肝来自公民逝世后器官捐献。排除标准:①术中临时改行背驮式肝移植的病人;②同时进行肾脏、胰腺、小肠等其他器官移植的病人。根据门静脉开放后10 min内的血钾水平,分为高钾组(血钾浓度≥5.5 mmol/L)、非高钾组(血钾浓度<5.5 mmol/L)。本研究获得医院伦理委员会批准,且与病人或家属签署知情同意书。
1.2 麻醉管理
入室后,病人常规监测心电图(ECG)、脉搏血氧饱和度(SpO2)、无创血压(NIBP),局麻下左右桡动脉穿刺置管分别用于测血压和采集血样本,经右颈内静脉穿刺置入三腔深静脉导管和肺动脉导管(Swan-Ganz導管),分别监测中心静脉压、肺动脉压、肺毛细血管楔压。
麻醉诱导:咪达唑仑0.05 mg/kg、舒芬太尼0.5 μg/kg、丙泊酚1.5~2.5 mg/kg、顺式阿曲库铵0.2 mg/kg,持续泵注丙泊酚和顺式阿曲库铵并间断追加舒芬太尼维持麻醉。采用气管插管全麻,呼吸机设置为吸入氧含量60%~90%,潮气量6~8 mL/kg,呼吸频率10~13 min-1,维持呼气末二氧化碳分压4.67~6.00 kPa。术中根据出血量、血常规和血凝常规及时输注红细胞、血浆和血小板等。根据动脉血气分析结果调整血电解质浓度和呼吸参数,维持酸碱平衡。术中血气分析均采用丹麦雷度ABL90血气分析仪。
1.3 手术过程
病人均行经典原位肝移植术,术前通过对供肝穿刺活检判断其是否为脂肪肝。手术过程分为无肝前期、无肝期和新肝期。无肝期血管吻合前经门静脉灌注4 ℃乳酸钠林格液与清蛋白冲洗。新肝期血管开放的顺序是先肝上下腔静脉、肝下下腔静脉,后门静脉。门静脉开放前15 min内使用甲泼尼龙琥珀酸钠进行免疫抑制治疗,术毕送入ICU。
1.4 观察指标
收集受体病人术前资料,包括年龄、性别、体质量、终末期肝病模型(MELD)评分、血清清蛋白、总胆红素、肌酐(Cr)、尿素氮(BUN)、国际化标准比值(INR)共计9项;术中资料包括无肝期pH值、无肝期剩余碱(BE)、无肝期碳酸氢根离子(HCO-3)、无肝期血钙、冷缺血时间、无肝期尿量、无肝期时间、腹水量、供体是否脂肪肝、麻醉诱导后血钾、无肝期末血钾共计11项;术中补液情况包括门静脉开放前输入胶体量、血浆量及红细胞量共计3项。分别于麻醉诱导后(T0)、无肝期末(T1)、门静脉开放即刻(T2)、门静脉开放后20 s(T3)、门静脉开放后40 s(T4)、门静脉开放后1 min(T5)、门静脉开放后2 min(T6)、门静脉开放后5 min(T7)、门静脉开放后10 min(T8)采集动脉血测定血钾浓度。
1.5 统计学分析
采用SPSS 21.0软件进行统计分析。正态分布计量资料以[AKx-D]±s表示,组间比较采用两独立样本t检验及重复测量数据方差分析;分类资料以频数(百分数)表示,组间比较采用χ2检验或Fisher确切概率法。将单因素分析中差异有显著性的因素纳入Logistic多元回归进行多因素分析。P<0.05表示差异有统计学意义。
2 结 果
2.1 两组病人术前资料分析
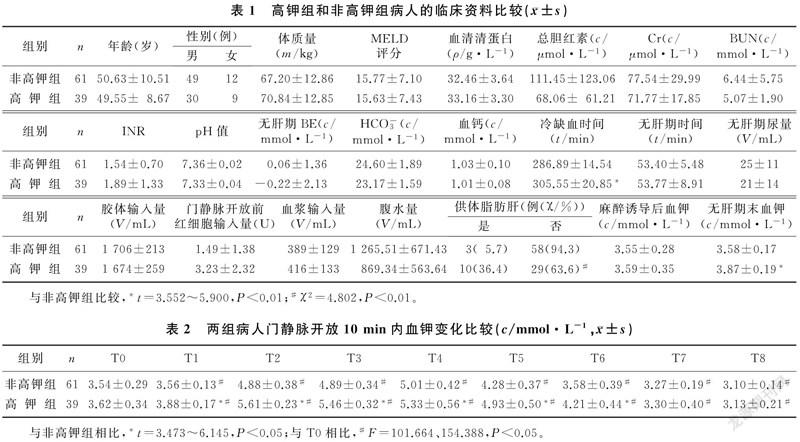
本文100例肝移植病人均成功实施肝移植术,其中男85例,女15例;年龄为26~74岁,平均为(50.21±9.77)岁。肝硬化(包括乙型肝炎性、乙醇性和自身免疫性肝硬化)病人59例(59%),肝细胞癌病人31例(31%),胆管细胞癌5例(5%),急性肝衰竭3例(3%),药物性肝衰竭2例(2%)。两组病人术前临床资料比较差异无统计学意义(P>0.05)。见表1。
2.2 两组病人术中资料分析
新肝期门静脉开放10 min内有39例病人发生高钾血症,有61例病人未发生高钾血症。与非高钾组相比较,高钾组冷缺血时间较长(t=3.982,P<0.01),门静脉开放前输入红细胞量较多(t=3.552,P<0.01),无肝期末血钾浓度较高(t=5.900,P<0.01),供体脂肪肝例数较多(χ2=4.802,P<0.01)。
两组间其他术中指标比较差异无统计学意义(P>0.05)。见表1。
2.3 门静脉开放10 min内的血钾变化
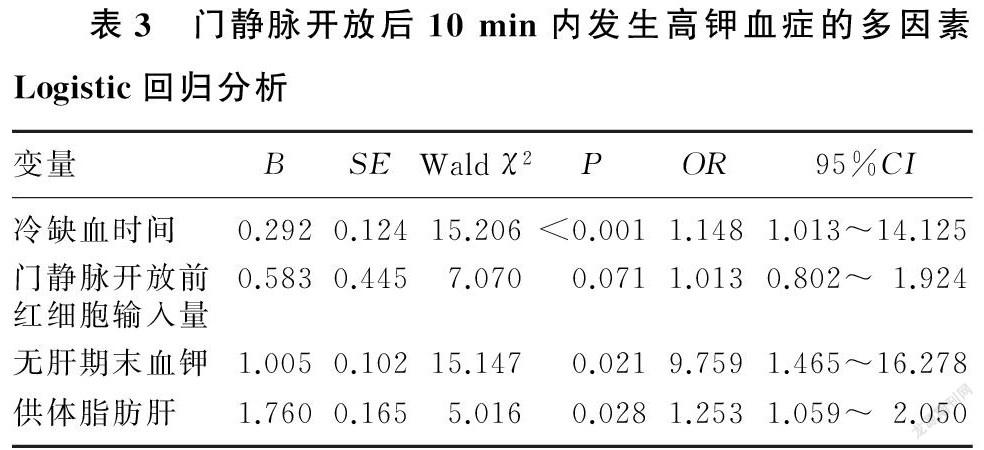
门静脉开放后10 min内,两组病人的血钾浓度均呈先升高后降低的趋势(F时间=283.295,F组别=36.916,F時间×组别=10.239,P<0.05)。与T0相比,两组病人血钾浓度在T1~T6时较高,在T7~T8时较低(F=101.664、154.388,P<0.05)。两组间比较,高钾组血钾在T0、T7和T8时与非高钾组差异无显著性(P>0.05),在T1~T6时均显著高于非高钾组(t=3.473~6.145,P<0.05),其中高钾组有2例病人在门静脉开放后出现心脏停搏,最高血钾浓度达7.1 mmol/L,经心脏复律,术后恢复良好。新肝恢复灌注5 min后,两组共有68例病人血钾低于3.5 mmol/L,最低血钾浓度为2.7 mmol/L,通过补钾治疗,手术结束离开手术室时血钾浓度均在正常范围。见表2。
2.4 门静脉开放后10 min内发生高钾血症的危险因素
以是否发生高钾血症为因变量,以一般临床资料为自变量,将单因素分析确定与高钾血症发生显著相关的因素纳入多因素Logistic回归分析,结果显示,冷缺血时间(OR=1.148,P<0.05)、无肝期末血钾(OR=9.759,P<0.05)、供体脂肪肝(OR=1.253,P<0.05)为门静脉开放10 min内发生高钾血症的独立危险因素,冷缺血时间长的病人发生高钾血症的风险是冷缺血时间短者的1.148倍,无肝期末血钾高的病人发生高钾血症的风险是无肝期末血钾低者的9.759倍,应用脂肪肝供体的病人发生高钾血症的风险是不应用脂肪肝供体者的1.253倍。见表3。
3 讨 论
肝移植术新肝期门静脉开放后急性高钾血症可导致心肌抑制、心律失常和心脏停搏[5],而低钾血症会导致室性心律不齐、代谢性酸中毒、全身肌肉无力等,影响术后恢复[6]。因此,为避免围术期血钾相关不良心血管事件的发生,需要严密监测血钾变化。本研究通过观察100例肝移植病人门静脉开放前后的血钾变化显示,一过性血钾升高均发生于门静脉开放后短暂的40 s内,随后血钾浓度迅速下降,开放后2 min的血钾水平基本恢复正常,有68%的病人在开放后10 min内发生低钾血症,需及时补钾。
本文观察门静脉开放10 min内多个时间点的血钾变化而不再继续延长观察时间的原因如下:①经临床观察,新肝期低血压、心脏停搏等循环系统并发症多发生于门静脉开放后5 min[7];②查阅文献显示,多数文献围绕整个围术期血钾变化进行研究,监测的时间间隔较长,尚缺乏对门静脉开放后血钾变化的精确描述。
针对新肝期高钾血症,已有研究认为与无肝期末下腔静脉和门静脉血钾水平、酸碱状态无关[8-9]。其出现的原因主要有:①无肝期严重代谢性酸中毒导致的细胞外H+交换;②输注红细胞使外源性K+增多;③富含钾的供肝保存液(UW液)在肝脏恢复灌注后进入全身血液循环[10-11];④移植肝细胞内钾释放使门静脉冲洗液中钾浓度升高[12]。而门静脉开放后血钾浓度下降可能与移植肝恢复循环后肝细胞的摄取作用很快恢复以及无肝前期应用胰岛素等降钾措施有关[13-14]。相较于新肝期低钾血症,门静脉开放后快速出现的急性高钾血症对循环系统影响更显著,更易导致心脏停搏等恶性心律失常的发生,因此需要进一步探讨发生高钾血症的危险因素,从而预防其发生。
本研究通过分析100例肝移植病人术前、术中的临床资料显示,无肝期末血钾水平是发生高钾血症的独立危险因素之一,这与既往研究结果一致。NAKASUJI等[15]研究指出,门静脉开放后高钾血症组的血钾水平在手术前、门静脉开放前均明显高于非高钾组。肝移植病人术前肝功能严重受损,多存在水电解质平衡失调、钾平衡紊乱,无肝期常规使用钙剂、碳酸氢钠、呋塞米等药物改善内环境。有研究表明,即使病人术前存在胰岛素抵抗,无肝期葡萄糖伍用胰岛素可以在15 min内有效降低血钾浓度,且其作用能持续1 h以上,可明显减小门静脉开放即刻血钾上升峰度[16-17]。
冷缺血时间是指供肝从供体取下,经4 ℃ UW液保存,到受体门静脉开放恢复肝脏灌注的时间。缺血再灌注损伤被认为是再灌注早期高钾血症的主要机制之一[10]。细胞内外钾离子平衡需要完整的细胞膜,冰冷的保存液会进行性地破坏肝细胞膜,增强渗透性,并破坏Na+-K+-ATP酶活性,使细胞内的钾外流。在供肝严重受损的情况下,受体高钾血症可以作为缺血再灌注损伤程度的标志[11]。有动物实验表明,供肝保存不佳与再灌注后血钾升高密切相关[18]。本研究结果证实,冷缺血时间延长是门静脉开放后发生高钾血症的独立危险因素。此外,还有研究显示,冷缺血时间延长还会损伤供肝再生功能,导致肝移植术后不良结局的发生[19-20]。因此,更好地缩短冷缺血时间是改善病人新肝期电解质紊乱的有效措施。
随着临床肝移植技术的推广应用,由于供肝短缺,人们不得不选择边缘供肝——脂肪肝扩展肝源。在公民逝世器官捐献中,脂肪变性供肝占比高达50%[21]。一项收集了5 051例肝移植病人数据的研究显示,使用大泡性脂肪变性>30%供肝的病人术后1年移植存活率明显降低[22]。由于能量储备少,再灌注后恢复ATP水平的能力下降,Kupffer细胞功能障碍,白细胞黏附增加和脂质氧化增加,脂肪肝更容易发生缺血再灌注损伤[23]。本研究显示,新肝期高钾组病人使用脂肪肝供体的例数明显多于非高钾组;多因素Logistic回归分析显示,供体脂肪肝是门静脉开放后发生高钾血症的独立危险因素。边缘供肝是一宝贵资源,如何更加安全、合理地利用这一资源还需进一步探索。
有研究显示,术中输注红细胞也是导致肝移植术中高钾血症的独立危险因素[2]。而本文多因素分析结果表明,门静脉开放前红细胞输入量并不是门静脉开放后发生高钾血症的独立危险因素,考虑本文结果为单中心数据分析,因此可能与其他中心结果存在一定差异,需要进一步进行多中心研究。
本研究存在以下局限性:①未对入组病人进行术后随访观察,无法得知高钾血症是否会增加术后并发症,降低病人生存率;②未检测供肝释放的其他会导致心肌抑制的酸性物质和炎性递质,高钾血症是否与之有关需要进一步研究;③单中心回顾性研究存在选择偏倚,样本数量较少,可能會影响结果的准确性。
综上所述,无肝期末血钾、冷缺血时间以及供体脂肪肝是经典原位肝移植门静脉开放后发生高钾血症的独立危险因素。因此,为了避免门静脉开放后10 min内血钾变化引起的剧烈血流动力学参数波动,在无肝期应该维持正常低限血钾水平,尽量缩短冷缺血时间,优化脂肪肝供体的应用。
[参考文献]
[1]YAZIGI N A. Long term outcomes after pediatric liver transplantation[J]. Pediatric Gastroenterology, Hepatology & Nutrition, 2013,16(4):207-218.
[2]JUANG S E, HUANG C E, CHEN C L, et al. Predictive riskfactors in the development of intraoperative hyperkalemia in adult living donor liver transplantation[J]. Transplantation Proceedings, 2016,48(4):1022-1024.
[3]高玲,Michael J.Bookallil. 43例原位肝移植病人手术中血电解质浓度的变化[J]. 中华麻醉学杂志, 1998(3):138-140.
[4]张秀生,张裕霞,杜洪印,等. 原位肝移植100例麻醉处理[J]. 中华麻醉学杂志, 2003,23(7):545-547.
[5]JAWAN B, WANG C H, CHEN C L, et al. Review of anesthesia in liver transplantation[J]. Acta Anaesthesiologica Taiwanica, 2014,52(4):185-196.
[6]XIA V W, DU B, TRAN A, et al. Intraoperative hypokalemia in pediatric liver transplantation: incidence and risk factors[J]. Anesthesia and Analgesia, 2006,103(3):587-593.
[7]VALENTINE E, GREGORITS M, GUTSCHE J T, et al. Clinical update in liver transplantation[J]. Journal of Cardiothoracic and Vascular Anesthesia, 2013,27(4):809-815.
[8]王亮,薛玉良,杜洪印,等. 肝移植术中门静脉血酸碱及电解质的临床观察[J]. 天津医药, 2008,36(8):641-642.
[9]王亮,薛玉良,杜洪印. 经典非转流肝移植术中下腔静脉血酸碱及电解质变化[J]. 天津医药, 2008,36(7):496-498.
[10]ZHANG W J, XIA W L, PAN H Y, et al. Postreperfusion hyperkalemia in liver transplantation using donation after cardiac death grafts with pathological changes[J]. Hepatobiliary & Pancreatic Diseases International: HBPD INT, 2016,15(5):487-492.
[11]PATRONO D, ROMAGNOLI R. Postreperfusion syndrome, hyperkalemia and machine perfusion in liver transplantation[J]. Translational Gastroenterology and Hepatology, 2019,4:68.
[12]ZHANG L, TIAN M, SUN L Y, et al. Association between flushed fluid potassium concentration and severe postreperfusion syndrome in deceased donor liver transplantation[J]. Medical Science Monitor: International Medical Journal of Experimental and Clinical Research, 2017,23:5158-5167.
[13]恽惠方,费卫东,沈跃华,等. 经典原位肝移植术中血电解质、酸碱和血糖变化及处理[J]. 江苏大学学报(医学版), 2004,14(6):507-508.
[14]朱伟,朱敏敏,田伟千,等.原位肝移植围术期血液酸碱和电解质变化[J]. 临床麻醉学杂志, 2008,24(8):670-672.
[15]NAKASUJI M, BOOKALLIL M J. Pathophysiological mechanisms of postrevascularization hyperkalemia in orthotopic liver transplantation[J]. Anesthesia and Analgesia, 2000,91(6):1351-1355.
[16]DE WOLF A, FRENETTE L, KANG Y, et al. Insulin decreases the serum potassium concentration during the anhepa-tic stage of liver transplantation[J]. Anesthesiology, 1993,78(4):677-682.
[17]李泉,周脉涛,俞卫锋,等. 肝移植术病人胰岛素复合葡萄糖预先给药对新肝再灌注后高钾血症的作用[J]. 中华麻醉学杂志, 2004,24(9):73-74.
[18]ABOUNA G M, ALDRETE J A, STARZL T E. Changes in serum potassium and pH during clinical and experimental liver transplantation[J]. Surgery,1971,69(3):419-426.
[19]CLAVIEN P A, PETROWSKY H, DEOLIVEIRA M L, et al. Strategies for safer liver surgery and partial liver transplantation[J]. The New England Journal of Medicine, 2007,356(15):1545-1559.
[20]JEONG S M. Postreperfusion syndrome during liver transplantation[J]. Korean Journal of Anesthesiology, 2015,68(6):527-539.
[21]MIKOLASEVIC I, FILIPEC-KANIZAJ T, MIJIC M, et al. Nonalcoholic fatty liver disease and liver transplantation—Where do we stand[J]? World Journal of Gastroenterology, 2018,24(14):1491-1506.
[22]SPITZER A L, LAO O B, DICK A A S, et al. The biopsied donor liver: incorporating macrosteatosis into high-risk donor assessment[J]. Liver Transplantation, 2010,16(7):874-884.
[23]SINISCALCHI A, GAMBERINI L, LAICI C, et al. Post reperfusion syndrome during liver transplantation: From pathophysiology to therapy and preventive strategies[J]. World Journal of Gastroenterology, 2016,22(4):1551-1569.
(本文編辑 黄建乡)
3161500338277

