低分子量褐藻多糖硫酸酯对小鼠动脉粥样硬化影响
汪贯习 周缜 王悦 梁凤 李洪波 徐颖婕
[摘要] 目的 探讨低分子量褐藻多糖硫酸酯(LMWF)对小鼠动脉粥样硬化(AS)作用。方法 选择ApoE(-/-)雄性小鼠40只,随机分为对照组、模型组、阳性对照组和治疗组,每组10只。模型组、阳性对照组和治疗组应用高脂饲料喂养,对照组应用普通饲料喂养。阳性对照组和治疗组小鼠分别给予普罗布考和LMWF 0.5 mL灌胃干预治疗,对照组和模型组小鼠同步给予体积分数0.02橄榄油0.5 mL灌胃。采用生物化学方法检测小鼠血清三酰甘油(TG)、总胆固醇(TC)、低密度脂蛋白胆固醇(LDL-C)和高密度脂蛋白胆固醇(HDL-C)水平,酶联免疫吸附法(ELISA)检测血清氧化低密度脂蛋白(ox-LDL)水平,油红O染色和苏木精-伊红染色方法检测动脉内膜粥样硬化斑块的面积和结构,TUNEL法检测动脉内膜细胞凋亡情况。结果 与对照组比较,模型组小鼠血清TG、TC、LDL-C和ox-LDL水平显著升高,而HDL-C显著降低(F=21.98~114.31,P<0.05);与模型组比较,阳性对照组和治疗组小鼠血清TG、TC、LDL和ox-LDL水平显著降低,HDL水平显著升高(P<0.05);治疗组小鼠TG、TC、LDL-C和ox-LDL水平明显低于阳性对照组,而HDL-C水平明显高于阳性对照组(P<0.05)。治疗组小鼠动脉粥样斑块的面积较模型组显著缩小(F=595.39,P<0.01),动脉内膜结构显著改善(F=122.16,P<0.05),动脉内膜的细胞凋亡程度显著降低(F=8 128.51,P<0.01)。结论 LMWF能调控ApoE(-/-)小鼠体内脂质代谢紊乱,抑制粥样硬化斑块的形成,减缓AS的发展。
[关键词] 动脉粥样硬化;褐藻多糖硫酸酯;胆固醇,LDL;细胞凋亡;小鼠
[中图分类号] R282.72
[文献标志码] A
[文章编号] 2096-5532(2022)01-0068-05
doi:10.11712/jms.2096-5532.2022.58.028
动脉粥样硬化(AS)是心脑血管疾病的病理学基础[1],AS发生发展涉及大量炎性细胞和细胞因子[2],炎性细胞和细胞因子促进了斑块的形成[3]。低密度脂蛋白(LDL)滞留在血管内膜下是AS的主要病理机制,富含胆固醇的载脂蛋白聚糖上的糖胺聚糖能够通过LDL激活免疫应答启动炎症级联反应[4]。脂质氧化作用可以导致具有生物活性的脂类释放,其中的LDL颗粒可以被修饰成为氧化LDL(ox-LDL)[5],引起内皮细胞功能紊乱、炎性因子的释放,促进血管平滑肌细胞(VSMC)迁移和泡沫细胞的形成,最终形成AS斑块[6]。研究证实,心血管疾病病人血浆ox-LDL水平明显升高,活性氧(ROS)的产生能够导致LDL的氧化,而ox-LDL又能促进内皮细胞、VSMC和巨噬细胞中ROS的形成[7-8]。褐藻中提取的天然产物褐藻多糖硫酸酯,尤其是低分子量褐藻多糖硫酸酯(LMWF)具有众多高效的生物活性[9],其对内皮细胞和巨噬细胞有一定的调控作用[10]。本文研究LMWF对高脂饮食诱导的ApoE(-/-)小鼠[11]血脂代谢和AS斑块形成的影響,探讨LMWF是否有抗AS的作用。
1 材料与方法
1.1 实验材料
海藻提取物LMWF样品由中国科学院海洋研究所张全斌研究员提供,主要成分为高度硫酸化的α-L-岩藻糖和D-半乳糖及少量D-甘露糖、D-木糖、D-鼠李糖、D-葡萄糖、D-阿拉伯糖和糖醛酸[9]。SPF级7周龄ApoE(-/-)雄性小鼠40只,体质量为20~24 g,北京华阜康生物科技有限公司提供,饲养于青岛大学动物实验中心,室温(22±2)℃、湿度(60±5)%,12 h /12 h明暗周期,自由饮食。标准高脂块状饲料,每100.00 g含脂肪21.00 g、胆固醇0.15 g。
1.2 实验方法
ApoE(-/-)小鼠适应性喂养1周后,随机分为对照组(A组)、模型组(B组)、阳性对照组(C组)和治疗组(D组),每组10只。对照组:小鼠普通饲料喂养,0.5 mL橄榄油(体积分数0.02)灌胃给药;治疗组:高脂饲料喂养,200 mg/kg LMWF(用体积分数0.02橄榄油溶解至0.5 mL)溶液灌胃;阳性对照组:高脂饲料喂养,200 mg/kg普罗布考(Probucol,用体积分数0.02橄榄油溶解至0.5 mL)溶液灌胃给药;模型组:高脂饲料喂养,体积分数0.02橄榄油0.5 mL灌胃。各组给药均隔日1次,连续16周。
1.3 检测指标及方法
1.3.1 血脂检测 给药结束后第2天,100 g/L水合氯醛腹腔注射麻醉小鼠,经心脏取血1 mL,生化采血管收集,静置3 h,以4 000 r/min离心10 min,分离血清。全自动生化分析仪(AU 5800,贝克曼库尔特有限公司)检测血清三酰甘油(TG)、总胆固醇(TC)、低密度脂蛋白胆固醇(LDL-C)和高密度脂蛋白胆固醇(HDL-C)水平。
1.3.2 血清ox-LDL检测 应用ox-LDL ELISA试剂盒(Bio-Maide公司)检测,按说明书操作。每个样品孔先加40 μL样品稀释液,后加10 μL样品。每孔加50 μL显色剂A和50 μL显色剂B,于37 ℃避光静置15 min。终止显色反应。以空白孔调零,Spectramax M5多功能酶标仪测定450 nm波长处各孔吸光度,制作标准曲线,计算ox-LDL浓度。
1.3.3 AS粥样斑块面积检测 用油红O染色方法。经心脏取血后,每组随机取小鼠5只,分别切取主动脉1 cm,纵行剖开展平,置于40 g/L多聚甲醛固定2 h,流水冲洗,油红O染色5 min,体积分数0.60异丙醇分化5 s,苏木精复染2 min。甘油明胶封固。光镜下观察AS斑块位置,计算斑块面积。
1.3.4 AS粥样斑块病理结构观察 采用苏木精-伊红(HE)染色方法。经心脏取血后,每组取剩余小鼠5只,分别切取主动脉1 cm,置40 g/L多聚甲醛固定2 h,流水冲洗后用OCT包埋,液氮速冻。冷冻切片机(HM 505E,德国美康有限公司)连续切片,厚度10 μm,贴于多聚赖氨酸处理的载玻片上。苏木精染色5 min,盐酸乙醇分化5 s,伊红染色90 s。常规脱水、透明、封片。光镜下观察,粥样斑块呈红褐色,观察AS斑块位置并计算斑块面积。
1.3.5 细胞凋亡检测 采用In Situ细胞凋亡试剂盒(罗氏有限公司)检测,按说明书方法操作。荧光显微镜(Olympus BX53,Japan)下450~500 nm波长处观察,凋亡细胞呈绿色荧光。随机观察5个视野,测定吸光度值,取均值,以其表示细胞凋亡情况。
1.4 统计学分析
采用SPSS 13.0 软件进行统计学处理。计量资料结果以[AKx-D]±s表示,多组均数间比较采用单因素方差分析,两两比较采用SNK(Students-Newman-Keuls)法。以P<0.05 为差异有统计学意义。
2 结 果
2.1 各组小鼠血脂水平比较
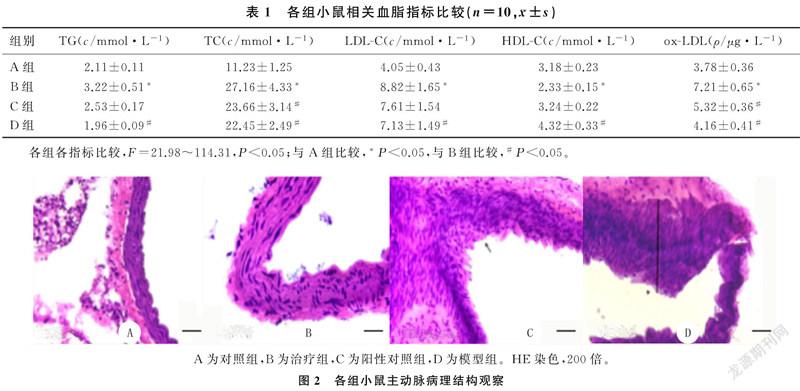
各组小鼠血清TG、TC、LDL-C、HDL-C水平比较,差异有显著性(F=21.98~114.31,P<0.05),其中模型组TG、TC、LDL-C水平较对照组显著升高,而HDL-C显著降低(P<0.05);阳性对照组和治疗组TG、TC和LDL-C水平较模型组均明显降低,而HDL-C水平升高(P<0.05);治疗组小鼠TG、TC、LDL-C水平明显低于阳性对照组,而HDL-C水平明显高于阳性对照组(P<0.05)。各组小鼠血清ox-LDL水平比较差异有显著性(F=111.79,P<0.05),其中模型组ox-LDL水平较对照组显著升高(P<0.05),而治疗组与阳性对照组血清ox-LDL水平较模型组均显著降低,且治疗组下降更为显著(P<0.05)。见表1。
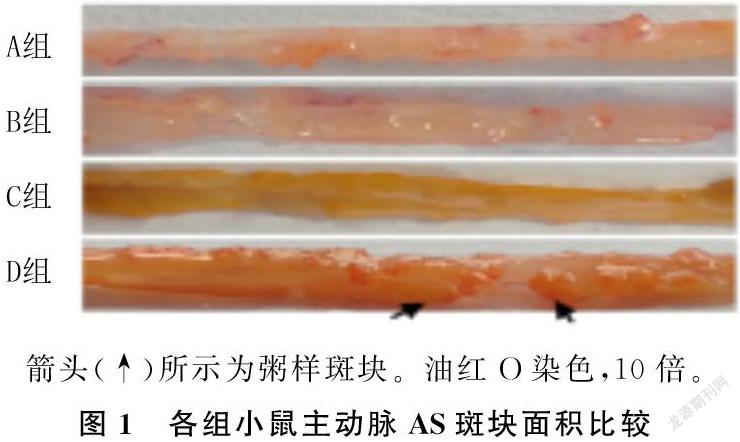
2.2 各组主动脉AS斑块面积比较
油红O染色显示,对照组小鼠主动脉可见散在的橘红色AS斑点,面积为(53±5)mm2;模型组出现明显的大片状AS斑块,面积为(230±16)mm2;阳性对照组的AS斑块呈现条纹状,面积为(116±10)mm2;治疗组小鼠的AS斑块呈散点状,面积为(75±6)mm2。各组AS斑块面积比较,差异有显著性(F=595.39,P<0.01),其中治疗组与阳性对照组小鼠斑块面积均较模型组减小(P<0.05),且治疗组减小更为显著(P<0.05)。见图1。
2.3 各组主动脉病理结构比较
HE染色显示,对照组小鼠主动脉内膜光滑,未见明显的病理改变;模型组小鼠主动脉内膜增厚、粗糙,出现明显的红褐色AS斑块,斑块面积为(165±25)μm2;治疗组主动脉内膜变薄,斑块面积为(68±5)μm2;阳性对照组主动脉内膜斑块面积为(93±11)μm2。治疗组、阳性对照组主动脉内膜粥样斑块面积与模型组比较均显著性減小(F=122.16,P<0.05),尤其是治疗组动脉内膜相对光滑,粥样硬化斑块面积显著低于阳性对照组(P<0.01)。见图2。
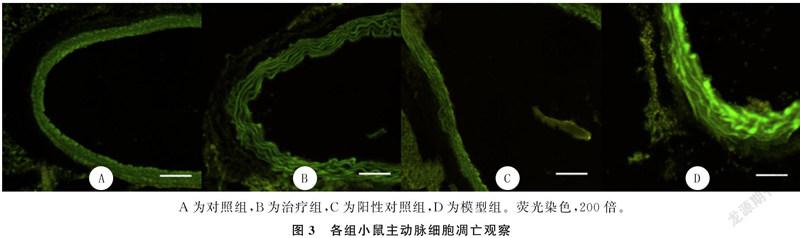
2.4 各组主动脉内膜细胞凋亡比较
荧光显微镜下观察,对照组小鼠主动脉内膜光滑;模型组小鼠主动脉内膜凹凸不平,出现凋亡细胞,血管壁内膜处细胞凋亡尤为明显;治疗组与阳性对照组小鼠动脉壁的细胞凋亡荧光强度显著减弱。对照组吸光度值为105±7,模型组为760±85,治疗组为150±12,阳性对照组为170±16,4组吸光度值比较差异有统计学意义(F=8 128.51,P<0.01),其中任意两组比较差异均具有统计学意义(P<0.05)。见图3。
3 讨 论
目前研究普遍认为,AS是由遗传和环境等多种危险因素共同作用引起的疾病,高脂血症、高血压、肥胖、吸烟、年龄和糖尿病等是AS的传统危险因素[12]。起初人们对AS的认识只限于AS是脂质堆积造成的动脉管壁堵塞而已,但近年实验研究和临床试验证明,炎症反应在AS及其并发症中发挥重要作用。目前有多种学说从不同角度探讨了AS的发生机制和病理过程,例如炎症学说、氧化应激学说、脂质渗入学说、平滑肌突变学说和内皮损伤学说等[13-15]。AS发生的起始阶段,主动脉、冠状动脉和脑动脉等大动脉部位脂质堆积并持续增加,其分支点和弯曲区极易形成AS斑块,循环的脂蛋白颗粒浸润至这些区域的动脉管壁,干扰局部内皮细胞正常功能,导致脂质及炎症因子在动脉内膜堆积,促进了AS斑块的产生[16]。AS斑块一旦破裂,会引起一系列急性临床疾病的发生,如脑卒中和急性心肌梗死等,导致病人瘫痪或者死亡。
AS是心脑血管疾病的病理学基础,其发生发展涉及大量炎性细胞和细胞因子。在AS早期,内皮功能障碍和脂质代谢紊乱会导致内皮细胞活化和细胞通透性的改变[4]。TG、TC、LDL-C和HDL-C是AS主要的临床生化评价指标,在AS的发生发展过程中具有关键作用[7]。ApoE(-/-)纯合子小鼠是被公认的一种AS血管损伤模型,具有形成AS的基础,经高脂饲料喂养一定时间后,就会出现典型的AS症状体征、血生化及血管病理改变[17]。本研究应用高脂饲料喂养ApoE(-/-)小鼠,结果显示,模型组小鼠血清TG、TC和LDL-C水平较对照组均显著升高,而HDL-C水平则显著降低,说明AS动物模型构建是成功的;治疗组TG、TC和LDL-C水平较模型组均明显降低,而HDL-C水平升高;治疗组小鼠TG、TC、LDL-C水平明显低于阳性对照组,而HDL-C水平明显高于阳性对照组,说明LMWF具有与普罗布考同样的降脂作用,且LMWF的降脂作用更为明显。
在AS的發生发展过程中,内皮细胞通透性改变,ox-LDL积累在内皮细胞下,刺激单核细胞分化为巨噬细胞,进而导致平滑肌细胞增生和迁移、血小板聚集、白细胞黏附和炎症细胞因子的释放等变化,促进了AS发生发展过程[18]。其中,巨噬细胞吞噬过量产生的ox-LDL形成泡沫细胞,泡沫细胞以坏死核为中心沉积在坏死核周围形成脂纹,最终发展为AS斑块[19]。LMWF具有多种生物学活性如抗氧化、抗炎性、抗血栓以及保护内皮细胞功能等[20]。本研究油红O染色和HE染色结果均表明,模型组小鼠形成了明显的AS斑块;与模型组比较,治疗组AS斑块面积减少,说明LMWF对AS小鼠主动脉的损伤有明显的抑制和改善作用,以此减缓AS的发生发展。提示LMWF可能通过抗氧化作用抑制AS的发生和发展。
游离的TG、TC、LDL-C和ox-LDL是强促炎性刺激因子,可引起更多巨噬细胞的聚集,脂质(TG和TC)、巨噬细胞、平滑肌细胞、细胞外基质、钙和坏死碎片构成了AS斑块的主要成分[21]。LMWF能够调节脂质代谢过程,抑制血管平滑肌细胞的迁移和内膜增生,减弱内皮细胞介导的血管生成过程而防治AS斑块的形成[22]。本文的研究结果显示,LMWF与传统降脂药物普罗布考的作用相似,能够降低血清TG、TC、LDL-C和ox-LDL水平,提高HDL-C的水平,而且治疗组小鼠TG、TC、LDL-C水平显著低于阳性对照组,HDL-C水平显著高于阳性对照组,提示LMWF可作为潜在的降脂药物。细胞凋亡可导致内皮细胞死亡和巨噬细胞浸润,凋亡的巨噬细胞会促进脂纹的产生,最后形成AS斑块[23-24]。本研究结果显示,LMWF还能明显抑制ApoE(-/-)小鼠动脉壁内膜的细胞凋亡,减少巨噬细胞的浸润,减缓AS的发展。
综上所述,LMWF能调控ApoE(-/-)小鼠体内脂质代谢紊乱,通过抗氧化机制,抑制细胞凋亡和粥样硬化斑块的形成,减缓AS的发展。
[参考文献]
[1]AFROZ R, CAO Y N, ROSTAM M A, et al. Signalling pathways regulating galactosaminoglycan synthesis and structure in vascular smooth muscle: implications for lipoprotein binding and atherosclerosis[J]. Pharmacology & Therapeutics, 2018,187:88-97.
[2]TOUSOULIS D, OIKONOMOU E, ECONOMOU E K, et al. Inflammatory cytokines in atherosclerosis: current therapeutic approaches[J]. European Heart Journal, 2016,37(22):1723-1732.
[3]LIANG W J, WANG Q, MA H, et al. Knockout of low molecular weight FGF2 attenuates atherosclerosis by reducing macrophage infiltration and oxidative stress in mice[J]. Cellular Physiology and Biochemistry, 2018,45(4):1434-1443.
[4]BORN J, WILLIAMS K J. The central role of arterial retention of cholesterol-rich apolipoprotein-B-containing lipoproteins in the pathogenesis of atherosclerosis: a triumph of simplicity[J]. Current Opinion in Lipidology, 2016,27(5):473-483.
[5]MOLLACE V, GLIOZZI M, MUSOLINO V, et al. Oxidized LDL attenuates protective autophagy and induces apoptotic cell death of endothelial cells: role of oxidative stress and LOX-1 receptor expression[J]. International Journal of Cardiology,2015,184:152-158.
[6]SUCIU C F, PRETE M, RUSCITTI P, et al. Oxidized low density lipoproteins: the bridge between atherosclerosis and autoimmunity. Possible implications in accelerated atherosclerosis and for immune intervention in autoimmune rheumatic disorders[J]. Autoimmunity Reviews, 2018,17(4):366-375.
[7]KATTOOR A J, POTHINENI N V K, PALAGIRI D, et al. Oxidative stress in atherosclerosis[J]. Current Atherosclerosis Reports, 2017,19(11):1-11.
[8]FRSTERMANN U, SESSA W C. Nitric oxide synthases: regulation and function[J]. European Heart Journal, 2012,33(7):829-837.
[9]WANG J, ZHANG Q B, ZHANG Z S, et al. Antioxidant activity of sulfated polysaccharide fractions extracted from Laminaria japonica[J]. International Journal of Biological Macromolecules, 2008,42(2):127-132.
[10]ZHAO X, DONG S Z, WANG J F, et al. A comparative stu-dy of antithrombotic and antiplatelet activities of different fucoidans from Laminaria japonica[J]. Thrombosis Research, 2012,129(6):771-778.
[11]OHTA H, WADA H, NIWA T, et al. Disruption of tumor necrosis factor-alpha gene diminishes the development ofatherosclerosis in ApoE-deficient mice[J]. Atherosclerosis, 2005,180(1):11-17.
[12]李靓,谢巍,姜志胜,等. 我国动脉粥样硬化基础研究近三年进展[J]. 中国动脉硬化杂志, 2015,23(11):1182-1188.
[13]张运. 关于动脉粥样硬化(AS)的新治疗靶点[J]. 医学研究杂志, 2011,40(6):1-3.
[14]WONG B W, MEREDITH A, LIN D, et al. The biological role of inflammation in atherosclerosis[J]. Canadian Journal of Cardiology, 2012,28(6):631-641.
[15]HANSSON G K, HERMANSSON A. The immune system in atherosclerosis[J]. Nature Immunology, 2011,12(3):204-212.
[16]PANT S, DESHMUKH A, GURUMURTHY G S, et al. Inflammation and atherosclerosis—revisited[J]. Journal of Cardiovascular Pharmacology and Therapeutics, 2014,19(2):170-178.
[17]魯晓丽,杨文,徐璐,等. ApoE-/-小鼠的繁殖与鉴定[J]. 实验动物科学, 2016,33(1):29-32,37.
[18]FENG Z B, YANG X F, ZHANG L, et al. Ginkgolide B ameliorates oxidized low-density lipoprotein-induced endothelial dysfunction via modulating Lectin-like ox-LDL-receptor-1 and NADPH oxidase 4 expression and inflammatory cascades[J]. Phytotherapy Research: PTR, 2018,32(12):2417-2427.
[19]WANG M Y, MONTICONE R E, MCGRAW K R. Proinflammatory arterial stiffness syndrome: a signature of large arterial aging[J]. Journal of Vascular Research, 2018,55(4):210-223.
[20]YANG W Z, YU X F, ZHANG Q B, et al. Attenuation of streptozotocin-induced diabetic retinopathy with low molecular weight fucoidan via inhibition of vascular endothelial growth factor[J]. Experimental Eye Research, 2013,115:96-105.
[21]XU Y J, XU J, GE K L, et al. Anti-inflammatory effect of low molecular weight fucoidan from Saccharina japonica on atherosclerosis in apoE-knockout mice[J]. International Journal of Biological Macromolecules, 2018,118(Pt A):365-374.
[22]MATOU S, HELLEY D, CHABUT D, et al. Effect of fucoidan on fibroblast growth factor-2-induced angiogenesis in vitro[J]. Thrombosis Research, 2002,106(4-5):213-221.
[23]OSONOI Y, MITA T, AZUMA K, et al. Defective auto-phagy in vascular smooth muscle cells enhances cell death and atherosclerosis[J]. Autophagy, 2018,14(11):1991-2006.
[24]XU Y J, ZHU W L, WANG T T, et al. Low molecule weight fucoidan mitigates atherosclerosis in ApoE(-/-) mouse model through activating multiple signal pathway[J]. Carbohydrate Polymers, 2019,206:110-120.
(本文编辑 黄建乡)
3582500338290

