芙朴感冒颗粒中橙皮苷小肠吸收特征研究
余蓓萌,周 萍,潘海滔,徐人杰*
0 引言
芙朴感冒颗粒的配方组成源于著名中医学家吴士元,以中药材木芙蓉叶(900 g)、牛蒡子(250 g)、厚朴(150 g)和陈皮(250 g)为原料,经过提取加工制成,临床用于治疗风热或风热挟湿感冒引起的发热头痛、咽痛、肢体酸痛、鼻塞、胃纳减退,为儿科常用药[1-2]。橙皮苷(图1)是芙朴感冒颗粒中最重要的糖苷类化合物之一,是陈皮的主要活性成分[3]。药理研究表明,橙皮苷具有镇静、抗惊厥、提高免疫力、抗抑郁和解毒等作用[4-5]。
已有研究表明,橙皮苷的绝对生物利用度偏低,静脉给药后大鼠血浆中橙皮苷的浓度水平比口服后要高很多[6-7]。口服是中药应用的主要途径,口服药物首先在胃肠道中吸收[8]。小肠吸收障碍是影响外源性物质生物利用度的重要因素。因此,探索橙皮苷的肠道吸收机制为研究其体内药代动力学研究提供了关键信息。
本项研究的目的是探究橙皮苷的肠吸收特性并考察芙朴感冒颗粒对其吸收的影响。本实验采用的Caco-2细胞系,由于其形态和功能与人类小肠上皮相似而被广泛使用,并且已经被美国食品药品监督管理局(FDA)认可作为模拟人体肠道吸收的模型[9]。本研究旨在通过体外Caco-2实验和大鼠体内药动学实验揭示橙皮苷的小肠吸收机制,并探究芙朴感冒颗粒对橙皮苷口服吸收的影响。
1 仪器和试药
1.1 药品与试剂 Transwell 转运小室(12孔,0.4 μm);96 孔细胞培养板、培养瓶(Corning 公司,美国)。橙皮苷、槲皮素、维拉帕米、MK571、吲哚美辛、苯溴马隆、芹菜素、左旋肉碱和奎尼丁均由上海阿拉丁生化科技股份有限公司提供。HBSS缓冲液购于美国Corning 公司;二甲基亚枫(DMSO)购于美国Sigma公司;芙朴感冒颗粒(批号:203033,浙江天一堂药业有限公司)。MTT购自白鲨生物科技有限公司;胎牛血清购自美国Gibco公司;甲醇、乙腈均为色谱纯;水为纯化水;细胞Caco-2 细胞株,购自中国科学院上海细胞库,代数在35~50代。
1.2 仪器 Applied Biosystem 5500 QTRAP®hy-brid triple-quad LC/MS/MS(美国AB科学技术公司);ZORBAX Eclipse Plus C18色谱柱(美国安捷伦科技有限公司,50 mm×2.1 mm,1.8 μm)。跨膜电阻仪(Millicell ERS system,Millipore,MA,美国)。
1.3 动物 Sprague-Dawley(SD)大鼠(210~230 g)由上海交通大学实验动物中心提供,在恒定温度(22~24 ℃)和湿度(55%~60%)条件下饲养。所有动物程序均按照上海交通大学实验动物中心指南和规章制度操作,并通过上海交通大学动物伦理委员会审核。
2 方法

图2 培养基样品中橙皮苷和槲皮素的二级碎片离子图
2.2 芙朴感冒颗粒溶液的配制与定量 取装量差异项下的芙朴感冒颗粒,研细并精密称定粉末约1 g,至50 ml具塞锥形瓶中,精密加甲醇10 ml,超声提取20 min,取出放冷,称定重量,并用甲醇补足减失的重量,摇匀,滤过,弃去初滤液,用0.22 μmol/L微孔滤膜过滤。采用高效液相色谱法测定芙朴感冒颗粒中橙皮苷含量(3.2±0.8)mg/g,在芙朴感冒颗粒甲醇溶液中为526.2 μmol/L。
2.3 对照品溶液的配制 精密称取橙皮苷对照品适量,用DMSO 配制成浓溶液,实验前用HBSS缓冲液(用于Caco-2实验)或甲醇(用于药动学实验)稀释至所需药物浓度,其中DMSO 最终浓度低于0.1%,4 ℃冷藏备用。
2.4 样本处理 取培养基或大鼠血浆样品50 μl,加入10 ng/ml槲皮素甲醇内标溶液10 μl,涡旋混匀,加入400 μl甲醇,涡旋提取1 min。12 000 r/min离心10 min,吸取2 μl上清进样LC-MS/MS分析。
2.5 Caco-2细胞培养和细胞毒性 将Caco-2细胞保持在含有10%FBS(56 ℃灭活30 min)、1%非必需氨基酸、1% L-谷氨酰胺和1%链青霉素的DMEM中,实验温度为37 ℃,实验环境包含95%空气及5% CO2。培养基2~3 d更换一次。当细胞单层达到80%融合后,用胰蛋白酶(0.5 mg/ml)和EDTA(0.2 mg/ml)分离传代,细胞密度为5×104/ cm2。采用MTT法检测橙皮苷的细胞毒性。胰酶消化对数生长期Caco-2 细胞制成单细胞悬液,以每孔5×104个细胞密度接种到96孔培养板中,孵育24 h后,加入不同浓度的橙皮苷溶液或者芙朴感冒颗粒溶液(终浓度体系甲醇含量低于1%,含1 μmol/L橙皮苷)。之后,加入5 mg/ml MTT 20 μl孵育4 h后,再加入150 μl DMSO溶解。酶标仪在490 nm吸光度处测量。使用没有接种细胞的孔作为空白对照,含有细胞但没有样品溶液的孔作为阴性对照。细胞存活率(%)=A实验组/A对照组×100%,其中A为吸光度值。
2.6 转运实验 采用12 孔Transwell细胞小室,按1×105cells/ml的密度接种Caco-2细胞。对于转运实验,使用Millicells ERS-2评估跨膜电阻(Transepithelial electrical resistance,TEER),以反映细胞间连接的紧密性。单层接种后19~22 d即可进行实验。实验中使用了TEER大于400 Ω/cm2的Caco-2细胞单层。
实验前,用HBSS将细胞单层培养基(pH 7.4)洗涤2次。将细胞培养板在新鲜的HBSS培养基中于37 ℃孵育30 min。将测试化合物添加到顶膜端(AP,0.5 ml)或底膜端(BL,1.5 ml)中,同时接收室中包含相应体积的空白HBSS培养基。在37 ℃下以50 r/min摇动孵育120 min。为了评估药物从AP到BL的转运,在开始孵育后15、30、45、60、90和120 min,从BL或AP一侧收集50 μl溶液,并补充等量的HBSS溶液。在实验前后进行TEER测量以评估膜的完整性。取样后立即将样品冷冻,并在分析前保存在-80 ℃以下。
2.6.1 温度对橙皮苷转运的影响 拟在4 ℃和37 ℃条件下采用浓度为1 μmol/L的橙皮苷,研究其在Caco-2细胞中的转运行为是否受温度影响。
按照相关规则,按照税法规定外国企业以及外国企业收入,相关企业包含三例:在资金、运营、购销等方面,存在直接或间接地操控或具有联系;直接或间接地同为第三者所操控或具有;以及有其他利益上的相相联系。
2.6.2 pH值对橙皮苷转运的影响 在HBSS缓冲液中进行实验,该缓冲液根据实验调节至顶膜侧的pH值为6.0或7.4(0.5 ml),基底膜侧的pH值为7.4(1.5 ml)。
2.6.3 几种转运蛋白对橙皮苷转运的影响 将几种抑制剂分别预处理转运体系30 min,包括P-糖蛋白(p-gp)抑制剂维拉帕米(100 μmol/L)、多耐药蛋白(MRPs)抑制剂MK571(100 μmol/L)、苯溴马隆(MRP3,50 μmol/L)和吲哚美辛(MRP2,200 μmol/L)及乳腺癌耐药蛋白(BCRP)抑制剂芹菜素(25 μmol/L);通过添加钒酸钠(50 μmol/L)和西咪替丁(50 μmol/L)评估Na/K-ATPase的选择性;加入左旋肉碱(100 μmol/L)或奎尼丁(100 μmol/L)用以评估有机阳离子转运体OCTN1或OCTN2蛋白对橙皮苷吸收的影响。
2.7 药动学实验 实验前,大鼠被随机分为2组(每组6只大鼠),灌胃口服橙皮苷混悬液5.76 mg/kg或芙朴感冒颗粒溶液1.8 g/kg(临床等效量,约含5.76 mg/kg橙皮苷)。其中橙皮苷溶于0.5%CMC-Na中配置成混悬液用于口服。在给药后24 h内采血,收集全血150 μl,以3 000 r/min离心10 min,将50 μl血浆样品于-80 ℃保存。
2.8 数据处理 表观渗透系数(Apparent permeability,Papp) 值和外排率(Efflux ratio,ER) 值。Papp=(dQ/dt)/(A·C0),ER=PappBA/ PappAB。公式中 A 为Transwell小室的有效面积,dQ/dt为转运速率,C0为药物的初始浓度,PappBA为由BL至AP侧的Papp值,PappAB为由AP至BL侧的Papp值。ER > 1.5提示可能存在主动转运,ER < 1.5提示以被动扩散为主[10]。

3 结果
3.1 细胞毒试验 如表1所示,橙皮苷浓度小于100 μmol/L时对Caco-2细胞生长抑制率小于10%,表明低于100 μmol/L的橙皮苷对Caco-2细胞生长未产生明显的细胞毒性,因此,选取100、10、1 μmol/L作为转运实验中橙皮苷的终浓度。同时,浓度为0.19 mg/ml芙朴感冒颗粒溶液(含1 μmol/L橙皮苷)对Caco-2细胞生长无抑制作用,证明该浓度芙朴感冒颗粒溶液可用于Caco-2转运实验。

表1 不同浓度橙皮苷对Caco-2细胞的抑制率(n=33)
3.2 橙皮苷的含量测定 橙皮苷和内标的保留时间分别为1.74 min和2.18 min。代表性色谱图见图3,显示了橙皮苷和内标的基线分离,而不受内源性成分的干扰。橙皮苷在培养基及大鼠血浆中的校准曲线方程为y=0.050 7x+0.356(R2=0.991 4)及y=0.051 6x+0.235 7(R2=0.991 4),其中y表示橙皮苷峰面积与槲皮素峰面积的比率(x为培养基中的橙皮苷浓度,R为相关系数)。该测定方法的定量下限为0.5 ng/ml,线性范围0.5~200 ng/ml。橙皮苷在2种基质中的定量实验均通过专属性、准确度、精密度、提取回收率、稳定性和线性等方法学考察,结果可靠。

图3 样品质谱图
3.3 浓度和时间对橙皮苷转运的影响 在2个方向上研究了浓度分别为1、10、100 μmol/L的橙皮苷的转运,并估计了橙皮苷的渗透性(图4)。根据图4数据进行计算,橙皮苷的Papp为1.20×10-6~1.30×10-6cm/s(AP~BL)和2.23×10-6~2.81×10-6cm/s(BL~AP)。Papp值结果表明,橙皮苷属于中等吸收的化合物。在3个浓度下绘制了0~120 min Caco-2细胞单层中橙皮苷的浓度-时间图,橙皮苷在检测时间段内随时间呈线性增长。

图4 不同浓度下橙皮苷在Caco-2细胞中的跨膜转运(n=33)
3.4 pH值和温度对Caco-2细胞转运橙皮苷的影响 如图5所示,橙皮苷在pH=7.4时的PappAB值明显高于pH=6时的PappAB值(P<0.05),提示高pH(7.4)时穿过细胞单层的橙皮苷转运要比低pH(6.0)时更容易,原因可能是在橙皮苷转运过程中,pH=6.0时,某些外排蛋白如BCRP活性被激活,导致药物的转运效率降低[11]。温度降低会降低细胞的新陈代谢[12],低温(4 ℃)孵育显著降低了橙皮苷转运效率,使PappAB从1.23×10-6cm/s降低到0.58×10-6cm/s。
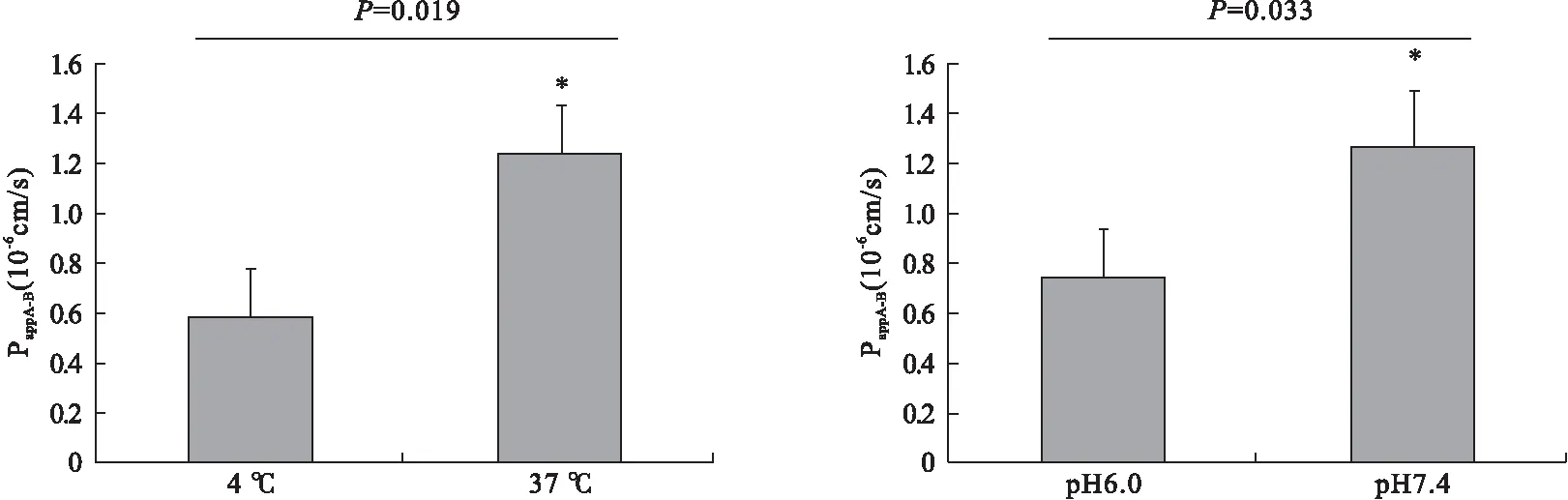
图5 不同pH和温度时橙皮苷 (1 μmol/L) 在Caco-2细胞中的跨膜转运(n=33,P<0.05)
3.5 转运蛋白抑制剂对跨细胞橙皮苷转运的影响 如表2所示,在用西咪替丁或钒酸钠预处理后,Papp值无显著影响。P-gp被认为是影响药物在肠道中运输的主要外排蛋白之一。P-gp抑制剂维拉帕米可能会显著增加某些化合物从AP到BL侧的转运。在维拉帕米预处理的情况下,橙皮苷的PappAB几乎是对照组的6.75倍,同时ER从2.19降至0.31,这提示P-gp可以影响橙皮苷的转运。除P-gp外,MRP和BCRP也是三磷酸腺苷超家族的成员,与药物的吸收和代谢过程密切相关。在以3种MRP抑制剂(MK571、苯溴马隆和吲哚美辛)预处理的情况下,橙皮苷的PappAB与对照组相比没有显著性差异,这说明橙皮苷并不是MRP的底物。另一方面,在通过转运蛋白OCTN1抑制剂预处理后发现,橙皮苷的跨膜转运并没有明显变化,说明OCTN1对橙皮苷的转运影响甚微。同时,推测橙皮苷并非为摄入型转运蛋白OCTN2 的底物,OCTN2属于有机阳离子转运蛋白,这些转运蛋白不需要消耗ATP,而是依赖药物离子表面的离子电荷实现药物转运,以被动扩散中的协助扩散的方式摄入细胞。

表2 橙皮苷在Caco-2细胞上转运结果(n=33)
橙皮苷是BCRP的底物。在芹菜素预处理的情况下,橙皮苷的PappAB显著升高,约为对照组的2.46倍,使PappAB从1.26×10-6cm/s增加至3.71×10-6cm/s。加入芙朴感冒颗粒处理液后,橙皮苷的PappAB显著升高,证明芙朴感冒颗粒中其他成分可能影响了橙皮苷的转运,促进了其小肠吸收。
3.6 体内药动学研究 大鼠口服橙皮苷或芙朴感冒颗粒溶液后血浆浓度与时间的关系曲线如图6所示。主要的药动学参数如表3所示,芙朴感冒颗粒组中橙皮苷的Cmax为单体组的121.54%。口服给药后,两组橙皮苷均被迅速吸收并达峰值。两组橙皮苷的血浆暴露量(AUC0-t和AUC0-∞)差异有统计学意义(P<0.05),但MRT和t1/2差异无统计学意义,说明芙朴感冒颗粒片中其他成分主要影响橙皮苷的吸收,对其消除没有明显作用。这个结果可以与Caco-2实验中芙朴感冒颗粒影响橙皮苷小肠吸收这一结果吻合。

图6 两组大鼠口服橙皮苷或芙朴感冒颗粒溶液后体内橙皮苷的平均血药浓度-时间曲线(n=36)
4 讨论
一般认为,Papp值小于1×10-6cm/s的化合物被认为吸收率低(<30%),Papp值在1×10-6~1×10-5cm/s的化合物被认为具有中等吸收(30%~60%),而Papp值大于1×10-5cm/s的被认为具有高吸收(>70%)[13]。橙皮苷Papp值的这些结果表明了其在肠道中吸收一般。橙皮苷属于吸收中等化合物,结合文献,其渗透性与口服生物利用度并不完全一致。

表3 两组大鼠血浆中橙皮苷的主要药动学参数(n=6)
Caco-2试验的结果显示,橙皮苷吸收的ER值> 1.5,同时,抑制剂的试验结果表明,其存在外排蛋白参与的主动转运。P-gp 是ATP依赖型外向转运蛋白,属ATP 结合盒 (ATP binding cassette,ABC)超家族,由2个重复分子组成,每一分子包括6个跨膜的极度疏水区和1个包含高度保守的ATP 结合域亲水区。P-gp 主要定位在小肠黏膜上皮细胞和胎盘滋养层细胞的刷状缘、肝小管和肾近曲小管的管腔面以及脑血管内皮细胞,参与药物的吸收,临床上很多药物为P-gp的诱导剂或抑制剂[14]。本次试验发现橙皮苷为P-gp的底物,这为进一步研究橙皮苷临床应用及药物相互作用提供了前期基础。除P-gp 外,MRP2、BCRP 等外排型转运体在肠道上皮细胞的顶膜侧都有所表达,它们在将底物分泌至胞外中发挥重要作用[15]。
药物口服以后,首先在胃肠道被吸收,因此,肠道吸收能力的强弱直接影响到化合物的体内药动学行为尤其是其吸收相特征。除了肠道吸收障碍外,肝脏代谢也是导致口服生物利用度低的一个重要原因。
本次体外Caco-2试验及体内药动学试验结果表明,复方给药增加了橙皮苷的小肠吸收能力,导致芙朴感冒颗粒中的橙皮苷吸收显著增加,其原因可能是由于芙朴感冒颗粒中的某些成分竞争性地抑制了橙皮苷的外排作用。结果显示,该复方成分对橙皮苷有增加吸收作用。该结果证明了方剂配伍可明显影响活性化学成分在体内的药物动力学行为,说明在中医辨证理论指导下的复方配伍原则具有丰富的科学内涵。根据文献报道,除橙皮苷外,芙朴感冒颗粒主要还包括牛蒡子苷、川陈皮素、厚朴酚以及芦丁等若干成分[16],复方中几味药材间存在复杂的相互作用,从而可能导致药效发生改变,我们将进一步深入研究。

