硫酸铵、镁、锰复盐结晶动力学研究
靳学利, 李明东, 尤晓宇, 王家伟*,, 胡平
(1.湖北大江环保科技股份有限公司,湖北 黄石 435005; 2.贵州大学材料与冶金学院, 贵阳 550025;3.电池用锰材料工程技术研究中心,贵州 铜仁 554300)
0 引 言
近年来,我国电解锰行业发展迅速,但同样存在诸多问题[1-3]。 在电解锰生产中,Mg2+经多次循环后富集于电解液中难以去除,影响金属锰产品的质量[4-6]。 目前除镁的方法主要有化学沉淀法、萃取法、重结晶法及机械去除法等。化学沉淀法[7-8]利用合适离子与Mg2+反应生成难溶沉淀除镁, 但存在沉淀难以过滤、锰损失较大等问题;萃取法[9-10]利用易与Mg2+结合的有机溶剂除镁, 但存在萃取剂成本较高的问题; 机械去除法利用机械设备人工去除镁盐结晶,易造成电解槽内壁破损等问题。 这些方法都存在着明显的缺点, 并且未见相关工业化报道。重结晶法[11-15]是利用电解液中溶解度的差异实现锰镁分离,相比之下,该方法不带入新的杂质,较简单、环保。 袁飞等[16]依据Benrath 等[17]提出的MnSO4-MgSO4-H2O 三元体系溶解度图去除硫酸锰溶液中的Mg2+,但溶液中仍有大量Mg2+,效果不理想。 XIE 等研究了青海大浪滩盐湖区硫酸镁亚型盐田卤水的高温蒸发结晶规律[18];VARGAS 等采用Raman 光谱研究了硫酸镁和硫酸钠的复盐结晶[19]。目前对硫酸盐多元体系的溶解特性的研究还极不成熟,仍停留在理论研究阶段[20-22]。
因此,有必要在重结晶法基础上研究硫酸盐混合体系的复盐结晶行为,在硫酸铵、镁、锰复盐体系中进行结晶动力学的深入研究。结晶动力学是模拟结晶过程的理论前提, 可为结晶工艺优化提供理论依据,研究复盐体系的结晶动力学无疑具有重要意义[23-25]。 本文重点对硫酸铵、镁、锰复盐结晶动力学进行研究,为后续电解液中Mg2+的去除问题提供参考。
1 实 验
1.1 实验原料与仪器
硫酸铵(AR)、硫酸镁(AR)、硫酸锰(AR)购自国药集团化学试剂有限公司,蒸馏水自制。
实验仪器如表1 所列。

表1 实验仪器Table 1 Experimental instruments
1.2 实验方法
硫酸铵、镁、锰复盐体系结晶动力学实验装置如图1 所示。
配制硫酸铵、镁、锰混合溶液,Mn2+浓度为28 g/L,Mg2+浓度为20 g/L,NH4+浓度为30 g/L。 实验装置如图1 所示。利用旋转蒸发器进行蒸发结晶,取250 mL混合液于蒸发瓶内, 设置蒸发瓶转速为30 r/min,结晶时间为900、1 800、2 700、3 600、4 500、5 400 s,结晶温度为298、308、318、328 K。 结晶结束后取结晶产品干燥并称重,分别进行测试分析,重点对铵、镁、锰复盐体系的悬浮密度、晶体粒度、晶体粒数密度、晶体结晶动力学进行研究。

图1 复盐体系结晶实验装置Fig. 1 Experimental apparatus for crystallization of double salt system
2 结果与讨论
2.1 悬浮密度研究
控制蒸发瓶转速为30 r/min,研究结晶时间、结晶温度对铵、镁、锰复盐体系悬浮密度的影响,结果见图2。

图2 结晶时间、结晶温度对复盐体系悬浮密度的影响Fig. 2 Effect of crystallization time and temperature on suspension density of double salt system
由图2 可知,控制复盐体系结晶温度不变,随着结晶时间的增加, 结晶产物悬浮密度先呈上升趋势,在结晶时间超过4 500 s 后, 悬浮密度基本保持不变。结晶前中期,溶液过饱和度较高,结晶过程推动力较大,晶体成核、生长速率较快;结晶后期,过饱和度较低导致结晶推动力不足,晶体生长缓慢,晶体悬浮密度呈稳定趋势。
控制复盐体系结晶时间不变,随着结晶温度的升高, 结晶产物悬浮密度呈上升趋势, 在结晶温度为328 K 时,悬浮密度达到最大。 这是因为晶体生长对结晶温度较为敏感,随着结晶温度的升高,粒子运动加剧,颗粒互相碰撞黏附形成聚集体,而后聚集体生长为团聚体,使悬浮密度增大[26]。
综合考虑成本和效果, 结晶时间4 500 s,结晶温度328 K 为较优结晶条件,此时,悬浮密度最大为240.4 kg/m3。
2.2 晶体粒度研究
控制蒸发瓶转速为30 r/min, 研究结晶时间、结晶温度对铵、镁、锰复盐体系晶体粒度的影响,结果见图3 和表2。

表2 复盐体系晶粒平均尺寸(M.S)及变异系数(C.V)Table 2 Average grain size (M.S.) and coefficient of variation (C.V.) of double salt system
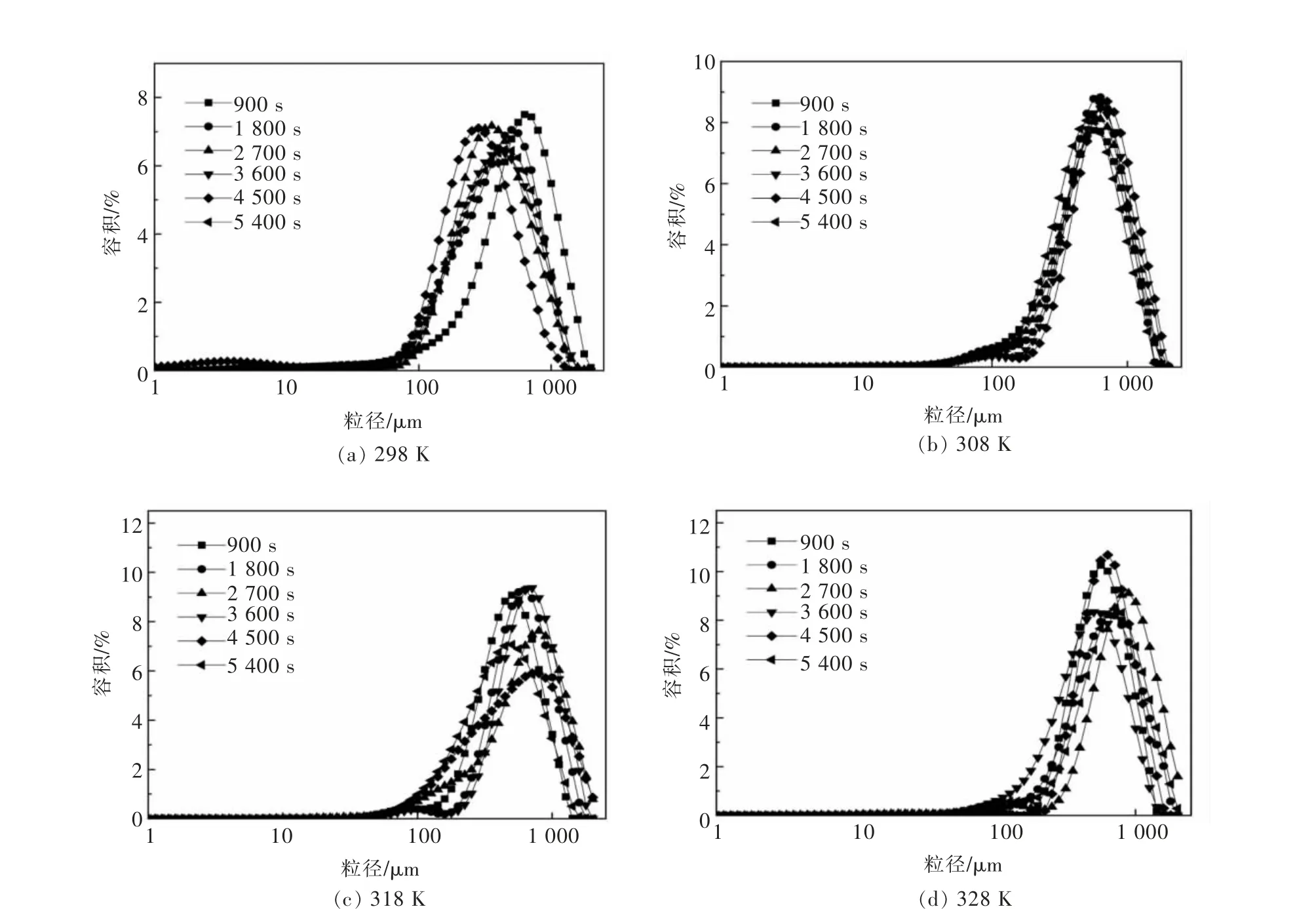
图3 铵、镁、锰复盐体系结晶粒度分布Fig. 3 Crystal size distribution of ammonium, magnesium and manganese double salt system
由图3 和表2 可知, 随着结晶温度的升高, 铵、镁、锰复盐体系晶粒平均尺寸呈上升趋势,且在同一温度下,不同结晶时间的晶粒平均尺寸差异较大。 在结晶时间为2 700 s,结晶温度为328 K 时,晶体粒度最大为817.758 μm,变异系数为51.89。
随着复盐体系结晶温度的升高, 溶液黏度会变小,溶质分子的能量随之增大,促进了溶质分子的扩散,粒子间碰撞频率加大,溶质分子黏附在一起形成聚集体,化学力使其生长为团聚体,造成晶粒平均尺寸增大[27]。
当结晶时间为2 700 s 时,晶粒平均尺寸变化明显,变异系数较高,综合考虑,结晶时间为4 500 s,结晶温度为328 K 是较优条件,此时,晶粒平均尺寸为633.982 μm,变异系数为42.46,效果较好。
2.3 晶体粒数密度研究
由晶体粒度分布结果,得到铵、镁、锰复盐结晶粒数密度分布图及晶体成核、生长速率表,结果见图4和表3。
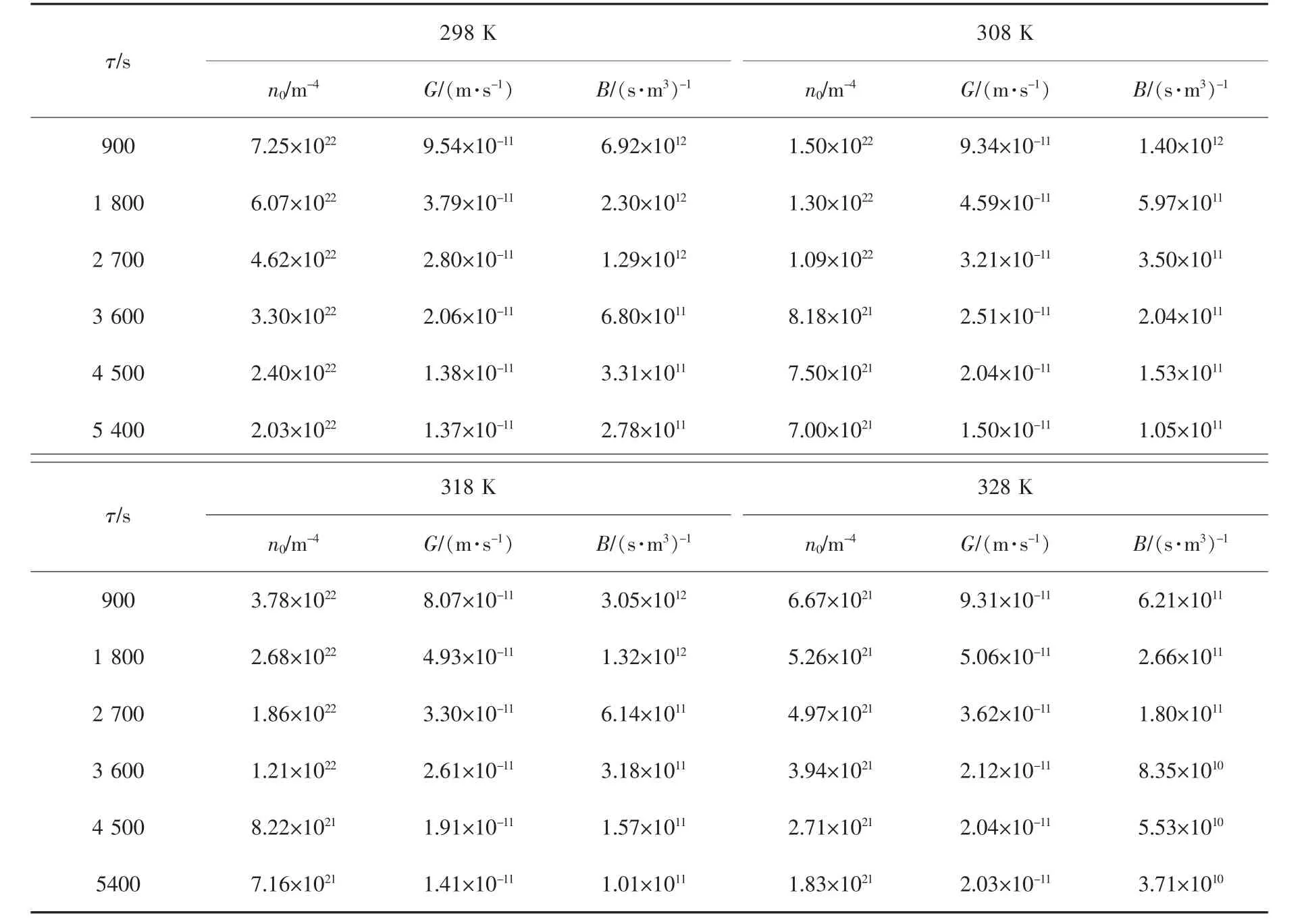
表3 铵、镁、锰复盐结晶成核和生长速率Table 3 Nucleation and growth rate of ammonium, magnesium and manganese double salts
由图4 可知, 在复盐体系结晶温度相同时,晶体的粒度与粒数密度并不能实现完全线性拟合,在晶体粒度L<50 μm 时, 粒数密度有突变的趋势,与ΔL 定律模型相冲突。 这是因为在复盐体系结晶过程中,当晶体粒度较小时,晶体与晶体、晶体与器壁碰撞概率增大,晶体会因为冲击作用发生破裂而产生新的晶核,产生二次成核的现象[28]。 在实际生产中,二次成核现象是难以避免的,应尽量减小二次成核的发生概率。
当晶体粒度L>50 μm 时, 晶体粒度与粒数密度对数成线性关系,在复盐体系结晶过程中,铵、镁、锰复盐体系晶体生长总体为粒度无关生长,利用ΔL 定律模型所得的动力学数据仍符合实际结果。取晶体粒度L>50 μm 时进行线性拟合, 得出晶体的晶核粒数密度n0和晶体生长速率G,计算得晶体成核速率B,结果见表3。
2.4 结晶动力学方程研究
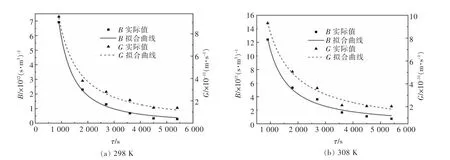
在复盐结晶过程中, 当蒸发瓶转速为30 r/min时, 采用优化后的ΔL 定律模型对结晶过程中成核、生长速率进行拟合,结果见图5,拟合方程见表4。
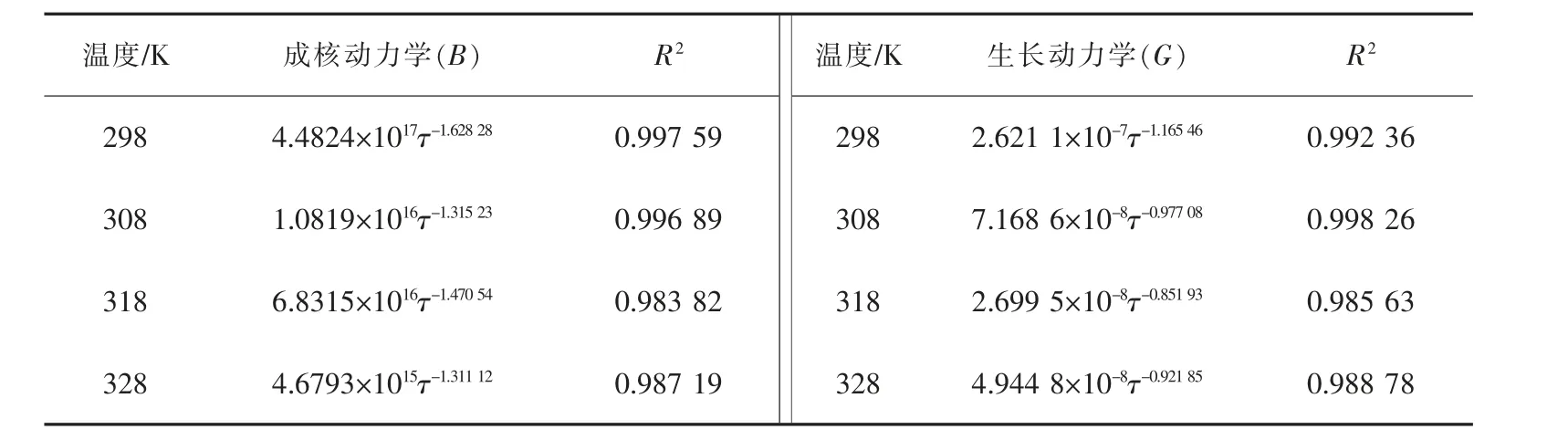
表4 铵、镁、锰复盐结晶成核、生长动力学方程Table 4 Kinetics equation of nucleation and growth of ammonium,magnesium and manganese double salt
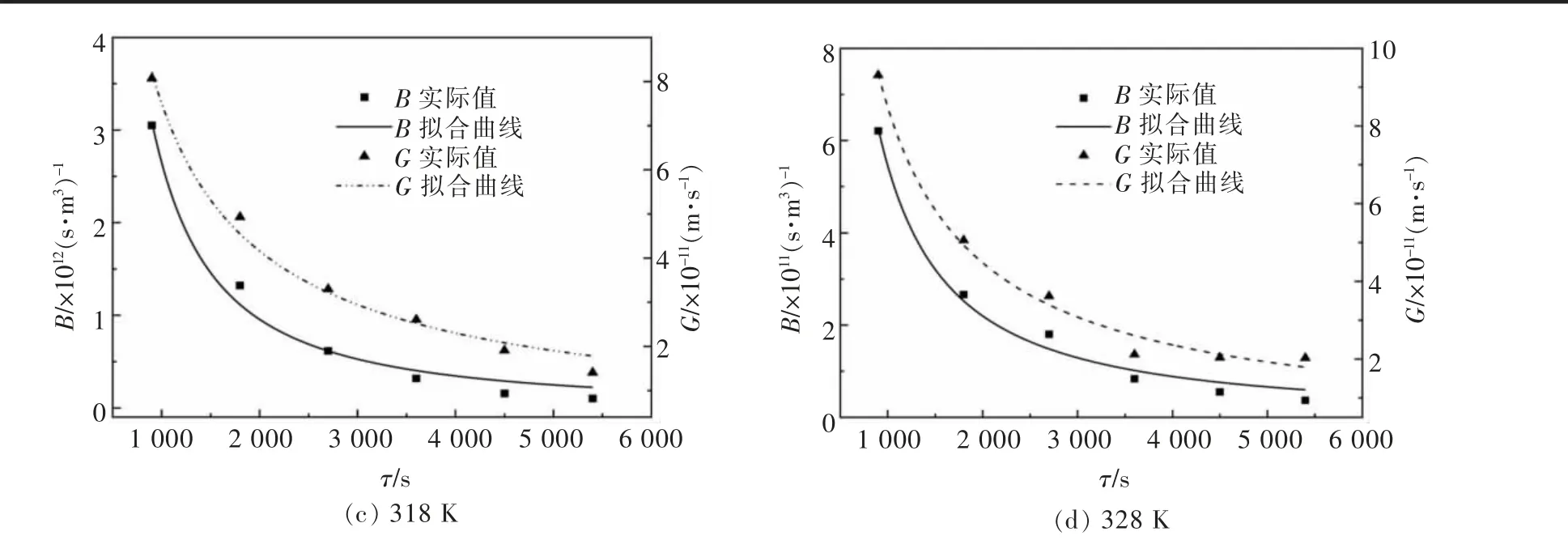
图5 铵、镁、锰复盐体系成核、生长动力学拟合曲线Fig. 5 Fitting curve of nucleation and growth kinetics of ammonium,magnesium and manganese complex salt system
传统ΔL 定律模型为G=kLΔCl,在复盐体系结晶过程中,采用浓度差来反映结晶的进程。 当结晶时间变化时,浓度差也随之改变,此时,采用时间为自变量可更精确描述结晶进行的程度[29]。以时间代替浓度差,对ΔL 定律模型进行优化,得:

由图5 可知,随着结晶时间的增加,复盐体系结晶成核、生长速率呈下降的趋势,且增速逐渐放缓。这是因为结晶初期,溶液过饱和度较高,晶核易于形成并长大;随着结晶过程的进行,过饱和度变低,结晶推动力不足,难以形成晶核并稳定生长。
由表3 可知,随着结晶温度的增加,复盐体系结晶产物成核和生长速率呈缓慢下降的趋势。 这是因为随着结晶温度的增加,溶液的溶解度呈上升趋势,溶液过饱和度降低,推动力减弱,造成晶体成核和生长速率呈缓慢降低的趋势。
当复盐体系蒸发瓶转速为30 r/min 时,铵、镁、锰复盐结晶成核、生长动力学方程分别为:298 K:
B=4.482 4×1017τ-1.62828, R2=0.997 59;

3 结 论
1)在复盐结晶过程中,当结晶时间为4 500 s,结晶温度为328 K 时,溶液悬浮密度为240.4 kg/m3,晶粒平均尺寸为633.982 μm,变异系数为42.46,晶粒品质较好。
2)随着结晶时间的增加,复盐体系成核和生长速率呈下降的趋势;随着结晶温度的增加,复盐体系成核和生长速率呈缓慢下降的趋势。
3)在Mn2+、Mg2+、NH4+初始浓度分别为28、20、30 g/L,蒸发瓶转速为30 r/min 时,铵、镁、锰复盐结晶过程符合ΔL 定律,晶体生长为粒度无关生长。 在晶体粒度L 高于50 μm 时, 利用优化后ΔL 定律拟合可得晶体成核和生长动力学方程, 相关指数R2均在0.98以上,拟合结果较好。

