中国294例胃肝样腺癌临床数据荟萃分析
王康韬,田梦翔,葛鹤铭,艾则孜·麦麦提,宋堃,邓静,陈鸰,裴海平,谭风波
[1.中南大学湘雅医院普通外科,湖南长沙410008;2.国家老年疾病临床医学研究中心(湘雅医院),湖南长沙410008;3.中南大学湘雅公共卫生学院,湖南长沙410078]
胃肝样腺癌(hepatoid adenocarcinoma of the stomach,HAS)是一种罕见且预后差的胃癌类型,研究显示HAS 患者约占同期胃癌患者总人数的0.17‰,我国HAS 发病率占同期胃癌患者的3.7‰~15‰[1-2]。HAS 于1985年首次由Ishikura 等[3]报道,相较于一般胃腺癌,HAS 常伴有血清甲胎蛋白(alpha‐fetoprotein,AFP)的升高,出现肝脏和淋巴结转移概率更高,预后更差,且易漏诊及误诊。目前研究发现这可能与胃和肝脏拥有相同的胚胎起源,因此HAS 组织形态学特征与肝细胞癌有相似之处,文献报道常见的HAS 的免疫组化标志物包括AFP、磷脂酰肌醇蛋白聚糖3 (glypican‐3,GPC‐3)、人类婆罗双树样基因4(sal‐like protein 4,SALL4)等可以对两者进行辅助诊断[1,4-5]。然而因HAS 发病率极低,缺乏大样本多中心研究,有关于其发病特点、临床病理特征、高危风险因素仍不明确。
目前HAS 的文献报道主要为少量病例及单一机构报道,尤其和相关地域发病情况研究较少。基于此,本研究拟利用文献荟萃方法,收集近年在国内外数据库发表关于中国HAS 的文献资料,筛选并分析临床数据,探讨中国HAS 患者的发病地域特点、疾病临床特点及预后危险因素,拟对HAS 在我国的临床发病特点、诊治及预后进行探讨,提高对中国临床一线工作者对于HAS 的认识,促进中国HAS 患者的治疗规范性并提高患者的预后。
1 资料与方法
1.1 研究对象
纳入标准:2014年1月—2021年1月收录于国内外医学杂志上中国HAS 临床研究的中英文文献,排除重复内容、综述、会议摘要、评论及信息不全的文献。结合文献报道,不以患者血清中是否有AFP 升高为依据,仅以病理结果发现肝样分化区的胃癌为诊断标准[6-7]。
1.2 检索方法
检索中南大学图书馆电子期刊数据库,包括中国生物医学文献数据库(CBM)、维普中文科技期刊数据库(VIP)、万方期刊全文数据库和PubMed 数据库。检索词:胃肝样腺癌;肝样腺癌;HAS;Hepatoid Adenocarcinoma of the Stomach;HAC 等。
由2 名研究人员分别进行文献检索及筛选,提取文献数据,后行交叉核对。遇到分歧时,进行标记并讨论,咨询此领域的相关专家,最终得出统一意见。文献筛选时,先阅读标题和摘要,排除明显与该研究不符的文献后,再仔细阅读文献全文,最后收集详细临床信息。将所纳入文献中相关研究信息制作成表,包括“病例数”、“病例来源省市,地区”、“性别”、“年龄”、“血清AFP浓度”、“TNM 分期”、“肿瘤转移”、“药物治疗方式”、“手术治疗情况”、“患者预后”等,进而分析我国HAS 地域分布情况。进一步将完整有效病例数据纳入生存分析,分析影响HAS 预后的相关临床病理因素。
1.3 统计学处理及图像绘制
采用SPSS 22.0 软件对结果进行统计分析,临床病理因素基于Kaplan‐Meier 检验方法分析并采用GraphPad Prism 9 绘制变量的生存曲线。多因素生存分析采用Cox 多因素风险回归模型,以生存分析中P<0.10 作为多因素分析纳入标准。所有检验均以α=0.05 作为检验水准。中华人民共和国自然资源部网站(http://bzdt.ch.mnr.gov.cn)制图工具绘制疾病分布相关地图。
2 结果
2.1 文献检索结果
检索中文、英文相关文献总量分别为717 篇、87 篇,排除重复报道,非中国数据,综述文献,信息缺失等,最后纳入研究的文献为32 篇[8-39],其中中文文献28 篇,英文文献4 篇,文献筛选流程及结果见图1 与表1。总计纳入地域分析病例294 例,纳入生存及相关分析的有效病例95 例。

表1 294例HAS基本临床病理信息(续)Table 1 General clinicopathologic information of the 294 HAS patients(continued)
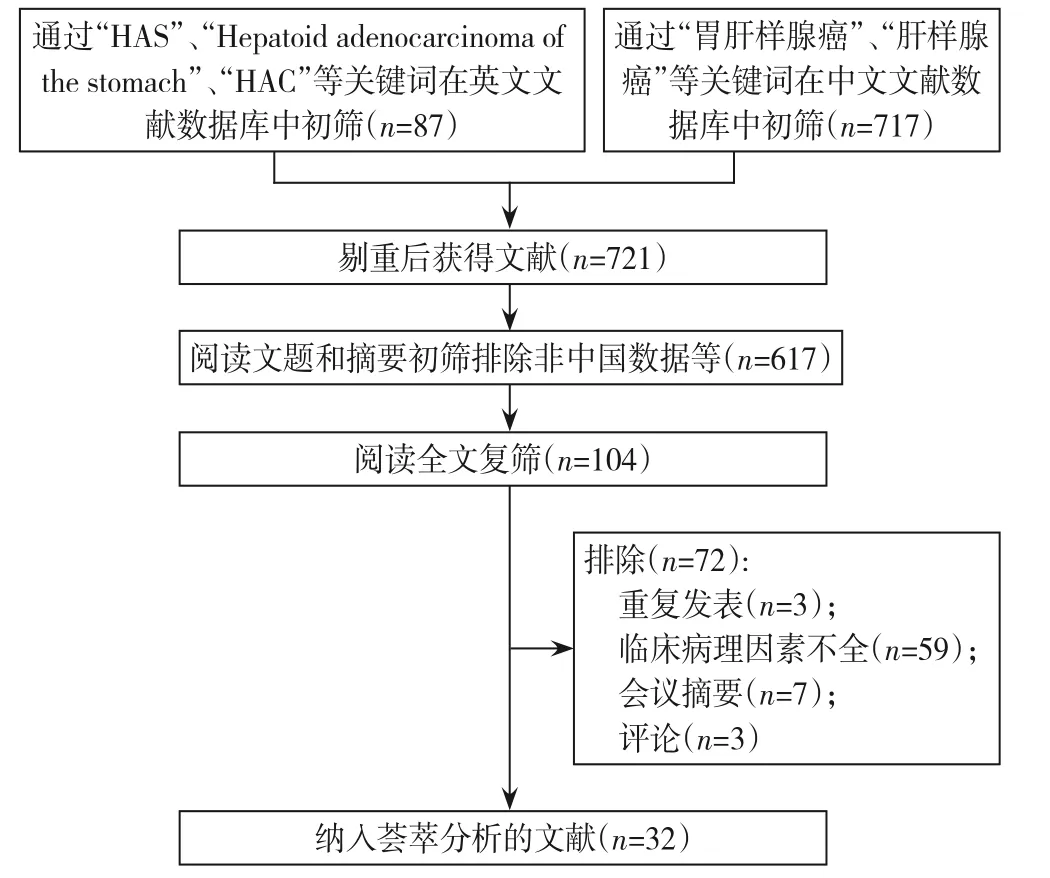
图1 文献筛选流程图Figure 1 Literature screening process and results
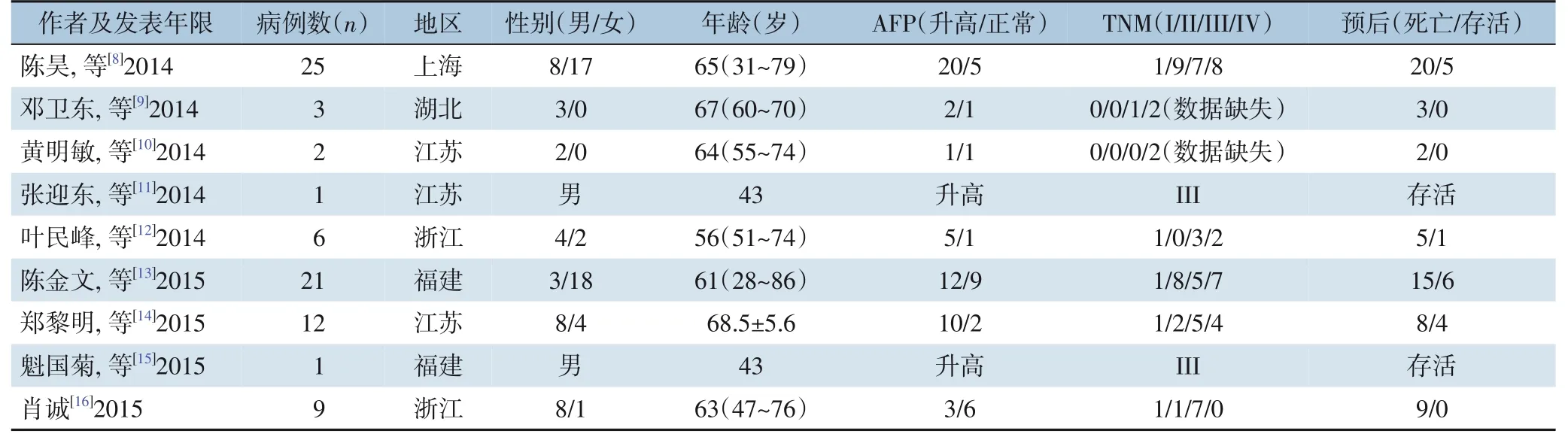
表1 294例HAS基本临床病理信息Table 1 General clinicopathologic information of the 294 HAS patients
2.2 地域分析
国内HAS 相关的报道及研究主要集中于北京及部分沿海地区,占比为86.4%(图2)。沿海地区对HAS 报道更密集,一方面提示HAS 可能与高糖高脂饮食,经济发展及城镇化率相关。另提示沿海地区对罕见病例关注程度更高,内陆对HAS 的认识尚不足,大量HAS 病例可能被误诊为普通胃腺癌或未进行报道。
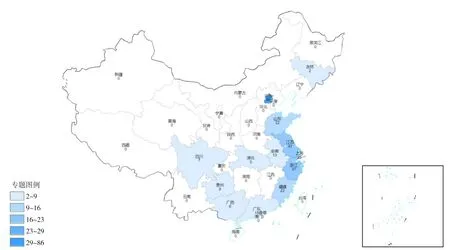
图2 294例HAS报道病例地区分布图Figure 2 Regional distribution of the 294 HAS cases
2.3 95例HAS临床病理特征
294 例病例中筛选出95 例有效病例(表2),其中男性77 例(81.1%),女性18 例(18.9%),男女比例为4.28∶1。患者年龄40~79 岁,其中60 岁及以上的患者60 例,占总例数的63.2%。在诊断方面95 例患者中有70 例(73.7%)血清AFP 升高,血清AFP>500 ng/mL 的病例数为47(49.5%),最高超过80 000 ng/mL。TNM 分期采用UICC/AJCC 第八版分期标准:I、II、III、IV 期患者分别为6 例(6.3%)、15 例(15.8%)、51 例(53.7%)、23 例(24.2%)。在35 例远处转移患者中,30 例为肝转移,2 例为肝肺、腹腔多发转移。在治疗方面,95 例有效统计病例中行根治性手术81 例(85.3%)(含7 例新辅助治疗后),另5 例行姑息性手术,9 例未进行手术。在化学药物治疗方面,72 例(75.8%)患者接受化疗,17 例患者仅进行支持治疗。结果提示HAS 病例以老年男性为主,患者血清AFP 多升高并且部分患者血清AFP 升高明显,HAS 发现时多为肿瘤晚期,最常见肝脏转移,治疗方式以手术,化学药物治疗为主。
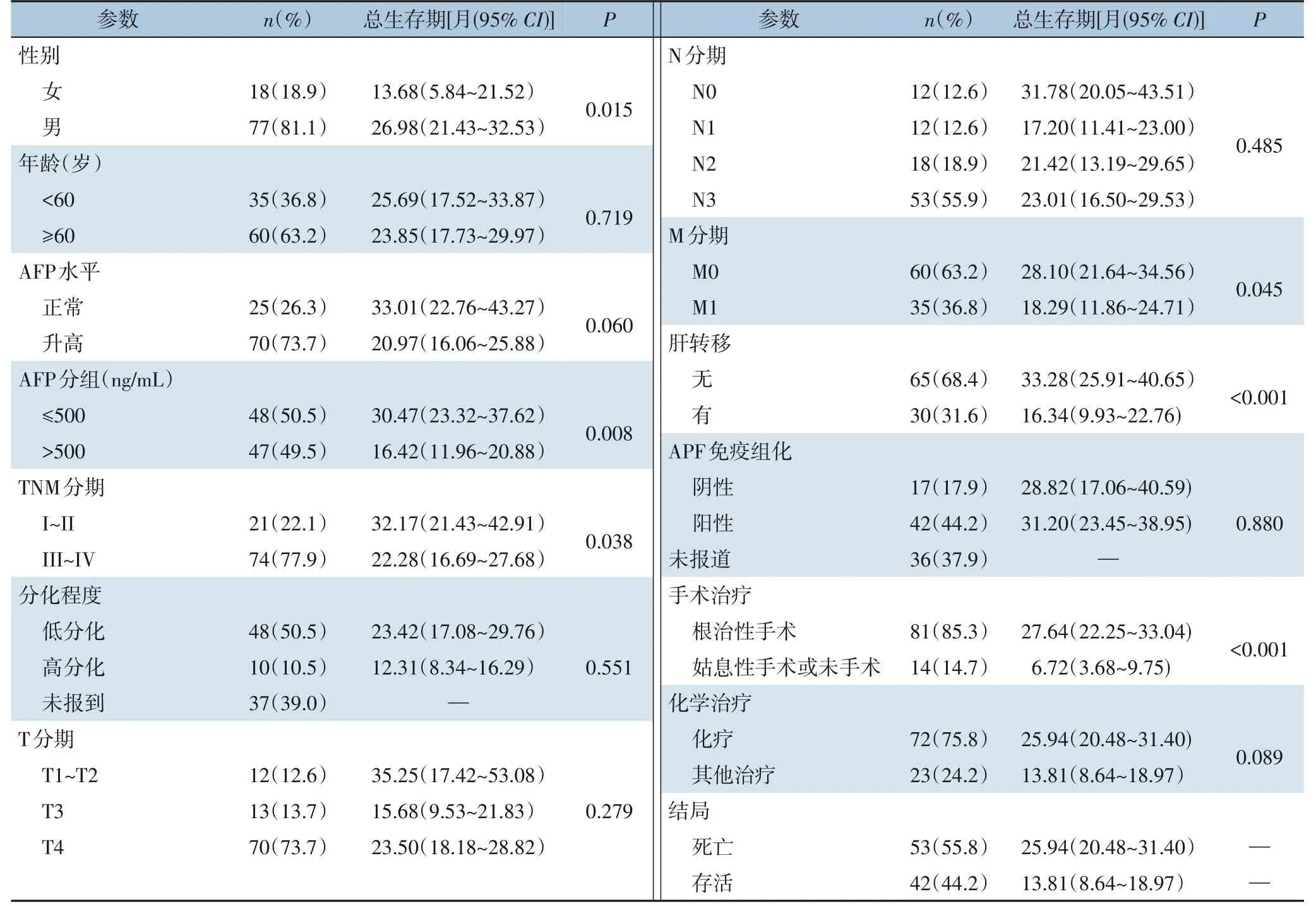
表2 95例HAS患者的临床病理特征及Kaplan-Meier生存分析Table 2 The clinicopathologic features and Kaplan-Meier survival analysis of 95 HAS patients
2.4 预后分析
患者中位生存期为11个月,死亡53例(55.8%),最短生存期为1 个月,最长生存期为52 个月,3年累积生存率仅为12.4%。经过Kaplan‐Meier 生存分析发现性别、AFP>500 ng/mL、TNM 分期、M 分期特别是肝脏转移为预后不良因素(表2)(图3)。手术治疗特别是根治性手术能够显著延长患者生存期。结果提示HAS 患者预后整体较差特别是女性,并随着TNM 分期,血清AFP 升高而降低,随着采取积极治疗措施如根治性手术切除而明显降低,而随着远处转移特别是肝转移死亡风险明显升高。

图3 不同AFP水平与不同TNM分期HAS患者的生存曲线Figure 3 Survival curves of HAS patients with different AFP levels and TNM stages
2.5 多因素Cox回归分析
为了进一步探究独立危险因素,将Kaplan‐Meier 生存分析中有临床意义(P<0.1)的因素纳入多因素Cox 回归分析,结果显示,女性相对男性(HR=2.472,95%CI=1.247~4.904,P=0.010),AFP>500 ng/mL (HR=1.987,95%CI=1.073~3.677,P=0.029),姑息性手术或未手术相对于根治术手术患者(HR=0.223,95%CI=0.099~0.500,P<0.001) 为HAS 独立危险因素。结果说明,调整了其他因素后,女性死亡风险约为男性的1 倍;AFP>500 ng/mL是HAS 患者死亡的危险因素,其死亡风险是AFP≤500 ng/mL 患者的1.987 倍,根治术手术是患者死亡的保护因素,其风险仅为非根治术手术患者(姑息性手术或未手术)的0.223 倍(表3)。
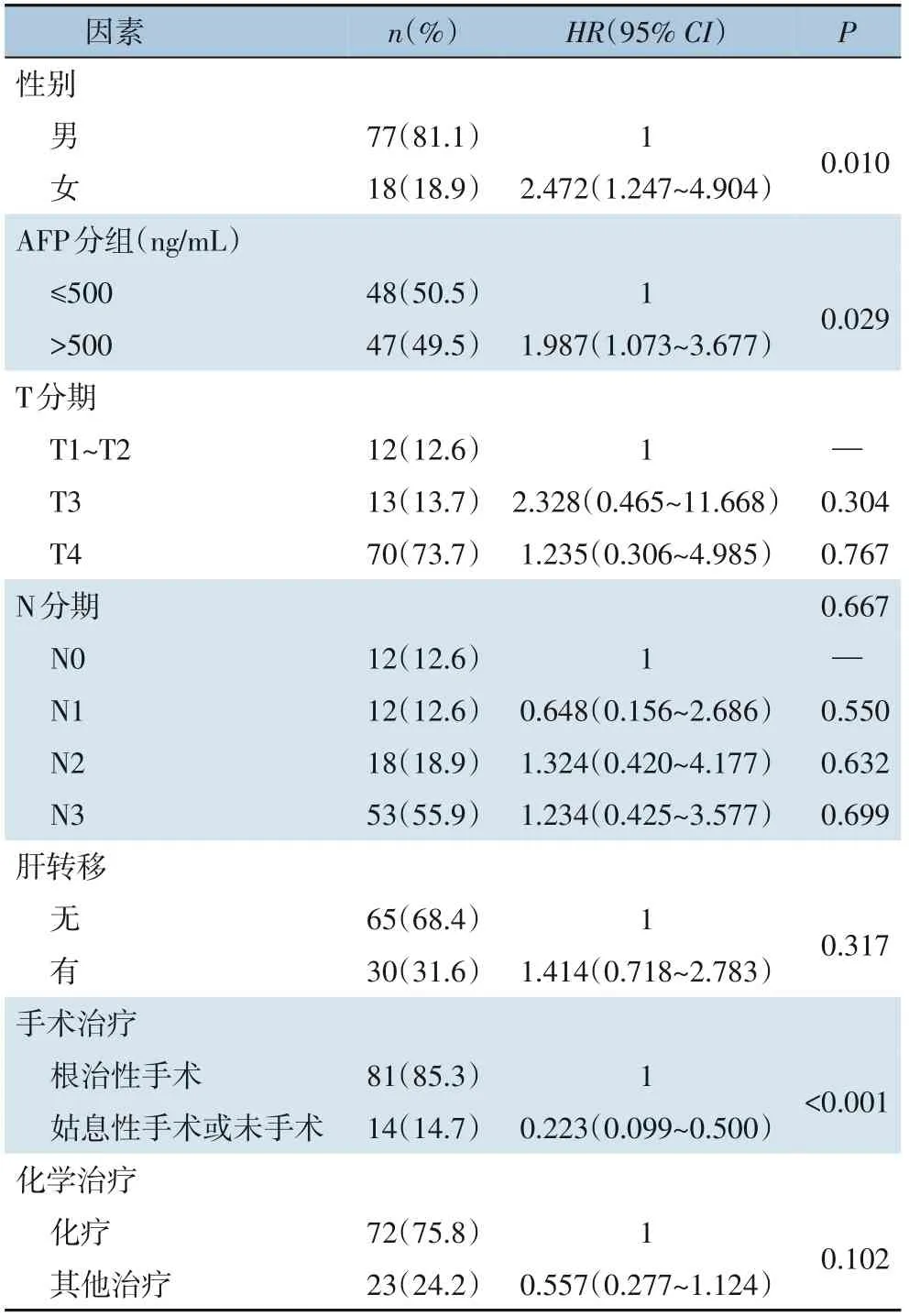
表3 95例HAS患者多因素Cox回归分析Table 3 Multivariate Cox regression analysis of 95 HAS patients
3 讨论
本研究纳入了2014年1月—2021年1月发表于中外文献数据库报道的所有胃肝样腺癌病例报道,并进行了临床数据的荟萃分析。据报道我国2015年胃癌发病例数为40.3 万例,结合HAS 发病率约为3.7‰~15‰,预估我国HAS年发病例数为1 490~2 940 例[7,40]。本研究的统计分析发现绝大部分病例报道于沿海地区,这可能与沿海地区医疗和经济水平相对更高,医师交流更为频繁相关,使HAS诊断率更高。由于病例较少,也不排除环境污染、生活习惯改变等因素,导致HAS 在这些地区有较高的发病率。但目前还没有找到任何证据证明HAS 与已知的常见胃腺癌风险因素之间存在关系,因此HAS 的发病原因以及发病机制仍需进一步研究。
本研究中发现HAS 患者血清AFP 大部分有升高,AFP>500 ng/mL 患者占49.5%,这类患者预后更差,转移概率更高。Yang 研究[41]指出AFP 升高与肝细胞癌样组织分化区生物学行为类似肝癌细胞相关,HAS 更易发生血道转移,脉管内癌栓发生率更高。AFP 可作为免疫抑制因子,减弱机体抗肿瘤免疫效应,进而促进肿瘤的生长及转移[7]。因此对于普通胃腺癌患者血清异常AFP 增高要引起重视,考虑HAS 的可能性并积极采取治疗。Cox 回归结果也显示,调整其他因素后,AFP>500 ng/mL患者的预后仍然较差,死亡风险是AFP≤500 ng/mL的1.978 倍。
在临床实践中,HAS 极易被误诊为普通胃腺癌,免疫组化可以较好地进行鉴别诊断[42]。但我们的研究中37.9%的患者未进行免疫组化,在进行免疫组化的患者中AFP 阳性占有绝大部分,另外新近发现的标志物检测将有助于对HAS 进行鉴别诊断。肝细胞癌样分化区白蛋白mRNA 以及GPC‐3在HAS 中呈100%阳性[4]。还可采用干细胞标志物SALL4,其在产生AFP 的HAS 中高表达,而在普通胃腺癌及肝细胞癌中少见表达[43]。
另外超过30%的病例存在肝转移,概率远高于普通胃腺癌。除HAS 外,胃腺癌可能存在肠母细胞样分化亚型 (gastric adenocarcinoma with enteroblastic differentiat,GAED),甚至两种亚型同时存在,这与其组织学和胚胎学上高度同源自原肠相关[41]。因此,由于HAS 与肝细胞癌的相似性,临床上经常会出现将HAS 肝转移误诊为肝癌胃转移的情况。文献[35]报道可以通过SALL4 及Lin28 蛋白免疫组化联合阳性证明为HAS 肝转移。此外,组织学上GAED 是一种分化良好的胃腺癌的变体,表现为管状乳头状生长模式,以透明细胞和腔内嗜酸性分泌物为主。在GAED 中,实区则是由核深染的大细胞和丰富的透明胞浆和胞浆内过碘酸希夫反应阳性液滴组成,与HAS 的透明肝样区非常相似。因为它们的组织学特征有诸多重叠,这导致GAED 和HAS 之间的诊断区别是相对困难的。但新近发现,SALL4 在HAS 中呈弥散性强阳性,而在GAED 中呈异质性表达。综上AFP,SALL4,LIN28等免疫组化指标有助于HAS 的鉴别诊断[44-45]。在治疗方面,我们研究发现根治性手术治疗可以延长患者生存时间,降低死亡风险。虽然目前HAS 临床资料较少,但结合胃癌肝转移相关研究,根治性手术存在一定的选择偏倚,如选择肿瘤负荷小,更年轻的或者拥有其他更有利的特征患者进行手术,导致最终的结果可能更偏向于手术组[46]。但我们认为具有手术条件患者应当积极手术,同时伴随着积极化疗应当是能够带来生存获益。
HAS 是一种罕见特殊类型胃癌,本研究对近年我国HAS 文献报道的地域特点、疾病临床病理因素、治疗预后进行了荟萃分析。HAS 多被我国沿海地区报道,可能与地区发病存在差异、地区诊断水平及报道率有关。HAS 常伴有血清AFP 水平增高,高血清AFP 浓度患者易发生远处特别是肝脏的转移,预后差。因此早发现、早治疗以及提高对胃癌患者血清AFP 浓度对于改善HAS 预后具有重要意义,对于有条件的患者应当行根治性手术治疗。然而本研究仍有不足,因病例数少,文献报道具有选择偏倚,不同的研究者对病例随访时间不一,治疗方案可能也存在差异,这些都是本研究无法避免的缺陷。综上HAS 的发生发展机制、多学科综合诊断方案以及治疗研究上仍具有大量空白,值得进一步研究。
利益冲突:所有作者均声明不存在利益冲突。

