红瓤核桃JrMYB4和JrMYB306基因的克隆及表达分析
赵伟, 刘永辉, 章露露, 樊璐, 孟海军, 张港港, 李琳, 王磊, 吴国良
(河南农业大学园艺学院,河南 郑州 450002)
核桃(JuglansregiaL.)是一种全球性的经济果树,其种仁营养丰富,被誉为“超级食品”[1-2]。目前世界上主栽的核桃品种叶片、果皮多呈现绿色,种皮黄白色或黄褐色。中国核桃资源丰富,其中发现于太行山区域的红瓤核桃,其果皮、种皮及枝叶均呈红色,是核桃育种中稀有而珍贵的资源[3]。王克建等[4]研究表明,红瓤核桃呈现红色的主要原因是含有大量花青苷。李永洲等[5]通过UPLC-PDA-MS/MS定性和定量检测方法确定了红瓤核桃果皮和叶片中的主要花青苷类型。
花青苷是一种广泛存在于植物体内的天然色素,属于黄酮类化合物,在植物体内,由于花青苷的含量、种类不同会呈现不同的颜色[6-7]。花青苷生物合成是植物类黄酮合成途径的重要分支,目前大多数植物中花青苷通路中的合成酶及相关转录因子已经被分离鉴定[8-11]。其中MYB转录因子可以在多种植物中调节花青苷的生物合成。MYB转录因子是一个庞大且功能多样的家族,在所有真核生物中均有表达[12]。在拟南芥中,AtMYB113、AtMYB114、AtMYB75/PAP1和AtMYB90/PAP2基因调控花青苷生物合成[13],而AtMYB123/TT2在种皮中调节原花青苷的合成与积累[14]。
近年来,关于MYB基因参与果树花青苷代谢途径的研究日益增多。例如,油桃中的PpMYB10主要调控其果皮花青苷的合成[15],苹果中MdMYB9和MdMYB11参与茉莉酸诱导花青苷生物合成网络[16],梨PyMYB10通过调控花青苷生物合成途径中的结构基因表达,从而促进花青苷的积累[17-18]。然而,MYB基因在红瓤核桃花青苷生物合成与代谢中的功能和表达尚不清楚。本试验基于红瓤核桃和普通绿核桃不同发育时期果皮的转录组测序结果,对筛选获得的两个差异表达MYB基因进行同源克隆与生物信息分析,探究其在红、绿核桃内种皮及红瓤核桃自然杂交后代不同表型叶片(红叶和绿叶)中的表达情况,进一步通过亚细胞定位和转录激活活性分析验证其功能,为探明MYB转录因子调控红瓤核桃花青苷的生物合成机制提供理论基础。
1 材料与方法
1.1 试验材料
供试的植物材料为普通绿核桃‘中林一号’、红瓤核桃(JuglansregiaL. accession ‘RW-1’)内种皮及红瓤核桃2 a生自然杂交后代不同表型的红叶和绿叶,均定植于河南农业大学果树资源圃。依照红叶颜色变化过程,分别于叶片发育早期 (即幼叶期(2019-04-06), 叶片全红色)、叶片发育中期(即新梢旺长、果实迅速膨大期(2019-05-29),叶片红绿相间)、叶片发育后期(即果实成熟早期(2019-06-21),叶片成熟近于老化,趋于全绿色)采集红瓤核桃自然杂交后代性状分离的红、绿核桃叶片;在开花(2019-04-18)后60、90和120 d采集两种核桃的内种皮。取样后经液氮速冻,置于-80 ℃超低温冰箱中保存。
选用本氏烟草(NicotianatabacumL.)作为亚细胞定位的植物材料,在温度22 ℃、湿度60%、光照每天16 h的条件下, 培养5~6周后,用于试验。
1.2 RNA提取与cDNA合成
分别取普通绿核桃和红瓤核桃内种皮及红瓤核桃自然杂交后代不同表型红、绿叶片,经液氮速冻研磨后,采用改良的CTAB法分别提取普通绿核桃与红瓤核桃的内种皮及红瓤核桃自然杂交后代不同表型红、绿叶片总RNA[19]。用质量分数为1%的琼脂糖凝胶电泳检测其完整性,使用超微量分光光度计测定RNA浓度。按照Fast Quant RT One-Step gDNA Removal(TransGen,北京)说明书合成第一链cDNA,以备后续基因克隆和qRT-PCR分析。
1.3 JrMYBs基因CDS序列克隆
通过河南农业大学核桃育种课题组前期的转录组数据[4],筛选获得2个差异表达MYB基因MYB4(LOC108981042)、MYB306(LOC108980474)。使用Primer Premier 6.0设计特异引物,以红瓤核桃自然杂交后代不同表型叶片的cDNA为模板,克隆JrMYBs基因CDS序列,使用高保真酶进行PCR扩增。反应体系50 μL,其中KOD OneTMPCR Master Mix 25μL、 上游引物2 μL、下游引物2 μL、模板cDNA 2 μL、ddH2O 19 μL。反应程序:98 ℃ 3 min;98 ℃ 10 s,58 ℃ 10 s,72 ℃ 30 s,35个循环;72 ℃ 2 min。
1.4 JrMYBs生物信息学分析
使用TBtools软件对JrMYBs基因进行结构分析与染色体定位。运用NCBI的Blastp(https://blast.ncbi.nlm.nih.gov/Blast.cgi)分析2个MYB蛋白的保守结构域,并下载其他物种中的相似序列。通过DNAMAN和MEGA6.0软件进行多序列比对与系统进化分析。使用ProtParam(https://web.expasy.org/protparam/)在线软件分析2个MYB蛋白的氨基酸数、分子质量、理论等电点、不稳定指数、脂溶指数和总平均疏水性。在TMpred(https://embnet.vital-it.ch/software/TMPRED_form.html)网站上进行蛋白序列跨膜区分析。
1.5 JrMYBs亚细胞定位分析
根据SE无缝克隆和组装试剂盒(庄盟,北京)的说明书,利用同源重组和双酶切(XbaI/KpnI)的方法将不含终止密码子的JrMYB4/MYB306基因的ORF序列连接到含有GFP标签的pCAMBIA-super2300载体,构建GFP融合蛋白的瞬时表达载体。参照贺丹等[20]的方法,将测序检验正确的重组质粒转化至农杆菌GV3101后注射烟草叶片,培养3 d后取样在蔡司LSM 710激光扫描显微镜(Carl Zeiss AG,德国)下观察GFP信号。
1.6 JrMYBs转录激活活性分析
将JrMYB4/MYB306基因的ORF序列通过并双酶切(NdeI/PstI)克隆到pGBKT7载体中,构建。将包括pGADT7-T+pGBKT7-Lam(阴性对照)和pGADT7-T+pGBKT7-p53(阳性对照)的重组质粒通过LiAc介导的方法转化到酵母Y2HGold细胞中,详细步骤参照王磊[21]的方法,最终在SD/-Trp-Leu-His-Ade+X-α-Gal缺陷培养基上点斑检测转录激活活性。
1.7 JrMYBs基因在红、绿核桃不同组织发育过程中的表达分析
采用ChamQ Universal SYBR qPCR Master Mix 试剂盒(Vazyme,南京)于ABI(Applied Biosystems)7500 Fast检测系统进行qRT-PCR分析。以18 S rRNA(XM_019004991.1)作为内参基因。用2-ΔΔCt法分析JrMYBs基因不同核桃内种皮及红瓤核桃自然杂交后代不同表型叶片发育过程中的表达水平。引物由Primer Premier 6.0设计,引物序列见表1。

表1 核桃MYB基因克隆、表达及功能分析所用引物Table 1 The primers used in walnut MYB gene cloning,
1.8 数据分析
所有数据的采集和计算均设3组生物学重复。其中,利用IBM统计软件包SPSS 17.0和Excel 2007进行数据处理与统计分析;采用独立样本t检验 (P<0.05) 进行差异显著性分析。
2 结果与分析
2.1 JrMYBs基因的克隆和序列分析
根据PCR特异性引物,以红瓤核桃自然杂交后代子代红核桃和绿核桃叶片cDNA为模板,通过同源克隆获得核桃2个MYB基因JrMYB4和JrMYB306的CDS序列(图1-a)。JrMYB4和JrMYB306的全长CDS序列分别为846和1 047 bp。内含子-外显子结构分析结果表明,JrMYB4含有2个内含子,而JrMYB306仅含有1个内含子(图1-b)。根据核桃基因组对2个核桃JrMYBs基因进行染色体定位分析显示,JrMYB4定位于1号染色体上,而JrMYB306定位于3号染色体上(图1-c)。

a:JrMYB4和JrMYB306基因的CDS序列克隆。M:DL 2 000;1、3:以红瓤核桃自然杂交后代绿叶为模板分别扩增基因JrMYB4和JrMYB306产物;2、4:以红瓤核桃自然杂交后代红叶为模板分别扩增基因JrMYB4和JrMYB306产物。b:2个JrMYB基因内含子-外显子结构。c:2个JrMYB基因染色体定位。
2.2 JrMYBs蛋白序列分析
对JrMYB4和JrMYB306进行蛋白结构域分析显示(图2-a、2-b),JrMYB4转录因子N端含有典型的R2R3-MYB结合位点结构域,而JrMYB306转录因子含有R3-MYB结构域。序列比对结果发现,JrMYB4和JrMYB306转录因子蛋白序列在红瓤核桃自然杂交后代不同表型叶片之间均无差异,且JrMYB4蛋白序列与其他物种中花青苷生物合成相关MYB转录因子相似性较大,而JrMYB306在N端R2-MYB保守结构域发生了缺失突变。蛋白序列跨膜区预测结果表明(图2-c、2-d),JrMYB4和JrMYB306蛋白均不存在跨膜结构。
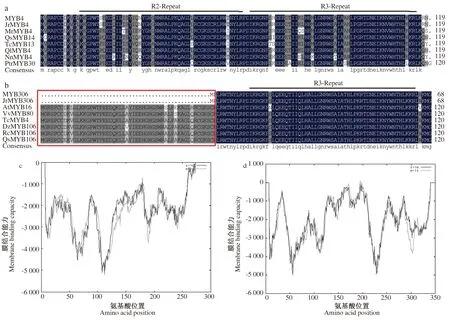
a:核桃JrMYB4与其他物种MYB蛋白序列比对。MYB4:红瓤核桃自然杂交后代红叶中MYB4蛋白序列;JrMYB4:红瓤核桃自然杂交后代绿叶中MYB4蛋白序列。b:核桃JrMYB306与其他物种MYB蛋白序列比对。MYB306:仁核桃自然杂交后代红叶中MYB306蛋白序列;JrMYB306:红瓤核桃自然杂交后代绿叶中MYB306蛋白序列序列。c、d:分别为核桃JrMYB4和JrMYB306蛋白的跨膜结构预测。
利用ProtParam tool在线工具分析显示(表2),JrMYB4蛋白由281个氨基酸组成,化学分子式为C1395H2125N383O439S13,理论等电点pI为5.11,相对分子质量为31.70 kD,不稳定系数为64.82(>50),脂肪系数为63.24,总负电荷残基(Asp+Glu)为35,总正电荷残基(Arg+Lys)数为25。JrMYB306蛋白由348个氨基酸组成,化学分子式为C1395H2125N383O439S13,理论等电点为5.62,相对分子质量分别为38.25 kD,不稳定系数为51.60(>50);脂肪系数为69.52;总负电荷残基(Asp+Glu)为38;总正电荷残基(Arg+Lys)数为41。此外,两个JrMYBs的总平均疏水指数(GRAVY)均为负值,故均为亲水性蛋白。
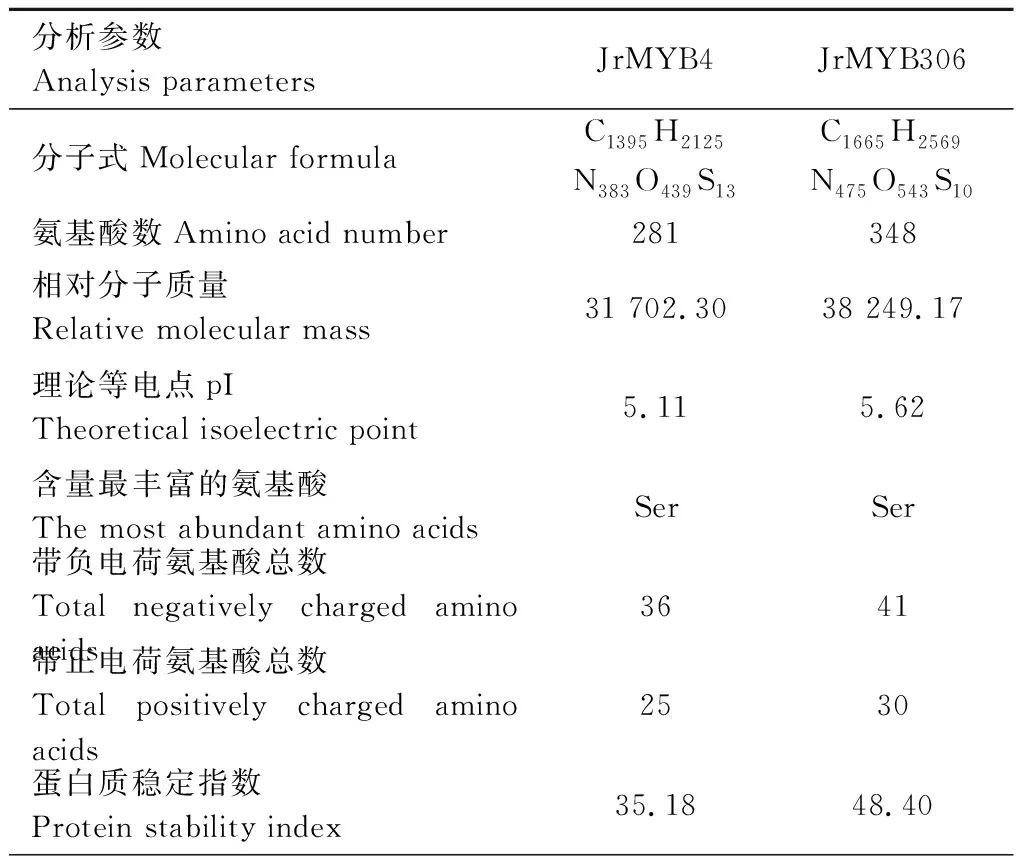
表2 JrMYBs蛋白理化性质分析Table 2 Analysis of physicochemical properties of
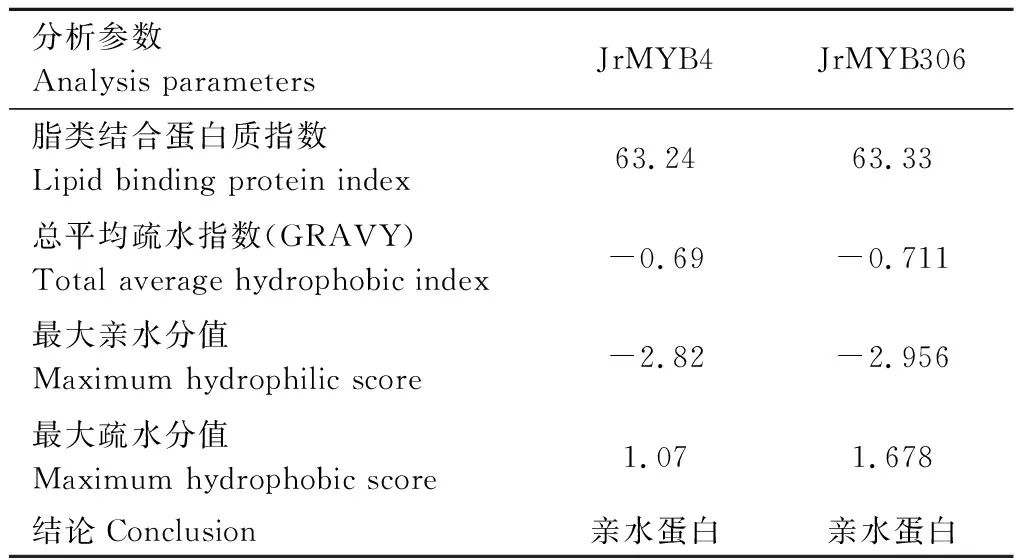
续表 Continuing table
2.3 JrMYBs蛋白系统进化分析
利用2个JrMYB蛋白与拟南芥(Arabidopsisthaliana,AtMYB3、AtMYB4、AtMYB12、AtMYB113、AtMYB114、AtPAP1、AtPAP2、AtTT2)、玉米(Zeamays,ZmMYBC1、ZmPI)、苹果(Malusdomestica,MdMYB1、MdMYB10、MdMYB17)、葡萄(Vitisvini-fera,VvMYB5a、VvMYBA1、VvMYBA2、VvMYBA7)、桃(Prunuspersica,PpMYB10、PpMYB16、PpMYB111)、草莓(Fragariaxananassa,FaMYB1、FaMYB10、FvMYB10)、桑树(Morusnotabilis,MnMYB4、MnMYB308、MnMYB330)、杨树(Populustrichocarpa,PtrMYB182)、柿(Diospyroskaki,DkMYB14、DkMYB15)、烟草(Nicotianatabacum,NtMYB2)、矮牵牛(Petuniahybrida,PhAN2)、胡萝卜(Daucuscarota,DcMYB1)等12个物种的32个花青苷合成相关MYB蛋白构建系统进化树。图3结果表明,核桃JrMYB4和JrMYB306蛋白均与MnMYB4、NtMYB2和DcMYB1亲缘关系较近。

AtMYB3(NP_195225)、AtMYB4(AAS10085)、AtMYB12(ABB03913)、AtMYB113(NP_176811)、AtMYB114(NP_176812)、AtPAP1(ABB03879)、AtPAP2(NP_176813)、AtTT2(NP_198405)DcMYB1(BAE54312)、DkMYB14(AVR54519)、DkMYB15(AVR54520)、FaMYB1(AAK84064)、FaMYB10(ABX79947)、FvMYB10(ABX79948)、MdMYB1(XP_028963316)、MdMYB10(DQ267896)、MdMYB17(ADL36757)、MnMYB4(XP_010107438)、MnMYB308(XP_010090332)、MnMYB330(XP_010104477)、NtMYB2(BAA88222)、PhAN2(ABO21074)、PpMYB10(ABX79945.1)、PpMYB16(ppa010277m)、PpMYB111(ppa010716m)、PtrMYB182(XP_002305872)、VvMYB5a(NP_001268108)、VvMYBA1(XP_010664911)、VvMYBA2(BAD18978)、VvMYBA7(ACI96116)、ZmMYBC1(AAA33482)、ZmPl(AAA19821)
2.4 核桃JrMYB4和JrMYB306基因在红、绿核桃不同组织发育过程中的表达分析
为探究JrMYB4和JrMYB306基因在红瓤核桃花青苷合成中的表达模式,对普通绿核桃与红瓤核桃内种皮以及红瓤核桃自然杂交后代不同表型叶片(红叶和绿叶)发育过程中的表达水平进行qRT-PCR分析(图4)。结果表明,对于普通绿核桃与红瓤核桃内种皮,JrMYB4在各时期红瓤核桃的表达量均高于普通绿核桃,而JrMYB306除在第1时期普通绿核桃中的表达量高于红瓤核桃外,在第2、3时期红瓤核桃中的表达量均显著较高。对于红瓤核桃自然杂交后代不同表型叶片,JrMYB4和JrMYB306的表达模式相似,均在第1、3时期的红叶中显著高于绿叶,而在第2时期二者的表达水平均表现为在红叶中较低。对于各组织不同发育时期,JrMYB4和JrMYB306在红瓤核桃内种皮中的表达量均呈持续上调趋势,而在普通绿核桃中JrMYB4的表达量逐渐下降,JrMYB306呈先上升后下降的趋势;JrMYB4和JrMYB306在红瓤核桃自然杂交后代不同表型叶片中的表达量均呈先下降后上升的趋势,而JrMYB4在绿叶中的表达量逐渐下降,JrMYB306呈先下降后上升的趋势。
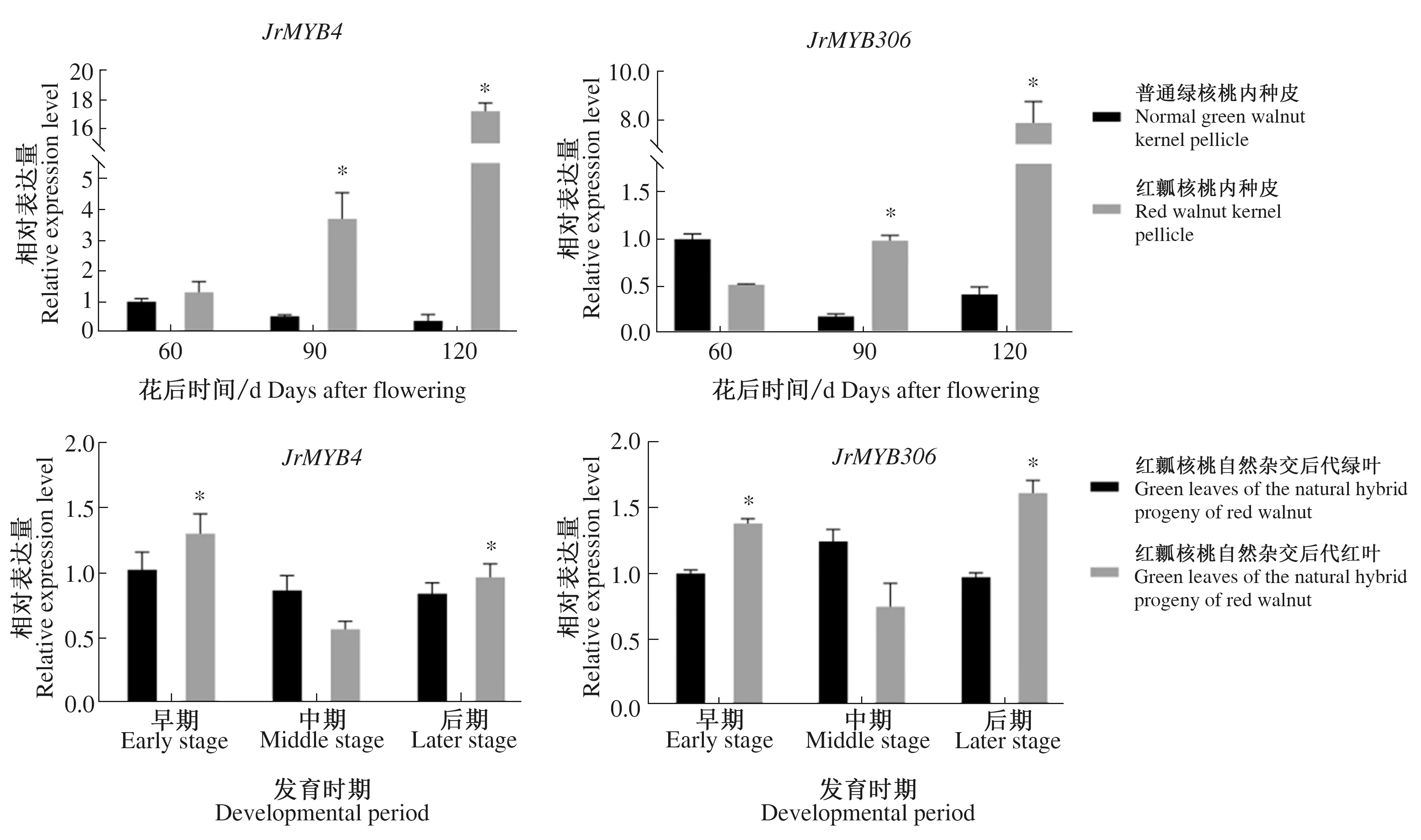
在同一时期的不同表型组织之间进行显著性差异比较。* P<0.05。
2.5 JrMYB4和JrMYB306亚细胞定位分析
为探究JrMYB4和JrMYB306在细胞中发挥功能的场所,分别将JrMYB4和JrMYB306基因的ORF序列构建到pCAMBIA-2300-35S-GFP载体上,并将重组质粒通过农杆菌介导法转化烟草叶片。结果显示(图4),空载pCAMBIA2300-GFP在整个细胞核和细胞质中均能检测到绿色荧光信号,而在含有35 S::JrMYB4-GFP和35 S::JrMYB306-GFP载体的细胞中均仅在细胞核中检测到荧光信号,表明JrMYB4和JrMYB306转录因子均定位于细胞核上,在细胞核中发挥功能作用(图5)。
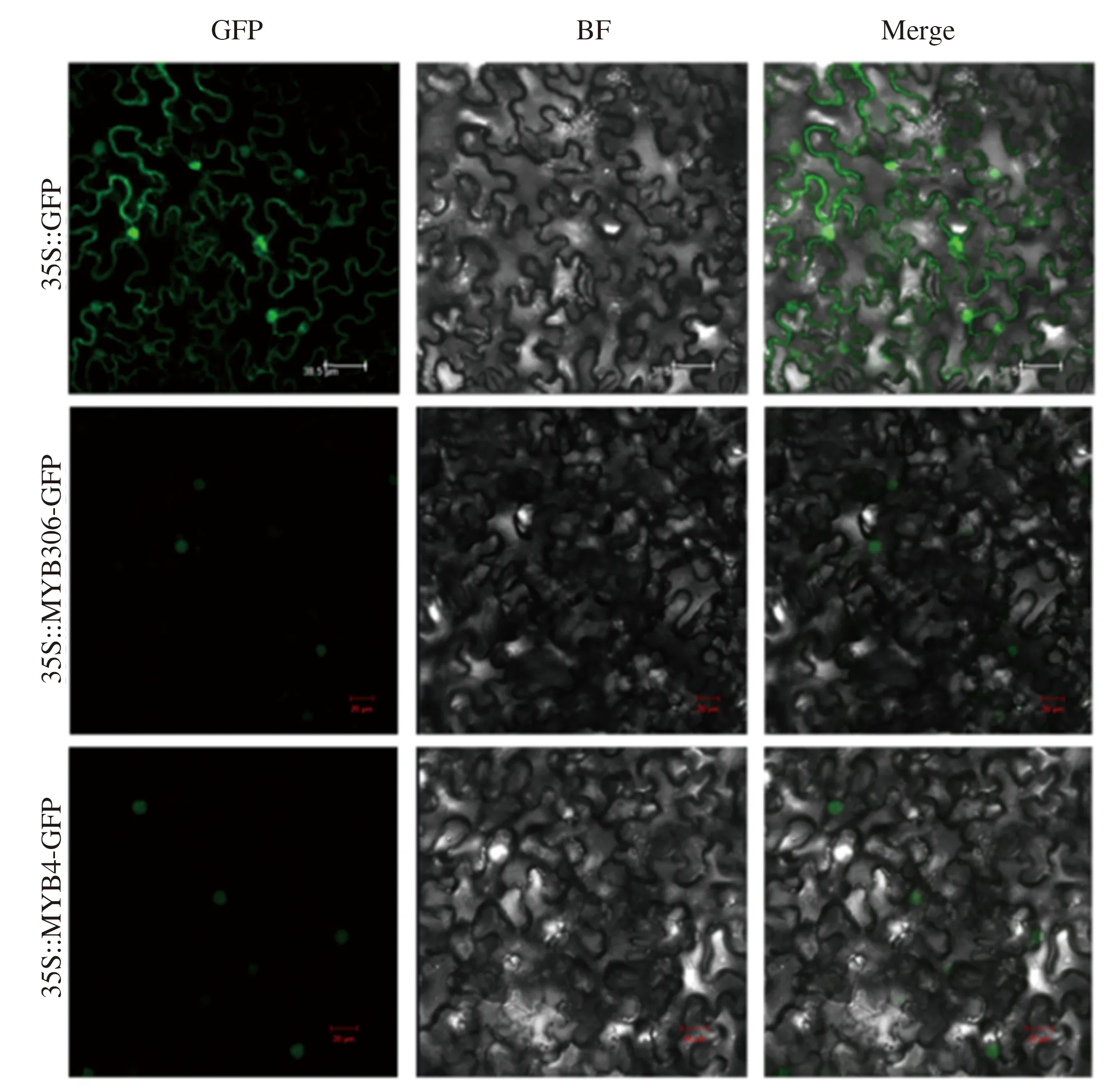
GFP:绿色荧光蛋白;BF:明场;Merge:混合场;标尺为38.5和20 μm。
2.6 JrMYB4和JrMYB306转录激活活性分析
将JrMYB4和JrMYB306基因的ORF序列分别构建到酵母pGBKT7载体中,获得JrMYB4-BD和JrMYB306-BD的融合载体,转化至酵母菌株Y2H后,在SD/-Trp-Leu-His-Ade+X-α-Gal四缺培养基上点斑培养。如图6所示,转化JrMYB4和JrMYB306的培养基上均有菌斑生长,其中JrMYB4显色较强,而JrMYB306显色较弱,表明二者均具有转录激活活性,但JrMYB306的活性较弱。
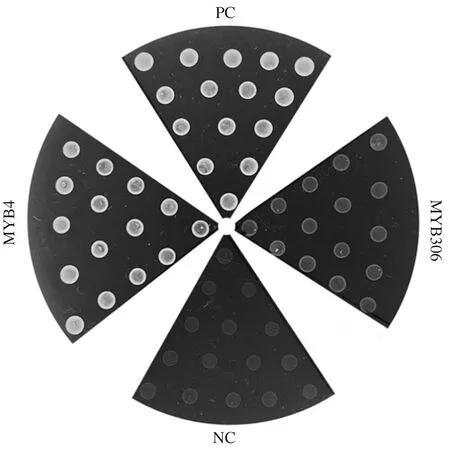
NC:阴性对照,pGADT7-T+pGBKT7-Lam;PC:阳性对照,pGADT7-T+pGBKT7-p53;MYB4:pGADT7-T+pGBKT7-JrMYB4;MYB306:pGADT7-T+pGBKT7-JrMYB306。
3 结论与讨论
本试验通过红瓤核桃与普通绿核桃果皮转录组数据筛选获得2个差异显著表达的MYB基因为JrMYB4和JrMYB306。对基因编码的蛋白结构分析,JrMYB4的氨基酸序列N端含有典型R2R3-MYB结构域,而JrMYB306的氨基酸序列仅存在R3型结构域。R2R3型MYB基因是众多调节基因中促进或抑制花青苷合成最重要的一类基因[22],当R保守结构域发生突变后可能引起转录因子的功能改变,即促进或抑制下游代谢途径中功能结构基因的表达量[23]。JrMYB306的N端R2保守结构域缺失,这种突变可能就是核桃花青苷积累的关键原因,在猕猴桃中有类似的结果[24]。系统进化树结果表明,JrMYB4和JrMYB306的蛋白序列与花青苷合成相关的桑树(Morusnotabilis)MnMYB4[25]、烟草(Nicotianatabacum)NtMYB2[26]和胡萝卜(Daucuscarota)DcMYB1[27]具有较高的相似性。
对2个JrMYB基因在不同颜色核桃不同组织发育过程中的表达分析发现,2个JrMYBs在不同颜色核桃组织各发育时期的表达水平较为相似。JrMYB4和JrMYB306在红瓤核桃内种皮花青苷合成过程中3个不同时期的表达量均逐渐上升且均在第2、3时期显著高于普通绿核桃;在红瓤核桃自然杂交后代不同表型叶片中,JrMYB4和JrMYB306均在颜色差异最大和基本保持稳定的的第1、3时期红叶中表达量显著较高,表明2个JrMYB基因的表达水平均与红瓤核桃颜色表型变化及其花青苷含量存在正相关关系,可能是正向调控花青苷合成与积累的关键转录因子。
亚细胞定位分析结果显示,JrMYB4和JrMYB306均定位于细胞核上,这与大部分的转录因子定位结果一致[28-29]。转录因子激活活性分析结果显示,JrMYB4具有较强的转录激活活性,而JrMYB306的转录激活活性较弱,这可能与其结构域缺失有关。已有研究表明,梨中PpMYB17转录因子通过激活类黄酮合成途径中结构基因的表达而正向调控果实中黄酮类化合物的合成与积累,分析发现PpMYB17是一个核蛋白且具有转录自激活活性[30]。
本研究初步推断JrMYB4和JrMYB306为红瓤核桃花青苷生物合成相关的关键差异表达基因,并为进一步验证其在花青苷合成与积累方面的作用奠定了基础。

