连作烟田健株与感染根腐病烟株根际土壤细菌群落多样性研究
敖金成 李永梅 李博

摘要:为探明连作与感染根腐病烟株根际土壤细菌群落结构变化,采用Illumina高通量技术对细菌16S rDNA的V3-V4区域进行测序,对比研究连作烟田健株与感染根腐病烟株根际土壤细菌群落结构。结果表明,变形菌门、放线菌门、浮霉菌门、酸杆菌门、芽单胞菌门、绿弯菌门是连作烟田健株和病株根际土壤主要的细菌优势种群,相对丰度累计总和为89.1%~93.9%,随连作年限的延长各优势种群发生趋向性变化;随连作年限的延长,健株根际土壤细菌群落丰富度和多样性呈先增后降趋势,病株根际土壤细菌群落丰富度和多样性呈降低趋势,短期连作(2~4 年)烟田健株和病株根际土壤细菌群落组成较为相似,与连作8年和撂荒2年以上(CK)土壤样本的细菌群落组成差异较大;冗余分析结果表明,土壤化学因子与细菌群落分布关联紧密,其中pH值是影响土壤细菌群落分布的核心因子,其贡献度为15.77%。综上,连作和染病降低了土壤细菌群落丰富度和多样性,优势菌群趋向性演化,有益菌群相对丰度降低。在生产实践中,提高烟田土壤pH值,降低连作年限并及时清除烟株病残体有利于维持土壤微生态环境的稳定性。
关键词:高通量测序;连作烟田;细菌群落;冗余分析;根际土壤;多样性分析
中图分类号: S154.36;S154.37文献标志码: A
文章编号:1002-1302(2022)04-0198-07
收稿日期:2021-05-26
基金项目:国家自然科学基金(编号:32060445、41807524);云南省自然科学基金(编号:202001AU070114);广西中烟工业有限责任公司科技项目(编号:GXZYCX2019b004)。
作者简介:敖金成(1984—),男,云南曲靖人,博士研究生,高级工程师,主要从事植物营养与病害控制技术研究。E-mail:89693180@qq.com。
通信作者:李永梅,博士,教授,博士生导师,主要从事植物营养与病害控制技术研究。E-mail:youngmaylee@126.com。
烤烟(Nicotiana tobacum L.)是云南重要的经济作物,是典型的忌连作作物。受土地资源短缺和其他经济作物种植面积的挤压,云南烤烟连作现象十分严重,多个核心烟区烤烟连作年限多在10年以上。连作引发许多土壤问题[1-4],加上近年来烟叶秸秆就地粉碎还田带来的弊端[5],致使连作烟田土传病害危害、烟叶产量和品质下降等问题持续加重。烟草病害一直是严重制约世界烟草生产和科研发展的重要难题[6]。在诸多的土传病害中,烟草镰刀菌根腐病是由镰刀菌属(Fusarium)病原菌引起的一種典型的土传病害,常与黑胫病、青枯病、黑根腐病复合发生,使得该病具有隐秘性、易混淆、难防治、危害重等特点,近年来全国各烟区发病率呈上升趋势。探寻有效防控烟草根腐病的方法,是促进烟草产业可持续发展的关键。
土壤细菌是土壤养分循环重要的驱动者[7],具有重要的生态功能[8-9]。连作可以改变根际细菌的群落结构,降低土壤细菌物种数和群落α多样性[10]。长期连作严重影响了土壤理化性质,进而显著降低了土壤细菌群落和组成多样性[11],并且土壤优势菌门的相对丰度和多样性存在时空异质性[12],反映了土壤微生态的复杂性,易受环境因子[13-14]、作物类型[15]、施肥[16]等因素的调控,因而了解土壤细菌群落结构及多样性对维持土壤生态功能具有重要意义。史普酉等研究指出,不同发病程度烟株根际细菌群落组成和结构发生趋向性变化,土壤生物多样性降低[17]。烟草镰刀菌根腐病发病烟株根际真菌群落多样性显著降低,病原菌相对丰度显著高于健康烟株[18]。郑元仙等研究也指出,烟株根际土壤真菌群落结构改变及物种多样性降低是根腐病发生的重要特征[19]。然而,关于土壤细菌群落结构及多样性对连作条件下烟株感染根腐病的响应特征鲜见报道。鉴于此,本研究以不同连作年限烟田健株和感染根腐病烟株根际土壤为研究对象,探索连作条件下健株和病株根际土壤细菌群落结构及多样性特征,以期为连作烟田烟草根腐病的科学防治提供参考依据。
1 材料与方法
1.1 连作土壤采集区概况
试验点位于云南省红河州泸西县(103°52′26″E,24°40′03″N),地处滇南低山丘陵烤烟区,地势平缓,多数栽烟区域海拔在1 100~1 600 m之间,热量条件优越,降水充沛,年均温为16.0~18.0℃,烤烟大田生育期降水量在1 000.0 mm左右,是云南省典型的清甜香风格烟叶核心产区,植烟历史悠久。2010—2020年间,试验地区域年均温为15.5 ℃,年均降水量为810.0 mm,年均日照时数为2 042.0 h,海拔为1 803.0 m。
1.2 样品采集
试验于2020年7月烤烟成熟期,选取2、4、8 年连作植烟地块,随机取健康(以下简称为“健株”)和感染根腐病烟株(以下简称为“病株”)各4株,去除地表杂物,然后将烟株整株挖起,去除根系外围土壤,采用抖根法采集根际土[20],轻轻抖落并收集须根2 mm范围内的土壤。对照(CK)为同区域撂荒2年以上未种植烤烟的土壤。每株烤烟根际土为1次重复,各4次重复。健株分别编号为HT2、HT4、HT8,病株分别编号为ST2、ST4、ST8。试验地块均为同一农户自己栽种,植烟历史可考证。供试烤烟品种为云烟87。
1.3 检测项目及方法
1.3.1 土壤化学性状 取样后将样品带回实验室,土壤经风干、磨细、过筛后备用。土壤有机质、碱解氮、速效磷、速效钾含量和pH值的测定参照文献[21]中的方法。
1.3.2 土壤细菌高通量测序 用于高通量测序的样本取样后立即放入冰盒带回实验室,于-80 ℃保存备用。基于Illumina高通量测序技术检测分析连作条件下烟田健株和感染根腐病烟株根际土壤细菌群落结构的丰度和多样性。
1.3.2.1 基因组DNA的提取 样本由广州基迪奥生物科技有限公司平台(https://www. Omic-smart.com)检测。采用HiPure Soil DNA Mini Kits(广州美基,中国,cat#3412)土壤DNA提取试剂盒进行土壤微生物DNA提取。首先在2 mL 珠管中加入0.25~0.50 g土壤样品和0.6 mL 缓冲溶液,利用涡旋仪(米欧mix-28+,广州围谷润仪器有限公司)充分匀浆裂解,然后70 ℃水浴10 min,并离心收集管壁上的液滴,然后加入200 μL 聚苯乙烯缓冲液 和150 μL 吸收溶液,涡旋混匀20 s,静置5 min后离心5 min,取上清液至2 mL离心管,加入等体积5′-二磷酸鸟苷二钠缓冲液,混匀,获得DNA柱。然后用1%琼脂糖(Biowest Agarose,西班牙)凝胶电泳(DYY-6C,北京市六一仪器厂)检测基因组DNA的完整性及是否发生蛋白等污染,DNA样品于 -80 ℃ 保存待用。
1.3.2.2 目的基因扩增及Illumina测序 采用具有条形码标记的引物341F:C C T A C G G G N G G T C W G C A G、806R:G G A C T A C H V G G G T A C T A A T对细菌16S rDNA 的V3-V4区进行MiSeq扩增子测序。第1轮扩增体系包括:10×Buffer KOD 5 μL,2 mmol/L dNTPs 5.0 μL,25 mmol/L MgSO4 3.0 μL,引物341F(10 μmol/L) 1.5 μL,引物806 R (10 μmol/L) 1.5 μL,KOD酶 1.0 μL,模板X μL(100 ng),用蒸馏水定容至 50 μL。然后利用AMPure XP Beads 进行PCR纯化,纯化后用Qubit 3.0定量。进入第二轮扩增,扩增体系包括:10×Buffer KOD 5 μL,2 mmol/L dNTPs 5.0 μL,25 mmol/L MgSO4 3.0 μL,索引引物(10 μmol/L)1 μL,PCR通用引物(10 μmol/L) 1 μL,KOD酶1 μL,模板 X μL(100 ng),再用蒸馏水定容至 50 μL。使用AMPure XP Beads 对第二轮扩增产物进行纯化,用ABI StepOnePlus Real-Time PCR System(Life Technologies,美国)进行定量,根据Novaseq 6000的样品要求规范化操作后,采用PE250模式上机测试。
1.4 数据分析
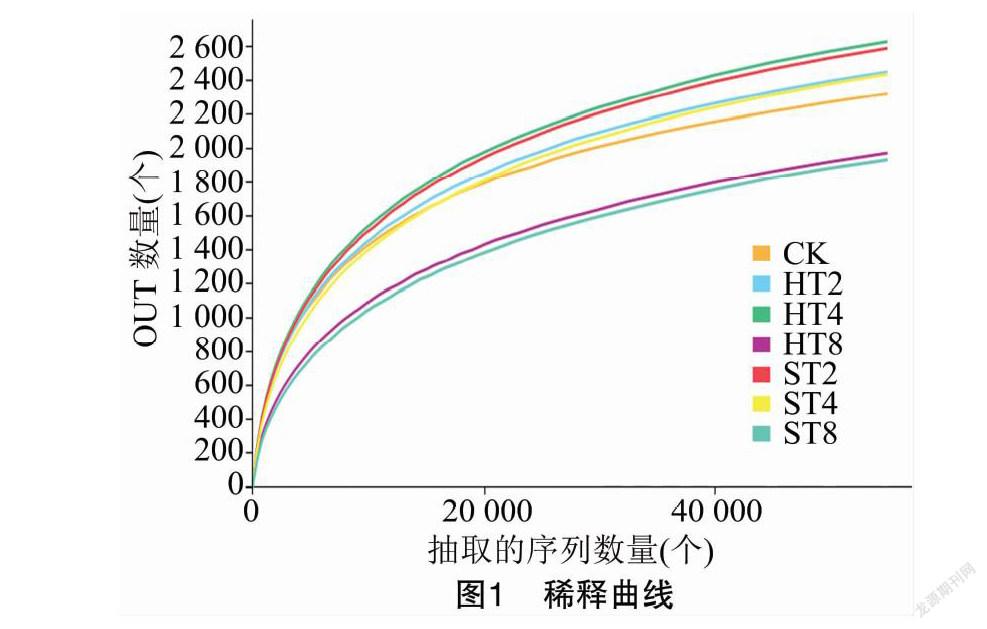
采用Microsoft Excel 2016进行数据处理,用IBM Statistics SPSS 19.0进行方差分析。利用软件平台Usearch(version 7.0)对相似度在97%条件下的操作分类单元(OUT)进行质控拼接和Tag聚类去嵌合体,获得OTU的丰度和OTU代表序列,生成稀释曲线,由图1可知,各样本的稀释曲线基本趋于平坦,说明本次测序数据量合理,能够比较真实地反映土壤样本的细菌群落。利用软件Mothur(version v.1.30.1)计算反映群落丰富度的Sobs指数、Chao1指数、Ace指数和反映群落多样性的Shannon-Wiener指数、Simpson指数。然后利用R语言vegan包进行群落柱状图的统计和作图,以及主坐标分析(principal coordinate analysis,简称PCoA)、非度量多维尺度分析(nonmetric multidimensional scaling,简称NMDS)、非加权组平均法(unweighted pair-group method with arithmetic means,简称UPGMA)分析,利用冗余分析(redundancy analysis,简称RDA)评价环境因子与细菌群落分布的关联性。
2 结果与分析
2.1 连作烟田健株和感染根腐病烟株根际土壤的化学性质
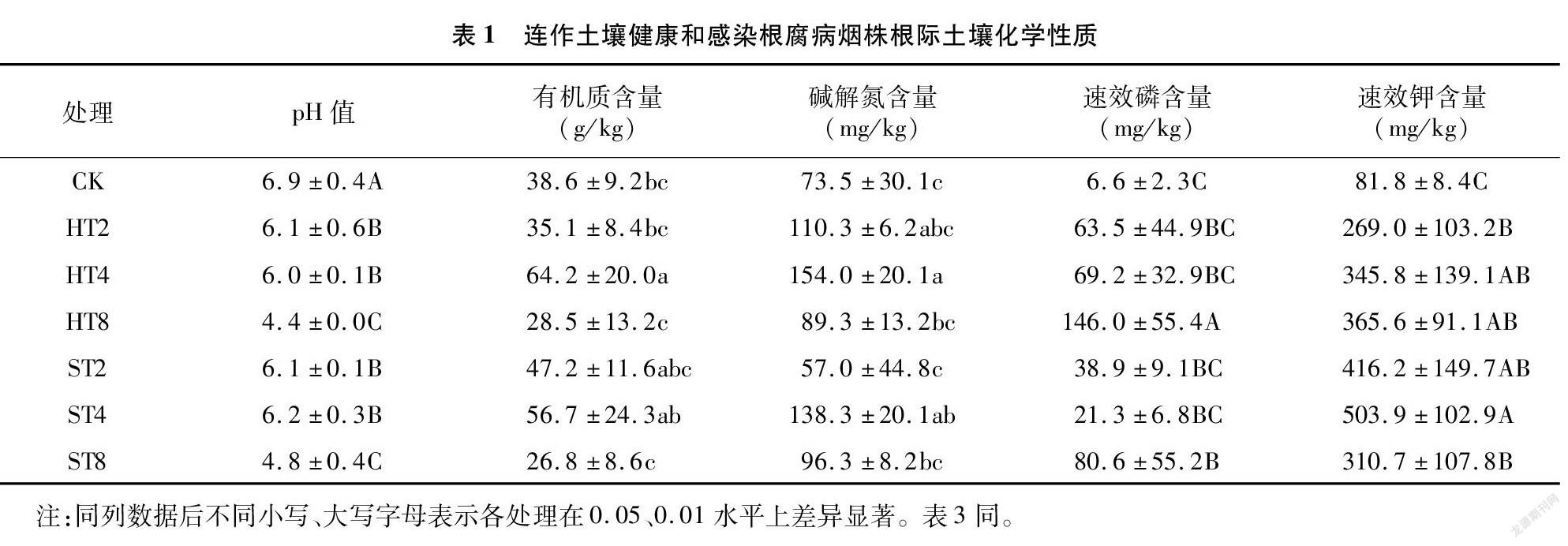
由表1可知,不同连作年限烟田健株和病株根际土壤样本的有机质、碱解氮、速效磷、速效钾含量及pH值存在显著(P<0.05)或极显著(P<0.01)差异。与CK相比,健株和病株根际土壤样本的pH值随连作年限增加极显著(P<0.01)降低,有机质和碱解氮含量呈先升后降的趋势,速效磷和速效钾含量呈极显著(P<0.01)增加的趋势。与CK相比,HT2、HT4和HT8样本的pH值分别下降0.8、0.9、2.5,ST2、ST4和ST8样本的pH值分别下降0.8、0.7、2.1。除连作8年烟田健株和病株根际土壤样本的有机质含量均低于CK外,其他处理显著高于CK或与CK一致。总体看,连作2年和连作4年烟田健株和病株根际土壤样本的土壤养分含量整体一致,而连作8年烟田健株和病株根际土壤样本的土壤pH值和有机质、碱解氮含量整体较低。健株根际土壤pH值整体低于染病烟株,但速效磷含量均明显高于染病烟株,短期连作(2~4年)烟田健株根际土壤样本的速效钾含量明显低于病株,连作8年的烟田则以健株稍高。
2.2 連作烟田健株和感染根腐病烟株根际土壤细菌群落组成分析
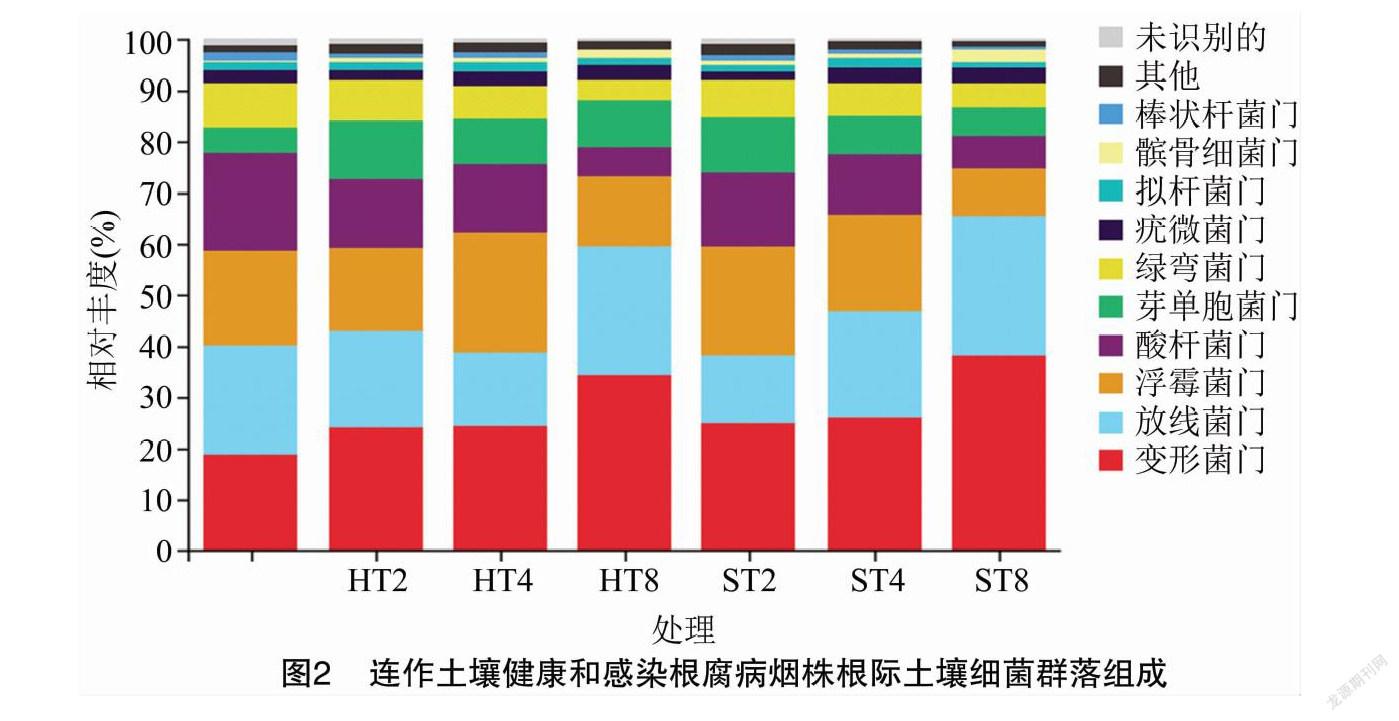
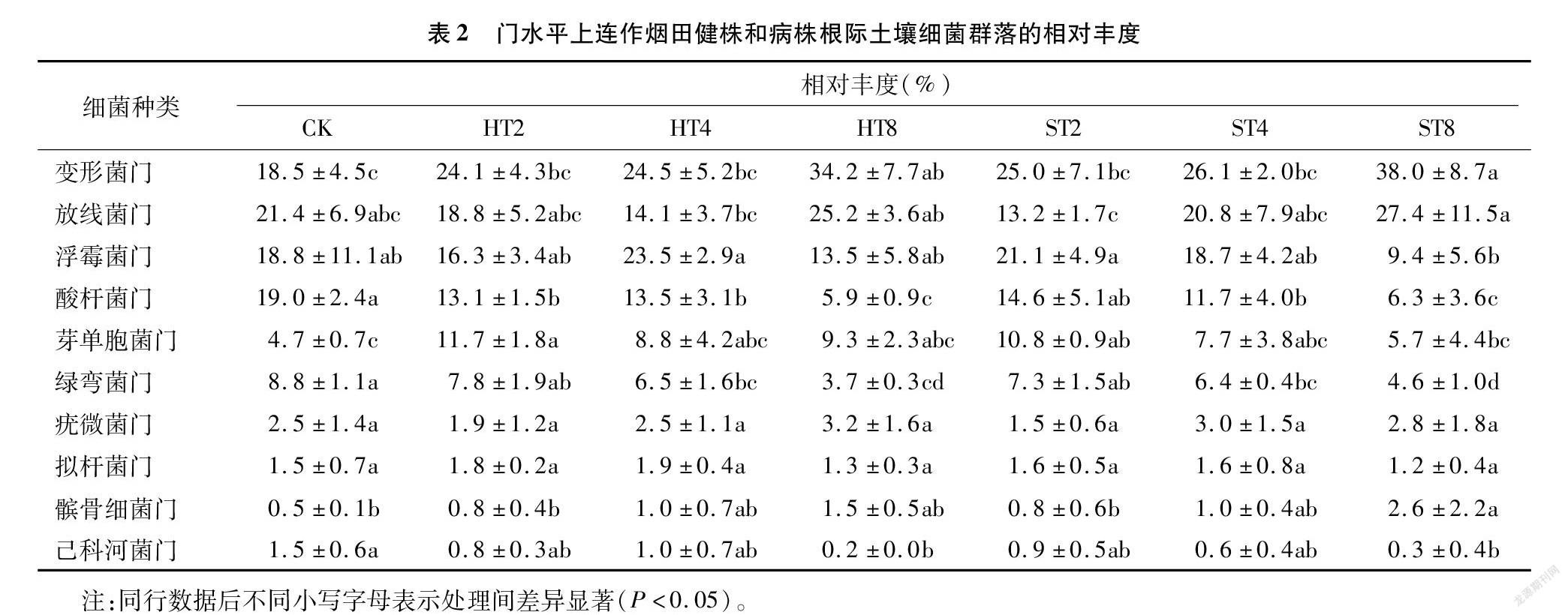
在门水平上,不同连作年限烟田健株和病株根际土壤细菌优势菌群相对丰度存在一定差异。由物种分布堆叠图(图2)和相对丰度值(表2)可以看出,变形菌门(Proteobactera)、放线菌门(Actinobacteria)、浮霉菌门(Planctomycetes)、酸杆菌门(Acidobacteria)、芽单胞菌门(Gemmatimonadetes)、绿弯菌门(Chloroflexi)是不同连作年限烟田健株和病株根际土壤的6个优势菌群,累积相对丰度总和为89.1%~93.9%。随连作年限的延长,HT2、HT4和HT8样本变形菌门和髌骨细菌门的相对丰度呈增加趋势,且均大于CK,放线菌门、芽单胞菌门的相对丰度呈先降后升趋势,浮霉菌门、酸杆菌门、拟杆菌门、己科河菌门的相对丰度呈先升后降趋势,绿弯菌门的相对丰度呈降低趋势。ST2、ST4和ST8样本的变形菌门、放线菌门、髌骨细菌门的相对丰度呈增加趋势,浮霉菌门、酸杆菌门、芽单胞菌门、绿弯菌门、拟杆菌门和己科河菌门的相对丰度呈降低趋势,仅疣微菌门的相对丰度呈先升后降趋势。
2.3 连作烟田健株和感染根腐病烟株根际土壤细菌群落的α多样性分析
Sobs指数是细菌群落丰富度的实际观测值,Ace指数和Chao1指数用于反映细菌群落丰富度,Shannon-Wiener指数用于反映群落多样性。由表3可知,连作烟田健株和病株根际土壤细菌群落丰富度和多样性存在差异。HT2、HT4和HT8样本的Sobs指数、Chao1指数和Ace指数及Shannon-Wiener指数均表现为随连作年限的增加呈先增后降的趋势,说明随连作年限的延长,连作烟田健株根际土壤细菌群落丰富度和多样性先增后降,其中HT8样本细菌群落丰富度和多样性均明显小于HT2和HT4样本。ST2、ST4和ST8样本的Sobs指数、Chao1指数和Ace指数及Shannon-Wiener指数均表现为随连作年限的增加呈降低趋势,说明随连作年限的延长,烟田病株根际土壤细菌群落的丰富度和多样性降低。健株和病株根际土壤样本间物种覆盖度均无显著性差异,均大于0.99,说明样本测序饱和度均较高。
2.4 连作烟田健株和感染根腐病烟株根际土壤细菌群落的β多样性分析
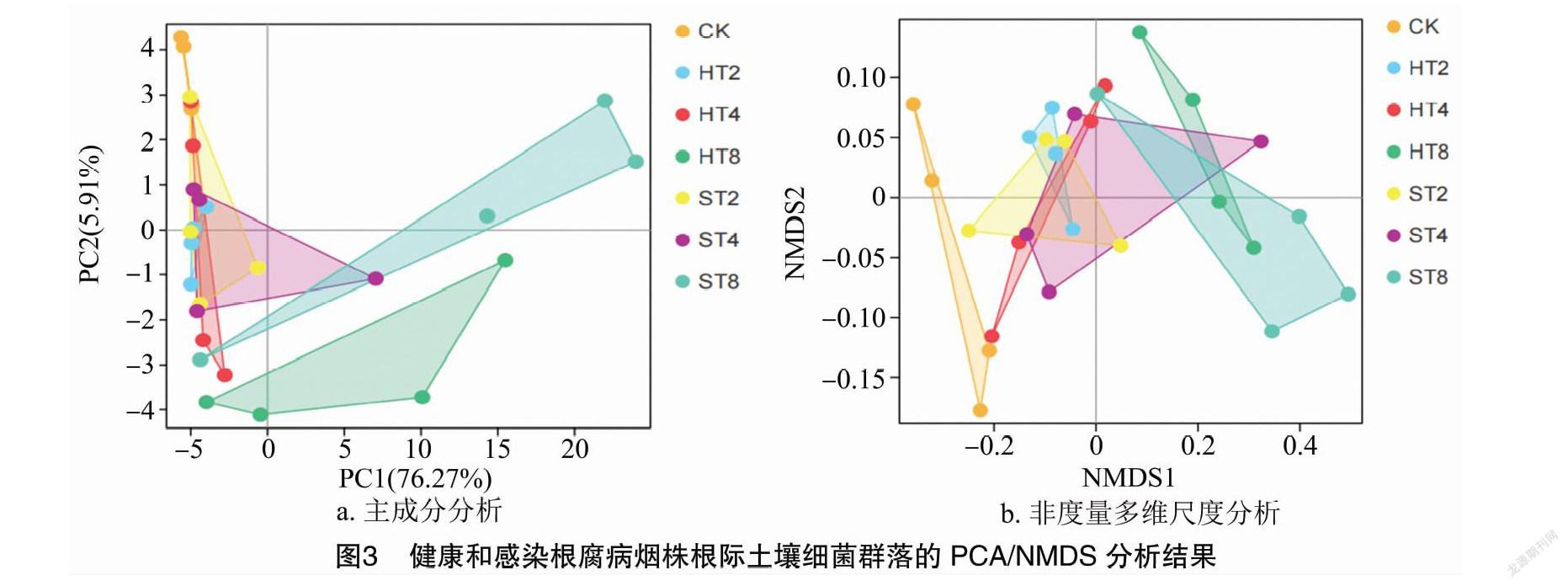
主成分分析(principal component analysis,简称PCA)和非度量多维尺度分析是基于OTU列表的物种丰度信息反映样本间群落组成距离关系的方法。PCA用于研究样本间的组成距离关系,NMDS分析可以更好地反映生态学数据的非线性结构,胁强系数(stress)越小(小于0.1较好),说明模型越可靠。从图3-a可以看出,第1主成分(PC1)和第2主成分(PC2)对样品差异的贡献值为82.18%,且PC1对样品差异的贡献值最高。NMDS分析结果(图3-b)显示,stress为0.050,小于0.1,说明模型可靠性高。图3-a和图3-b均表现出短期连作(2~4年)烟田的健株和病株样本距离较近,群落组成较相似,而与CK、HT8和ST8样本的距离较远,说明群落结构差异较大。进一步进行Anosim检验,结果表明,相同连作年限烟田健株和病株样本细菌群落组成无显著差异,但均与CK样本有显著差异(P<0.05)。3种连作年限的烟田健株(HT2、HT4和HT8)样本、病株(ST2、ST4和ST8)样本与CK样本之间,及HT2、HT4和HT8样本之间,ST2、ST4和ST8样本之间的细菌组成均有极显著差异(P<0.01)。
2.5 连作烟田健株和感染根腐病烟株根际土壤理化性质对细菌群落的影响
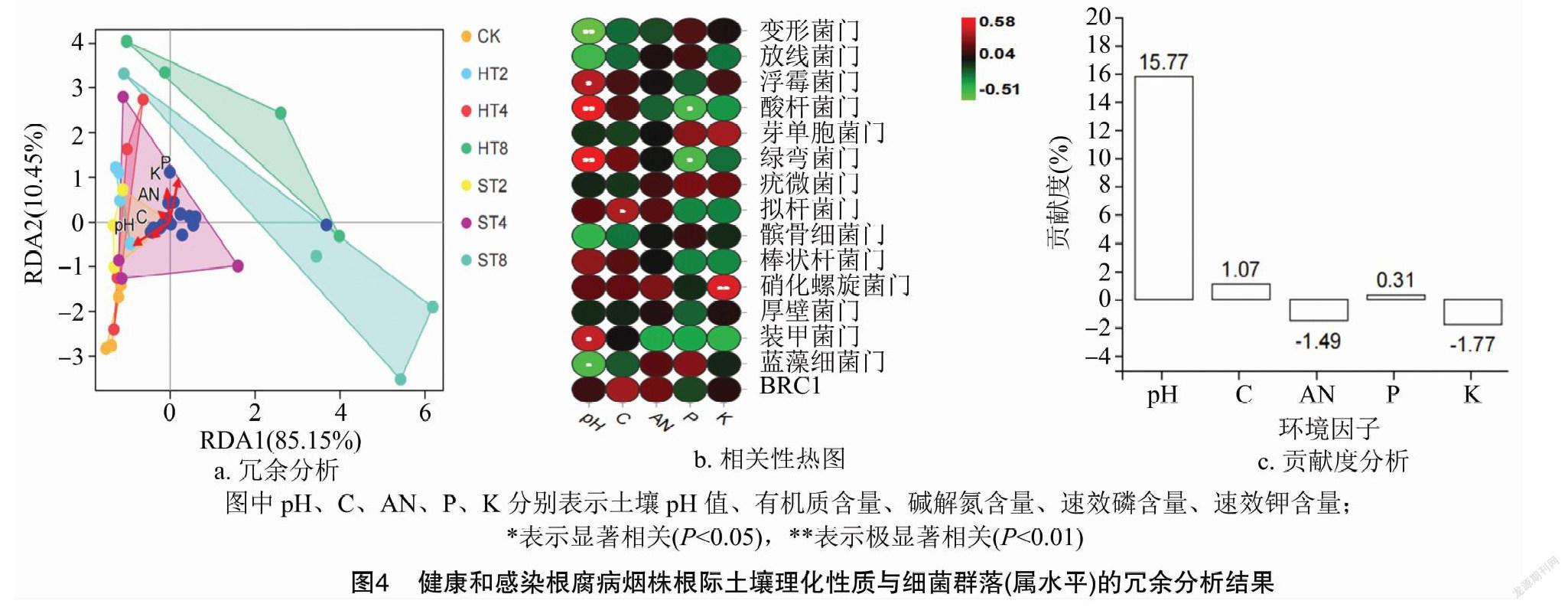
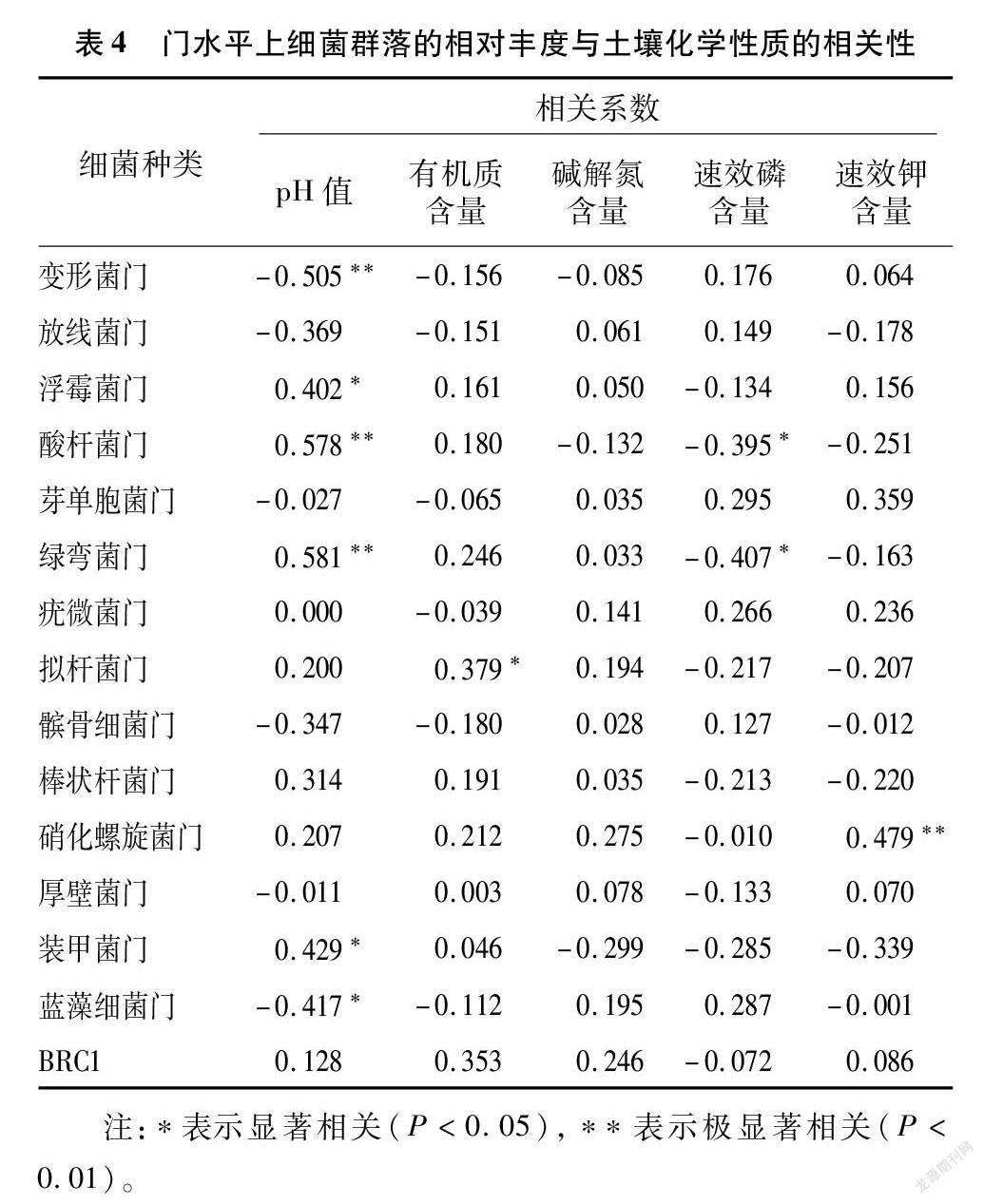
为了解土壤理化因子对连作烟田健株和病株根际土壤微生物群落分布的影响,在属水平上进行冗余分析。从图4-a可以看出,在属水平上,RDA的前2个轴总共解释了95.60%的群落变化,第1个轴和第2个轴分别解释了85.15%、10.45%的群落变化,说明观察样本聚类特征与分组一致。从图 4-b 和表4可以看出,在门水平上,土壤pH值与变形菌门的相对丰度呈极显著负相关关系(r=-0.505,P<0.01),与酸杆菌门(r=0.578,P<0.01)和绿弯菌门(r=0.581,P<0.01)的相对丰度呈极显著正相关关系,与浮霉菌门(r=0.402,P<0.05)和装甲菌门(r=0.429,P<0.05)的相对丰度呈显著正相关关系,与蓝藻细菌门的相对丰度呈显著负相关关系(r=-0.417,P<0.05);土壤有机质含量与拟杆菌门的相对丰度呈显著正相关关系(r=0.379,P<0.05);土壤碱解氮含量与细菌群落的相对丰度无显著相关性;速效磷含量与酸杆菌门(r=-0.395,P<0.05)和绿弯菌门(r=-0.407,P<0.05)的相对丰度呈显著负相关关系;土壤速效钾含量仅与硝化螺旋菌门的相对丰度呈极显著正相关关系(r=0.479,P<0.01)。从图4-c可以看出,在属水平上,根际土壤有机质、速效磷、速效钾含量及pH值对细菌群落的分布影响以pH值的贡献度(15.77%)最大,碱解氮和速效钾含量的贡献度为负值,表示对根际土壤细菌物种分布无意义。
3 讨论与结论
本研究结果表明,连作烟田健株与感染根腐病烟株根际土壤细菌群落的相对丰度及多样性存在差异。变形菌门、放线菌门、浮霉菌门、酸杆菌门、芽单胞菌门、绿弯菌门为几种连作烟田土壤健株和病株根际土壤的优势菌群。研究表明,变形菌门是最为普遍的细菌门[22],同时包含了大量的动植物致病菌[23],其丰度的增加可能引起土壤环境抗逆性降低,植株发病率增加。本试验中,随连作年限的增加,变形菌门的相对丰度呈明显增加的趋势,且感染根腐病烟株根际土壤变形菌门的相对丰度明显高于健株。试验中,除了连作2、4年的健株和连作2年的病株放线菌菌门相对丰度较低外,其余样本均较高,且表现出病株大于健株。说明随连作年限的延长,土壤变形菌门逐渐演化成优势菌群。绝大多数放线菌为腐生菌,但少数寄生性放线菌则能引起某些动植物的病害[24],其含量的高低可作为土壤健康状况的评价指标[25]。随连作年限的增加,总体上连作烟田健株和病株根烟株根际土壤酸杆菌门、绿弯菌门的相对丰度呈明显降低趋势,且整体表现为病株下降幅度大于健株。有研究认为,土壤细菌是环境变化的敏感指标,其组成和多样性与气温、降水以及土壤pH值、有机碳和全氮等含量密切相关[26],土壤微生物群落结构差异可指示土壤环境的变化[27]。岳思君等研究认为,引起硒砂瓜连作障碍的发生主要因素是随着连作时间的增加,放线菌门、绿弯菌门、酸杆菌门、厚壁菌门等有益微生物丰度下降造成的[28]。该研究说明随连作年限的延长,土壤细菌群落结构趋向性改变,土壤细菌性病原菌相对丰度可能增加,而细菌有益菌群落相對丰度降低。
有研究表明,土壤中微生物多样性越高、结构越复杂,系统的稳定性也越高[29]。试验中,烤烟短期连作(2~4年)烟田健株和病株根际土壤细菌群落丰度和多样性较高,群落组成较为相近,与撂荒土壤(CK)的距离较远,而连作8年烟田健株(ST8)和病株(ST8)根际土壤细菌群落相对丰度和多样性均显著减小。说明随连作年限的延长,土壤微生态稳定性降低,进而影响土壤系统抗性。土传病害的发生与土壤环境密切相关[30-31],土壤微生物与植物健康的相互关系研究备受关注。土壤微生物尤其是根际微生物的组成、结构、多样性和生态网络关系与植物土传病害的发生密切相关[32-35]。汪洋等综述了农田管理措施对土壤微生物的影响,认为提高有机肥和磷肥的施用比例有利于土壤中微生物丰富度的提高和微生物量碳的积累[36]。纳小凡等研究认为,因为土壤pH值是影响微生物群落结构组成最重要的因素之一[10],本试验中根际土壤pH值对健株和病株根际土壤细菌群落分布影响最大,说明pH值是影响细菌群落分布及丰富度的核心环境因子。本研究的供试土壤随连作年限的延长,pH值明显降低。因而针对连作植烟地块,生产中可通过撒施生石灰,增施有机肥、生物质炭、过磷酸钙等方式以提高连作土壤pH值,进而改善连作土壤微生态环境。
综上所述,本研究利用Illumina高通量测序技术探明了连作烟田健株和感染根腐病烟株根际土壤细菌群落结构和多样性的变化,为连作烟田烤烟根腐病的防治及土壤改良提供了借鉴。然而本研究只关注了连作烟田健株和病株根际细菌群落的丰富度、多样性及其细菌群落与连作土壤理化因子的关联性,未探明根腐病发病与相关细菌菌群的相关性,以及真菌群落丰富度、多样性的变化情况,在今后的研究中将加以完善。
参考文献:
[1]孙敬国,王昌军,孙光伟,等. 连作年限对植烟根际土壤化感物质积累的影响——以湖北黄棕壤烟田为例[J]. 土壤,2021,53(1):148-153.
[2]程亚东,白羽祥,史普酉,等. 连作植烟土壤具有显著积累特征的两种酚酸的化感效应评价[J]. 核农学报,2020,34(10):2307-2315.
[3]岳冰冰,李 鑫,张会慧,等. 连作对黑龙江烤烟土壤生物功能多样性的影响[J]. 土壤,2013,45(1):116-119.
[4]何 川,刘国顺,李祖良,等. 连作植烟土壤有机碳和酶活性的影响及其与土传病害的关系[J]. 河南农业大学学报,2011,45(6):701-705.
[5]闫 宁,郭东锋,姚忠达,等. 烟杆还田对烟草生长、产量、质量及病毒病发生的影响[J]. 江西农业学报,2016,28(7):68-72.
[6]高福宏,陈 静,陶 琼,等. 2011年昆明市烟草主要病害发生特点[J]. 植物保护,2013,35(2):158-164.
[7]Gabriel C,Paulo J P L T,Sur H P,et al. Root microbiota drive direct integration of phosphate stress and immunity[J]. Nature,2017,543(7646):513-518.
[8]Li J Y,Zhang Q C,Li Yong,et al. Effects of long-term mowing on the fractions and chemical composition of soil organic matter in a semiarid grassland[J]. Biogeosciences,2017,14(10):2685-2696.
[9]Bulgarelli D,Schlaeppi K,Spaepen S,et al. Structure and functions of the bacterial microbiota of plants[J]. Annual Review of Plant Biology,2013,64(1):807-838.
[10]纳小凡,郑国旗,刑正操,等. 连作对再植枸杞根际细菌群落多样性和群落结构的影响[J]. 土壤学报,2017,54(5):1280-1292.
[11]寇智瑞,周鑫斌. 不同连作年限黄壤烟田土壤细菌群落的差异[J]. 植物营养与肥料学报,2020,26(3):511-521.
[12]敖金成,李 博,阎 凯,等. 连作对云南典型烟区植烟土壤细菌群落多样性的影响[J]. 农业资源与环境学报,2022,39(1):46-54.
[13]Sheng R,Meng D L,Wu M N,et al. Effect of agricultural land use change on community composition of bacteria and ammonia oxidizers[J]. Journal of Soil and Sediments,2013,13(7):1246-1256.
[14]Van Horn D J,Van Horn M L,Barrett J E,et al. Factors controlling soil microbial biomass and bacterial diversity and community composition in a cold desert ecosystem:Role of geographic scale[J]. PLoS One,2013,8(6):e66103.
[15]Marques J M,da Silva T F,Vollu R E,et al. Plant age and genotype affect the bacterial community composition in the tuber rhizosphere of filed-grown sweet potato plants[J]. FENS Microbiology Ecology,2014,88(2):424-433.
[16]顧美英,刘洪亮,李志强,等. 新疆连作棉田施用生物炭对土壤养分及微生物群落多样性的影响[J]. 中国农业科学,2014,47(20):4128-4138.
[17]史普酉,杨成翠,贾 孟,等. 不同黑胫病发病程度下植烟根际土壤酶活性及细菌群落结构差异比较[J]. 中国土壤与肥料,2020(1):179-187.
[18]李朋发,杨 龙,李桂龙,等. 基于FUNGuild的镰刀菌根腐病发病烟株根际真菌群落研究[J]. 中国烟草学报,2019,25(2):63-68.
[19]郑元仙,杨 敏,王继明,等. 烤烟根腐病对烟株根际土壤真菌群落结构的影响[J]. 中国烟草科学,2021,42(2):50-55.
[20]Epelde L,Becerril J M,Hernandez-Allica J,et al. Functional diversity as indicator of the recovery of soil health from Thlaspi caerulescens growth and metal phytoextraction[J]. Applied Soil Ecology,2008,39(3):299-310.
[21]鲍士旦. 土壤农化分析[M]. 北京:中国农业出版社,2000.
[22]许艳蕊,方志军,卢晓平,等. 基于高通量测序技术分析使它隆对玉米土壤细菌多样性的影响[J]. 微生物学报,2017,57(7):985-993.
[23]Wagg C,Dudenhffer J H,Widmer F,et al. Linking diversity,synchrony and stability in soil microbial communities[J]. Functional Ecology,2018,32(5):1280-1292.
[24]李文均,职晓阳,唐蜀昆. 我国放线菌系统学研究历史、现状及未来发展趋势[J]. 微生物学通报,2013,40(10):1860-1873.
[25]张亚培,张嫣芸,李梅梅,等. 变形菌多重耐药性与整合子相关性分析[J]. 中国抗生素杂质,2015,40(2):141-144.
[26]Van Veen J A,Ladd J N,Amato M. Turnover of carbon and nitrogen through the microbial biomass in a sandy loam and a clay soil incubated wtih[14C(U)]glucose and[15N](NH4)2SO4 under different moisture regimes[J]. Soil Biology and Biochemistry,1985,17(6):747-756.
[27]李 飞,刘振恒,贾甜华,等. 高寒湿地和草甸退化及恢复对土壤微生物碳代谢功能多样性的影响[J]. 生态学报,2018,38(17):6006-6015.
[28]岳思君,冯翠娥,杨彦研,等. 不同连作年限硒砂瓜土壤细菌群落结构特征[J]. 干旱地区农业研究,2020,38(1):230-236.
[29]贺纪正,李 晶,郑袁明. 土壤生态系统微生物多样性-稳定性关系的思考[J]. 生物多样性,2013,21(4):412-421.
[30]王 弋,杨焕文,赵正雄,等. 不同抗性烤烟品种根际微生物数量及多样性差异研究[J]. 植物营养与肥料学报,2012,18(2):451-458.
[31]Benizri E,Piutti S,Verger S,et al. Replant diseases:bacterial community structure and diversity in peach rhizosphere as determined by metabolic and genetic fingerprinting[J]. Soil Biology & Biochemistry,2005,537(9):1738-1746.
[32]Niu L,Chan J,Xiao Y,et al. Insight into the effects of different cropping systems on soil bacterial community and tobacco bacterial wilt rate[J]. J Basic Microbiol,2017,57(1):3-11.
[33]Latz E,Eisenhauer N,Rall B C,et al. Unravelling linkages between plant community composition and the pathogen-suppressive potential of soils[J]. Scientific Reports,2016,6(1):23584.
[34]Niu J,Rang Z,Zhang C,et al. The succession pattern of soil microbial communities and its relationship with tobacco bacterial wilt[J]. BMC Microbiology,2016,16(1):1-10.
[35]李 赟,劉 迪,范如芹,等. 土壤改良剂的研究进展[J]. 江苏农业科学,2020,48(10):63-69.
[36]汪 洋,杨殿林,王丽丽,等. 农田管理措施对土壤有机碳周转及微生物量的影响[J]. 农业资源与环境学报,2020,37(3):340-352.
3761501908218

